- 2021-08-06 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届江西师范大学附属中学高二上学期第一次月考化学试卷 (解析版)
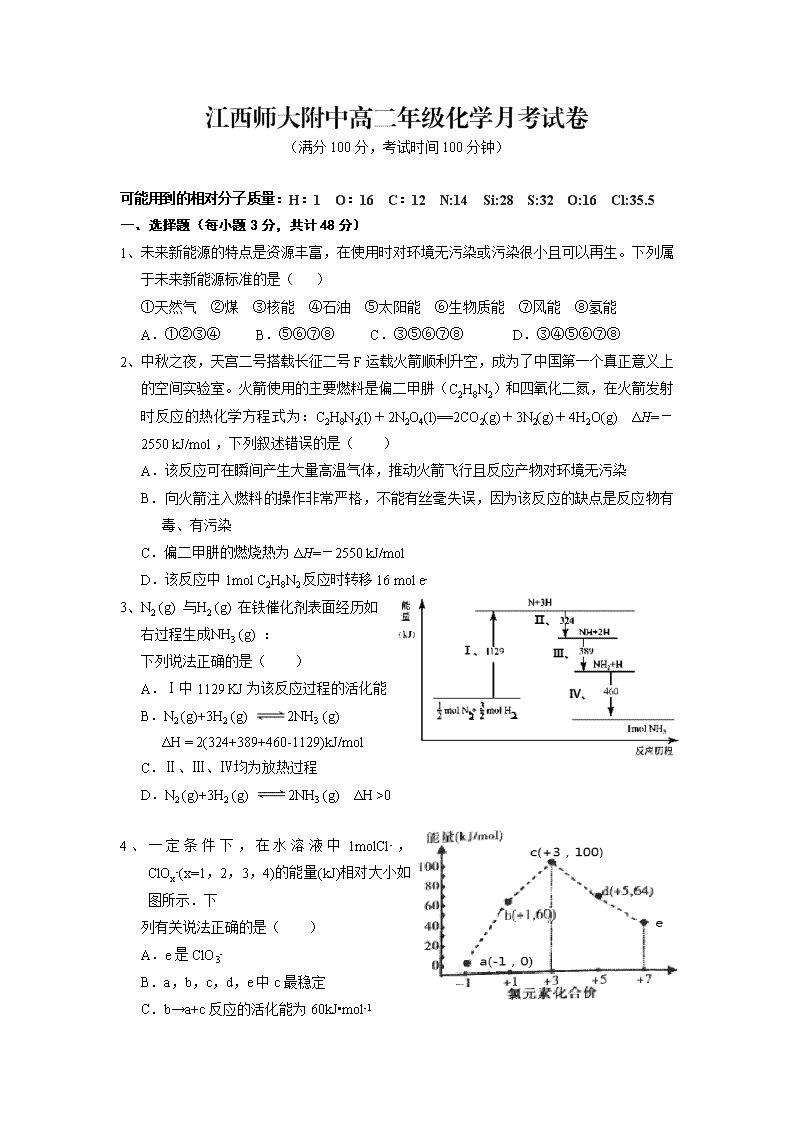
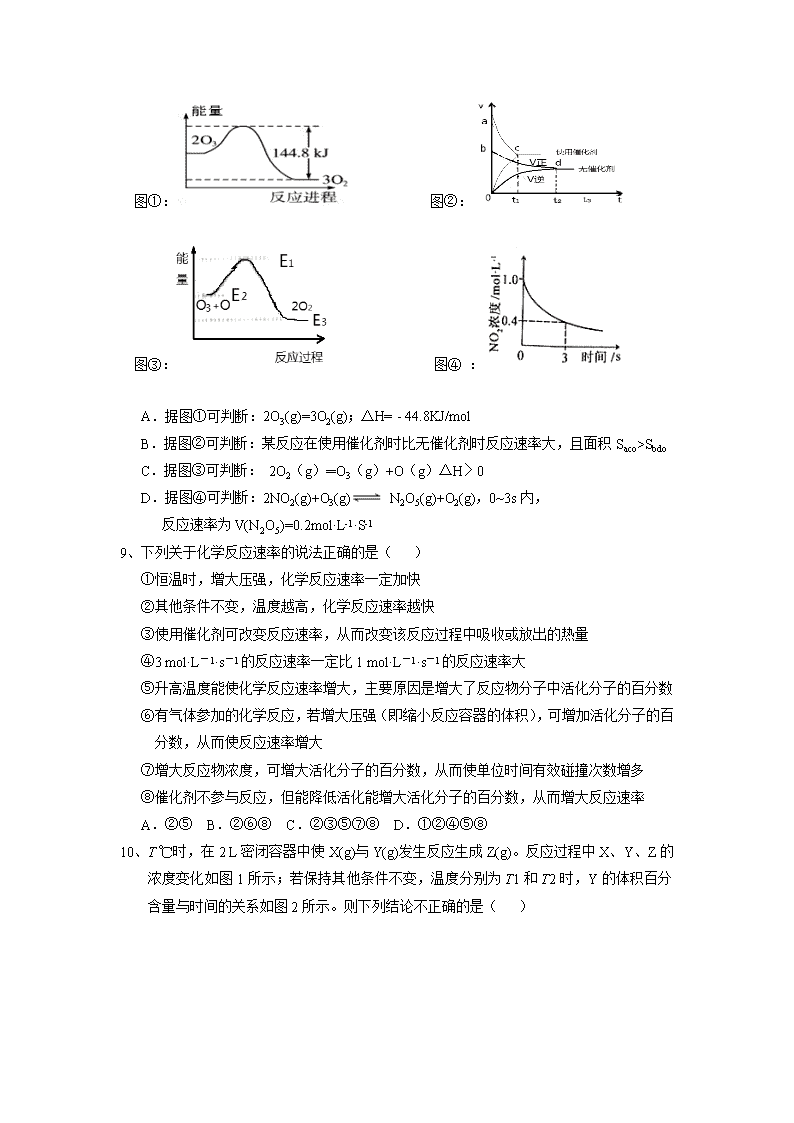
江西师大附中高二年级化学月考试卷【来.源:全,品…中&高*考*网】 (满分100分,考试时间100分钟) 可能用到的相对分子质量:H:1 O:16 C:12 N:14 Si:28 S:32 O:16 Cl:35.5 一、选择题(每小题3分,共计48分) 1、未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小且可以再生。下列属于未来新能源标准的是( ) ①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能 A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧ 2、中秋之夜,天宫二号搭载长征二号F运载火箭顺利升空,成为了中国第一个真正意义上的空间实验室。火箭使用的主要燃料是偏二甲肼(C2H8N2)和四氧化二氮,在火箭发射时反应的热化学方程式为:C2H8N2(l)+2N2O4(l)==2CO2(g)+3N2(g)+4H2O(g) ΔH=-2550 kJ/mol ,下列叙述错误的是( ) A.该反应可在瞬间产生大量高温气体,推动火箭飞行且反应产物对环境无污染 B.向火箭注入燃料的操作非常严格,不能有丝毫失误,因为该反应的缺点是反应物有毒、有污染 C.偏二甲肼的燃烧热为ΔH=-2550 kJ/mol D.该反应中1mol C2H8N2反应时转移16 mol e- 3、N2 (g) 与H2 (g) 在铁催化剂表面经历如右过程生成NH3 (g) : 下列说法正确的是( ) A.Ⅰ中1129 KJ为该反应过程的活化能 【来.源:全,品…中&高*考*网】 B.N2 (g)+3H2 (g) 2NH3 (g) ΔH = 2(324+389+460-1129)kJ/mol C.Ⅱ、Ⅲ、Ⅳ均为放热过程 D.N2 (g)+3H2 (g) 2NH3 (g) ΔH >0 4、一定条件下,在水溶液中1molCl-,ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示.下 列有关说法正确的是( ) A.e是ClO3- B.a,b,c,d,e中c最稳定 C.b→a+c反应的活化能为60kJ•mol-1 【来.源:全,品…中&高*考*网】 D.b→a+d反应的热化学方程式为 3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H= -116kJ•mol-1 5、在不同浓度(c)、温度(T)条件下,蔗糖发生水解反应(已知水解反应为吸热反应)的瞬时速率(v)如下表。下列判断不正确的是( ) c/mol/L v/mmol/(L · min) T/K 0.600 0.500 0.400 0.300 318.2 3.60 3.00 2.40 1.80 328.2 9.00 7.50 a 4.50 b 2.16 1.80 1.44 1.08 A.a=6.00 B.不同温度时,蔗糖浓度减少一半所需的时间相同 C.b<318.2 D.同时改变反应温度和蔗糖的浓度,v可能不变 6、可逆反应:2NO22NO+O2在定容密闭容器中反应,达到平衡状态的标志是( ) ①单位时间内生成n mol O2的同时生成2 nmolNO2 ②单位时间内生成n mol O2的同时生成2 nmolNO ③用NO2、NO 、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态 ⑧NO2 、NO、O2的分子数之比为2:2:1的状态 A.①③④⑦ B. ②③⑤⑦ C. ①④⑥⑦ D. ①②③④⑤⑥ 7、用CH4催化还原NOX可以消除氮氧化物的污染.例如: ①CH4(g)+ 4NO2(g)= 4NO(g)+ CO2(g)+ 2H2O(g)△H1 ②CH4(g)+ 4NO(g)= 2N2(g)+ CO2(g)+ 2H2O(g) △H2 = -1160kJ•mol-1 已知NO、 NO2混合气体的密度是相同条件下氢气密度的17倍,16g甲烷和该混合气体恰好完全反应生成N2、 CO2、H2O(g)放出1042.8 kJ的热量,则△H1是( ) A.-574kJ•mol-1 B.-691.2kJ•mol-1 C.-867kJ•mol-1 D.-925.6kJ•mol-1 8、关于下列图象及其相关说法正确的是( ) 图①: 图②: 图③: 图④ : A.据图①可判断:2O3(g)=3O2(g);△H= - 44.8KJ/mol B.据图②可判断:某反应在使用催化剂时比无催化剂时反应速率大,且面积Saco>Sbdo C.据图③可判断: 2O2(g)═O3(g)+O(g)△H〉0 D.据图④可判断:2NO2(g)+O3(g) N2O5(g)+O2(g),0~3s内, 反应速率为V(N2O5)=0.2mol·L-1·S-1 9、下列关于化学反应速率的说法正确的是( ) ①恒温时,增大压强,化学反应速率一定加快 ②其他条件不变,温度越高,化学反应速率越快 ③使用催化剂可改变反应速率,从而改变该反应过程中吸收或放出的热量 ④3 mol·L-1·s-1的反应速率一定比1 mol·L-1·s-1的反应速率大 ⑤升高温度能使化学反应速率增大,主要原因是增大了反应物分子中活化分子的百分数 ⑥有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 ⑦增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多 ⑧催化剂不参与反应,但能降低活化能增大活化分子的百分数,从而增大反应速率 A.②⑤ B.②⑥⑧ C.②③⑤⑦⑧ D.①②④⑤⑧ 10、T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化【来.源:全,品…中&高*考*网】如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论不正确的是( )【来.源:全,品…中&高*考*网】 A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) B.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L·min) C.据图2可知,相对于T1,温度为T2时更快达到“拐点”,说明T2时化学反应速率更快,可确定温度T2高于T1 D.若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂 11、把下列四种X溶液分别加入盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( ) A.10℃20 mL 3 moL·L-1的X溶液 B.10℃10 mL 2 moL·L-1的X溶液 C.20℃10 mL 5 moL·L-1的X溶液 D.20℃30 mL 2 moL·L-1的X溶液 12、可逆反应A(g)+3B(g)⇌2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( ) A.VA=0.15mol•(L•min)﹣1 B.VB=0.6 mol•(L•min)﹣1 C.VC=0.4 mol•(L•min)﹣1 D.VD=0.01 mol•(L•s)﹣1 13、选修四化学反应原理主要研究:化学反应进行的方向、快慢、程度以及反应过程中能量转化等内容。下列有关说法错误的是( ) A.化学变化中,遵循能量守恒,所谓吸热反应可看作把环境中的能量储存到了物质中 B.化学变化中,各种原子的数目是恒定的,所谓资源匮乏只是元素的分布发生了变化 C.氧化还原反应都是放热反应 D.强酸和强碱的中和反应的活化能接近于零,所以反应速率很高 14、在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( ) A.-488.3 kJ/mol B.+488.3 kJ/mol C.-191 kJ/mol D.+191 kJ/mol 15、下列说法或表示法正确的是 A.需要加热才能发生的反应一定是吸热反应 B.已知石墨比金刚石稳定,则C(s,石墨)→C(s,金刚石)△H>0 C.表示中和热的热化学方程式:H+(l)+OH-(l)===H2O(l) ΔH=-57.3 kJ/mol D.测定中和热的实验中,环形玻璃搅拌棒材料若用铜代替, 则测量出的中和热ΔH< -57.3 kJ·mol-1 16、下列两组热化学方程式中,有关ΔH的比较正确的是( ) ①NaOH(aq)+H2SO4(浓)===Na2SO4(aq)+H2O(l) ΔH1 NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH2 ②CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH3 CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH4 A.ΔH1>ΔH2;ΔH3<ΔH4 B.ΔH1>ΔH2;ΔH3>ΔH4 C.ΔH1=ΔH2;ΔH3<ΔH4 D. ΔH1<ΔH2;ΔH3>ΔH4 二、填空题(共计52分) 17、(12分)热化学方程式的书写. ①已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气时放出256.65kJ的热量.写出该反应的热化学方程式: 。 ②已知化学方程式:H2(g)+O2(g)=H2O(g),该反应的活化能为167.2kJ/mol,其逆反应的活化能为409.0kJ/mol,写出该反应的热化学方程式: 。 ③已知白磷(P4)和PCl3的分子结构如图所示,现提供以下的化学键的键能(KJ/mol):P-P 198,Cl-Cl 243, P-Cl 331。则写出1mol白磷完全反应生成PCl3(s)时的热化学方程式:_________. ④已知S(s)+O2(g)⇌ SO2(g) 当有4NA个电子转移时,放出297.23kJ的热量.写出该反应的热化学方程式 . ⑤常温常压下,1克CH4完全燃烧生成CO2和H2O时,放出Q kJ的热量.写出此反应的热化学方程式: 。【来.源:全,品…中&高*考*网】 ⑥酒精燃烧的化学方程式为:C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l),完全燃烧一定量的无水酒精,放出的热量为Q kJ,当完全吸收生成的CO2,消耗8mol/L的NaOH溶液50mL时恰好生成正盐.写出此反应的热化学方程式: 。 18、(10分)某化学反应 3A ⇌ 2B+D在四种不同条件下进行,B、D的起始浓度为0.反应物A 的浓度 c 随时间 t 的变化情况如下表: 实验 序号 t/min C/mol•L﹣1 温度/℃ 0 10 20 30 40 50 1 500 2.0 1.6 1.3 1.0 0.8【来.源:全,品…中&高*考*网】 0.8 2 500 C2 1.2 0.8 0.8 0.8 0.8 3 500 C3 1.7 1.3 1.0 1.0 1.0 4 600 2.0 1.1 0.9 0.9 0.9 0.9 根据上述数据,完成下列填空: (1)在实验 1 中,反应在10min~20min 内平均速率为 mol/(L•min) (2)在实验 2 中,A 的初始浓度 C2为 mol/L, 可推测实验 2 中还隐含的条件是 。 (3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3 v1 (填<、>或=),且C3 2.0mol/L (填<、>或=) 19、(共12分)(1)(6分)顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如右转化: 该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题: 已知:t1温度下,k(正)=0.006s-1,k(逆)=0.002s-1,该温度下反应达平衡时,C(反-1,2-二甲基环丙烷): C(顺-1,2-二甲基环丙烷)=________; 该反应的活化能Ea(正)小于Ea(逆),则________0(填“小于”“等于”或“大于”)。 (2)(6分)催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO。反应的热化学方程式如下:CO2(g)+3 H2(g)⇌ CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I CO2(g)+ H2(g) ⇌ CO(g)+H2O(g) ΔH2 II 某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据: 【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比; 已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1 ②H2O(l) H2O(g) ΔH3=44.0kJ·mol-1 请回答(不考虑温度对ΔH的影响):反应II的ΔH2= kJ·mol-1。 在右图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图(在图中标注出相应的曲线): 20、(10分)某校化学小组用实验的方法进行探究影响化学反应速率的因素。 他们只利用Cu、Fe、Al和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)。设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表:常温下, (1)甲同学表中实验步骤②为__________________ (2)甲同学的实验目的是__________________ (3)乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。乙同学在实验中应该测定的数据是______________________ (4)乙同学完成该实验应选用的实验药品是_____________;该实验中不选用某浓度的硫酸,理由是________________________ 21、(8分)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。 (1)(4分)已知:N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ/mol; 2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ/mol; C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol。 尾气转化的反应之一:2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH__________。 (2)(4分)某研究性学习小组在技术人员的指导下,按下列流程探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果。 ①实验过程中除空燃比不同外,其他条件:汽车尾气的流速、________等必须相同。 ②在一定条件下,测得尾气中的主要污染物的转化率与空燃比的关系如图所示。空燃比约为_______时,催化剂对汽车尾气的【来.源:全,品…中&高*考*网】催化效果最好。 [来源:【=来=源:全=品=高=考=网=】Z-X-X-K] 江西师范大学附属中学2016-2017学年高二上学期第一次月考化学试卷解析 一、单选题(共16小题) 1.考点:燃烧热、能源 答案:B 试题解析:结合未来新能源的特点,符合该标准的有:太阳能、生物质能、风能、氢能,正确答案B。 2.考点:化学反应与能量变化 答案:C 试题解析:由燃烧热的概念,可燃物应生成的是稳定的氧化物,故偏二甲肼的燃烧热不是-2550 kJ/mol,C选项错误,其他三个选项均正确。 3.考点:化学反应热的计算 答案:C 试题解析:从图示看,Ⅰ中1129 KJ为破坏化学键的键能,A错误;B选项的ΔH 加减关系反了,Ⅱ、Ⅲ、Ⅳ内能逐渐降低,都是放热的,C说法正确;整个反应的能量降低为放热反应,ΔH 小于0,D错误。正确选项为C。 4.考点:化学反应与能量变化 答案:D 试题解析:从图示变化看,e是+7价的ClO4-,A错误;a,b,c,d,e中-1价的Cl-最稳定,B错误;b→a+c反应ClO-=Cl-+ClO-,活化能为0+3×60-100=80kJ•mol-1,C错误;b→a+d反应的△H=64-2× 0-3×60=-116kJ•mol-1,D选项正确。 5.考点:化学反应速率 答案:B 试题解析:根据表格的数据可知:温度不变时,蔗糖的浓度越大,水解的速率越快。根据浓度与速率的变化关系可知:在328.2T时,蔗糖的浓度每减小0.100mol/L,水解速率减小1.50mmol/(L∙min),所以在温度是328.2T、浓度是0.400mol/L时,水解的速率是a=7.50-1.50=6.00 mmol/(L∙min),A正确。不同温度时,蔗糖浓度减少,所以速率减慢,但是温度不同,在相同的浓度时的反应速率不相同,B错误。在物质的浓度不变时,升高温度,水解速率增大,降低温度,水解速率减小。由于在物质的浓度是0.600mol/L时,温度是318.2T时水解速率是3.60 mmol/(L∙min),现在该反应的速率是2.16 mmol/(L∙min)<3.60 mmol/(L∙min),说明反应温度低于318.2 T。即b<318.2,C正确。升高温度,水解速率增大,增大浓度,水解速率也增大,若同时改变反应物的浓度和反应的温度,则二者对水解反应速率的影响因素可能相互抵消,使反应速率可能不发生改变,D正确。 6.考点:化学平衡 答案:C 试题解析:根据化学速率的特征,②③始终如此,⑤不会改变,投料不确定,⑧无法比较;①④⑥⑦为正确。 7.考点:化学反应热的计算 答案:A 试题解析:混合气体的平均分子量为34,二者的物质的量比为3:1,即0.2△H1+1160×0.8=1042.8,计算得△H1=-574kJ•mol-1 8.考点:化学反应速率 答案:C 试题解析:据图①△H= -1 44.8KJ/mol,据图②面积Sbdo>Saco,据图④(N2O5)=(1-0.4)/(3×2)=0.1mol·L-1·S-1正确选项为C。 9.考点:影响化学反应速率的因素 答案:A 试题解析:对速率的影响中,压强的改变必须引起浓度的改变;升高温度,活化分子的百分数增大,速率加快;使用催化剂,改变反应历程,降低活化能,增大活化分子的百分数,从而增大反应速率,但不会改变热量的大小;速率比等于方程式中的系数比,数值大不一定速率大;反应物浓度增大,活化分子的百分数不变;故正确说法只有②⑤。 10.考点:影响化学反应速率的因素化学反应速率 答案:B 试题解析:由图1数据变化A正确,结合图3所示,D也正确;温度高速率快,达平衡时间短,C正确;B选项中v(X)=(2.0-1.4)/3=0.2mol/(L·min),答案为B。 11.考点:化学反应速率 答案:D 试题解析:温度对速率的影响大于浓度,应优先考虑;温度高、浓度大(混合后的)的速率快,故最快的是D。 12.考点:化学反应速率 答案:D 试题解析:依据反应中各物质的速率比等于方程式中的系数比,可以换算为同一物质表示进行对比,明显最快的是D。 13.考点:化学反应与能量变化 答案:C 试题解析:反应中的能量变化和电子的得失无关,故D选项错误,其他说法均正确。 14.考点:燃烧热、能源 答案:A 试题解析:由燃烧热的概念及盖斯定律,所求的反应焓变为870.3 kJ/mol-(2×393.5 kJ/mol+2×285.8 kJ/mol)=-488.3 kJ/mol。A正确。 15.考点:化学反应与能量变化 答案:B 试题解析:需要加热的反应液可能是放热的(需要引发热),A错误;C选项的离子方程式H+和OH-后面加的是aq;D实验中铜易导热,损失热量,测量出的中和热ΔH>-57.3 kJ·mol-1。 16.考点:化学反应热的计算 答案:D 试题解析:因焓变ΔH带负号,所以题给中ΔH1<ΔH2,ΔH3>ΔH4;D选项正确。 第II卷(非选择题) 本试卷第二部分共有5道试题。 17.考点:燃烧热、能源 答案:①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=﹣641.6KJ•mol﹣1②H2O(g)=H2(g)+1/2O2(g);△H=+241.8KJ•mol﹣1③P4(s,白磷)+6Cl2(g)=4PCl3(s) ΔH = -1326 KJ/mol④S(s)+O2(g)SO2(g);△H=﹣297.23KJ•mol﹣1⑤CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=﹣16Q kJ•mol﹣1⑥C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l);△H=﹣10Q kJ•mol﹣1 试题解析:①1 mol 的液态N2H4和H2O2反应放出的热量为256.65/0.4=641.6KJ 。故有: N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=﹣641.6KJ•mol﹣1 ②由题意该反应放出的热量为:409.0-167.2=241.8kJ,故该反应的热化学方程式; H2(g)+O2(g)=H2O(g)△H=-241.8KJ•mol﹣1 ③由题意,反应P4(s,白磷)+6Cl2(g)=4PCl3(s) 的焓变为:198×4+243×6-331×12= -1326 KJ/mol,所以,1mol白磷完全反应生成PCl3 (s)时的热化学方程式: P4(s,白磷)+6Cl2(g)=4PCl3(s) ΔH = -1326 KJ/mol ④该反应转移4mol的电子,恰好反应了1ol的S,故有 S(s)+O2(g)=SO2(g);△H=﹣297.23KJ•mol﹣1 ⑤此时反应了1/16mol的CH4,因此有反应 CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=﹣16Q kJ•mol﹣1 ⑥题给的反应时,生成了0.2mol的Na2CO3,即乙醇燃烧生成的CO2是0.2mol,燃烧的乙醇是0.1mol,故有方程式:C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l);△H=﹣10Q kJ•mol﹣1 18.考点:化学反应速率 答案:(1)0.03(2)2.0,使用了合适的催化剂(3)>,> 试题解析:(1)该时间段内平均速率为(1.6-1.3)/(20-10)=0.03 mol/(L•min) (2)该实验和实验 1同温下进行,平衡后A的浓度也相同,故起始浓度也应该是一样的,即C2=2.0mol/L,不过该实验达到平衡的时间短速率快,可能使用了合适的催化剂。 (3)实验 3和1的温度相同,但达平衡时间短,故v3>v1;平衡时实验 3条件下的A的浓度大,其起始浓度也应该大,即C3>2.0mol/L 19.考点:化学反应速率化学反应与能量变化 答案:(1)3 小于(2)+41.2 试题解析:(1)平衡时v(正)=v(逆),因此二者的浓度比为0.006/0.002=3:1; 活化能Ea(正)小于Ea(逆),说明该反应是放热反应,即小于0。 (2)利用盖斯定律,由CO和H2的标准燃烧热(相减)和液态水的汽化热(再相加),即可得反应:CO2(g)+ H2(g)CO(g)+H2O(g),故ΔH2=-285.8+283.0+44.0=+41.2 kJ·mol-1 从表中数据分析,在催化剂Cat.2的作用下,甲醇的选择性更大,说明催化剂Cat.2对反应Ⅰ的催化效果更好,催化剂能降低反应的活化能,说明使用催化剂Cat.2的反应过程中活化能更低,故图为 20.考点:实验探究影响化学反应速率的因素 答案:(1)分别投入大小、形状相同的Cu、Fe、Al(2)研究金属(或反应物)本身的性质与反应速率的关系; (3)一定时间内产生气体的体积(或产生一定体积的气体所需时间)(4)Fe(或Al)、0.5 mol·L-1硫酸和2 mol·L-1硫酸;常温下Fe(或Al)在18.4 mol·L-1硫酸中钝化 试题解析:(1)要对比三者的活泼性,需要在相同条件下三者的大小形状相同均相同。即步骤②为:分别投入大小、形状相同的Cu、Fe、Al。 (2)甲同学的实验是为了研究金属活泼性与反应速率的关系。 (3)要精确的、定量的研究浓度对反应速率的影响,需要测定一定时间内产生气体的体积或产生一定体积的气体所需时间,来完成。 (4)要完成该实验,需要可和硫酸反应的金属Fe或Al等,及不同浓度的硫酸(如0.5 mol·L-1和2 mol·L-1);但不能用18.4 mol·L-1硫酸,因常温下Fe或Al钝化. 21.考点:化学反应与能量变化 答案:(1)-746.5kJ/mol(2)①催化反应的温度;②c 试题解析:(1)由盖斯定律方程式为③×2-②-①,即ΔH=-393.5 2-(-221.0)-180.5=-746.5kJ/mol (2)①对比催化剂在不同空燃比条件下对汽车尾气的催化效果,反应的温度必须相同; ②从图像看,c点时CO、NOx的转化率最高,此时催化效果最好。查看更多