- 2021-08-06 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江苏省大丰市新丰中学2018-2019学年高二下学期期中考试化学试题
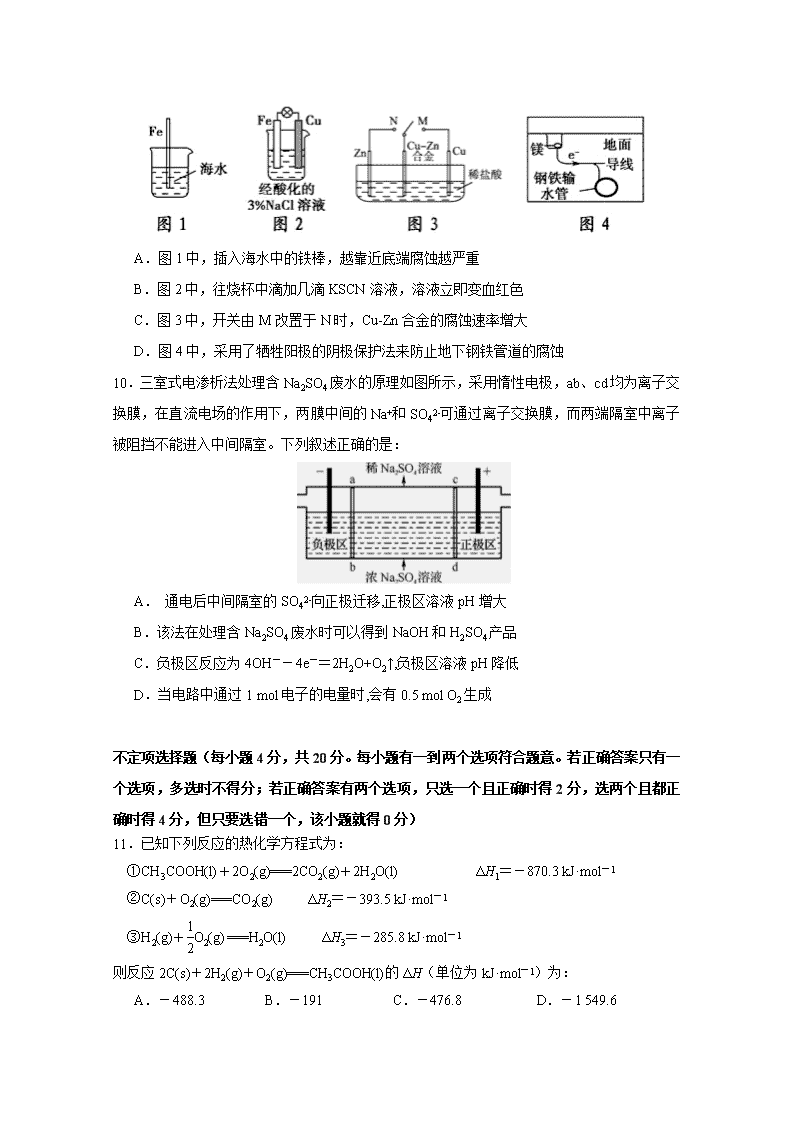
2018-2019学年度第二学期期中考试 高二年级化学(选修)试题 说明:本试卷分第I卷和第II卷两部分,全卷满分120分,考试时间100分钟。 第I卷(选择题共40分) 单项选择题(每小题2分,共20分。每小题只有一个选项符合题意) 1.人类在未来将逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能转换形态),届时人们将适应“低碳经济”和“低碳生活”。下列说法错误的是: A.煤、石油和天然气都属于碳素燃料 B.发展太阳能经济有助于减缓温室效应 C.太阳能电池可将太阳能直接转化为电能 D.目前研究菠菜蛋白质“发电”不属于“太阳能文明” 2.某反应的反应过程中能量变化如图所示,下列叙述不正确的是: A.催化剂能改变反应的焓变 B.催化剂能降低反应所需活化能 C.该反应是吸热反应 D.逆反应的活化能小于正反应的活化能 3.下列有关热化学反应的描述中正确的是: A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+(2×283.0)kJ/mol C.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 4.取20.00 mL 0.50 mol·L-1 NaOH溶液,恰好将未知浓度的H2SO4溶液20.00 mL滴定至终点,下列说法正确的是: A.该实验不需要指示剂 B.用量筒量取上述硫酸的体积 C.H2SO4的浓度为1.00 mol·L-1 D.参加反应的H+和OH-的物质的量相等 5.少量铁片与100mL 0.01mol/L的稀盐酸反应,反应速率太慢,为了加快此反应速率而不改变H2的产量,可以使用如下方法中的: ①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10mL 0.1mol/L盐酸 A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.③④⑥⑦⑧ 6.若溶液中由水电离产生的c(OH-)=1×10-14mol/L,则此溶液中一定可以大量共存的离子组是: A.Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、NO3- C.K+、Na+、Cl-、AlO2- D.K+、NH4+、SO42-、NO3- 7.下列事实能说明NH3·H2O一定是弱电解质的是: ①常温下,NH3·H2O溶液能使酚酞变红; ②用NH3·H2O溶液做导电性实验,灯泡暗; ③常温下,0.1mol / L的氨水pH约为11 ④常温下,体积相同且pH相同的NH3·H2O溶液和NaOH溶液,与相同浓度的HCl溶液中和时,消耗HCl溶液的体积:前者>后者 A.①②③④ B.③ C.③④ D.②④ 8.在一个不传热的固定容积的密闭容器中可逆反应mA(g)+ nB(g)pC(g)+ qD(g) 当m、n、p、q为任意整数时,一定达到平衡的标志是: ①体系的压强不再改变 ②体系的温度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变 ⑤反应速率v(A):v(B):v(C):v(D)=m:n:p:q ⑥单位时间内m mol A发生断键反应,同时pmol C也发生断键反应. A.③④⑤⑥ B.②③④⑥ C.①③④⑤ D.①③④⑥ 9.下列与金属腐蚀有关的说法,正确的是: A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 B.图2中,往烧杯中滴加几滴KSCN溶液,溶液立即变血红色 C.图3中,开关由M改置于N时,Cu-Zn合金的腐蚀速率增大 D.图4中,采用了牺牲阳极的阴极保护法来防止地下钢铁管道的腐蚀 10.三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是: A. 通电后中间隔室的SO42-向正极迁移,正极区溶液pH增大 B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 C.负极区反应为4OH--4e-=2H2O+O2↑,负极区溶液pH降低 D.当电路中通过1 mol电子的电量时,会有0.5 mol O2生成 不定项选择题(每小题4分,共20分。每小题有一到两个选项符合题意。若正确答案只有一个选项,多选时不得分;若正确答案有两个选项,只选一个且正确时得2分,选两个且都正确时得4分,但只要选错一个,该小题就得0分) 11.已知下列反应的热化学方程式为: ①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1 ②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1 ③H2(g)+O2(g) ===H2O(l) ΔH3=-285.8 kJ·mol-1 则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的ΔH(单位为kJ·mol-1)为: A.-488.3 B.-191 C.-476.8 D.-1 549.6 12.在某温度T℃时,测得0.01mol·L-1的NaOH溶液的pH=11。下列说法正确的是: A.T<25 B.该温度下水的离子积常数Kw=1×10-13 C.升高温度,溶液的pH增大 D.将Va L该溶液与Vb L pH=3的硫酸溶液混合,溶液溶液呈中性,则Va查看更多