- 2021-08-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届安徽省安庆一中高二下学期期中考试(2017
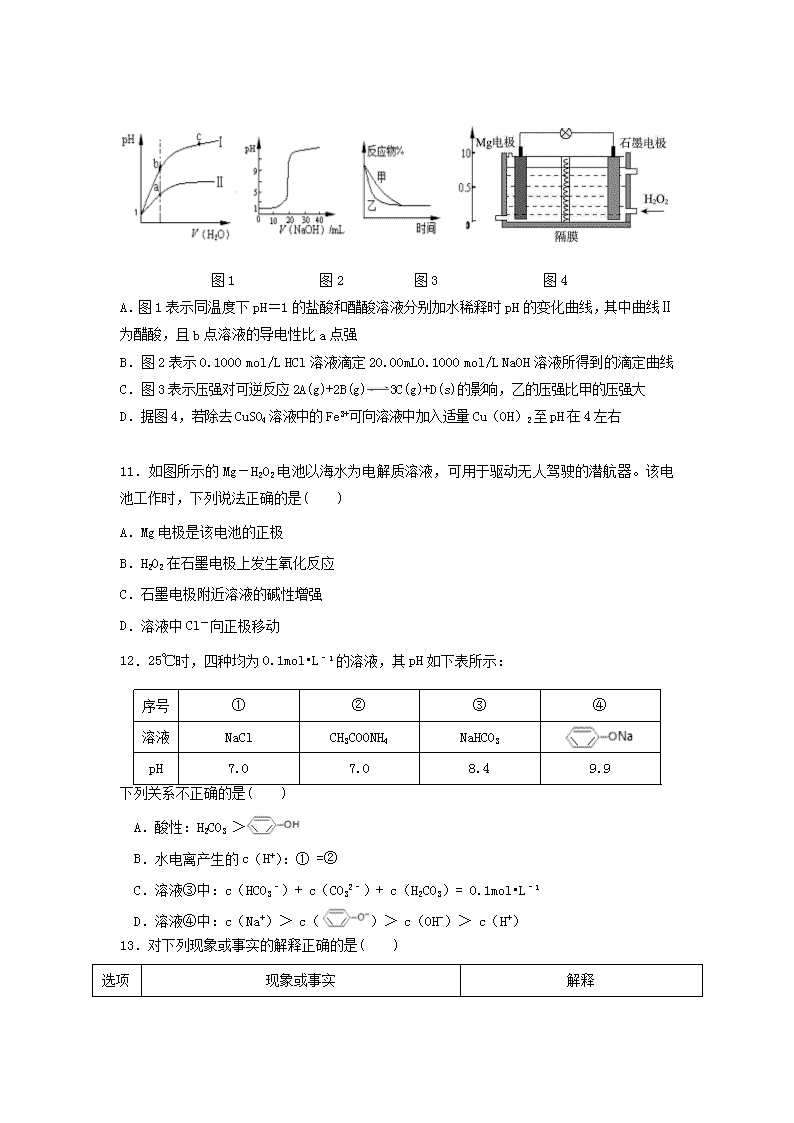
2016-2017 学年安庆一中高二(下)期中化学试卷 命题:江莉华 审题:高芳 可能用到的相对原子质量:H-1 C-12 O-16 S-32 Fe-56 I-127 第Ⅰ卷(共 54 分) 一、选择题:(每小题只有一个选项正确,每小题 3 分,共 54 分) 1.下列说法中正确的是( ) A.氨气溶于水能导电,故氨气属于电解质 B.碳酸钡难溶于水,故碳酸钡属于弱电解质 C.硫酸是强电解质,故纯硫酸能导电 D.室温下,氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同 2.室温下,下列离子组在给定条件下一定能大量共存的是( ) A.能使 pH 试纸变深蓝色的溶液:Na+、AlO2 ﹣、S2﹣、CO3 2﹣ B.Na2S 溶液中:K+、Na+、NO3 ﹣、Ag+ C.含有大量 Al3+的水溶液中:Na+、NH4 +、HCO3 ﹣、Br﹣ D.水电离产生的 H+浓度为 1×10﹣12mol•L﹣1 的溶液:NH4 +、Na+、Cl﹣、CO3 2﹣ 3.下列解释事实的方程式不正确...的是 ( ) A.制 Cl2 时用排饱和氯化钠溶液收集气体:H2O + Cl2 Cl-+H+ + HClO B.SO2 的水溶液显酸性:SO2+H2O H2SO3 2H++ SO3 2- C.常温下,0.1mol/L 醋酸溶液 pH≈3:CH3COOH CH3COO-+ H+ D.Mg(OH)2 固体在溶液中存在平衡: Mg(OH)2(s) Mg2+(aq)+2OH-(aq),该固体可溶于 NH4Cl 溶液 4.下列说法不能..说明 H3PO4 的酸性弱于 H2SO4 的是( ) A.非金属性 P<S B.Na3PO4 溶液呈碱性,Na2SO4 溶液呈中性 C.H3PO4 溶液的导电能力弱于 H2SO4 溶液 D.H2SO4 溶液与 Na3PO4 反应可以生成 H3PO4 和 Na2SO4 5.室温下,分别用物质的量浓度为 0.1 mol·L-1 的溶液进行下列实验,结论不正确...的是 ( ) A.向 NaOH 溶液中通 SO2 至 pH=7:c(Na+) = c(HSO 3 ) +2c(SO 2 3 ) B.向 NH4Cl 溶液中加入等浓度等体积的 NH3·H2O 后,所得溶液呈碱性,则: c(NH4 +) < c(NH3·H2O) C.向 NH4HSO4 加入等浓度等体积的 NaOH 溶液后:c(NH4 +) + c(NH3·H2O) = c(Na+) D.向 CH3COOH 溶液中加入少量 CH3COONa 晶体: - 3 3 c(CH COO ) c(CH COOH) 增大 6. 右图为锌铜原电池装置示意图,下列说法不.正确..的是( ) A. 电子由 Zn 极流向 Cu 极 B. 此装置能将电能转变为化学能 C. 取出盐桥,电流表指针不再偏转 D. 该装置的总反应:Zn + Cu2+ === Zn2++ Cu 7.下列根据水解反应原理设计的应用,不正确...的是( ) A.CO3 2﹣+H2O HCO3 ﹣+OH﹣;用热的纯碱溶液清洗油污 B.Al3++3H2O Al(OH)3(胶体)+3H+;明矾净水 C.TiCl4+(x+2)H2O(过量) TiO2•xH2O↓+4HCl;制备 TiO2 纳米粉 D.SnCl2+H2O Sn(OH)Cl↓+HCl;配制氯化亚锡溶液时加入氢氧化钠 8.水的电离平衡曲线如图所示,下列说法不正确...的是( ) A.图中五点 KW 间的关系:B>C>A=D=E B.若从 A 点到 D 点,可采用:温度不变在水中加入少量的酸 C.若从 A 点到 C 点,可采用:温度不变在水中加入适量的 NH4Cl 固体 D.若处在 B 点时,将 pH=2 的硫酸与 pH=10 的 KOH 等体积混合后,溶液显中性 9.已知 25℃时,AgI 饱和溶液中 c(Ag+)为 1.22×10﹣8 mol/L,AgCl 的饱和溶液中 c(Ag+) 为1.25×10﹣5 mol/L。若在10mL含有KCl和KI各为0.01mol/L的溶液中,加入16mL 0.01mol/L AgNO3 溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( ) A.c(K+)>c(NO3 ﹣)>c(Ag+)>c(Cl﹣)>c(I﹣) B.c(K+)>c(NO3 ﹣)>c(Cl﹣)>c(Ag+)>c(I﹣) C.c(K+)>c(NO3 ﹣)>c(Ag+)=c(Cl﹣)+c(I﹣) D.c(NO3 ﹣)>c(K+)>c(Ag+)>c(Cl﹣)>c(I﹣) 10.下列图示与对应的叙述相符的是( ) 图 1 图 2 图 3 图 4 A.图 1 表示同温度下 pH=1 的盐酸和醋酸溶液分别加水稀释时 pH 的变化曲线,其中曲线Ⅱ 为醋酸,且 b 点溶液的导电性比 a 点强 B.图 2 表示 0.1000 mol/L HCl 溶液滴定 20.00mL0.1000 mol/L NaOH 溶液所得到的滴定曲 线 C.图 3 表示压强对可逆反应 2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 D.据图 4,若除去 CuSO4 溶液中的 Fe3+可向溶液中加入适量 Cu(OH)2 至 pH 在 4 左右 11.如图所示的 Mg-H2O2 电池以海水为电解质溶液,可用于驱动无人驾驶的潜航器。该电池 工作时,下列说法正确的是( ) A.Mg 电极是该电池的正极 B.H2O2 在石墨电极上发生氧化反应 C.石墨电极附近溶液的碱性增强 D.溶液中 Cl-向正极移动 12.25℃时,四种均为 0.1mol•L﹣1 的溶液,其 pH 如下表所示: 下列关系不正确...的是( ) A.酸性:H2CO3 > B.水电离产生的 c(H+):① =② C.溶液③中:c(HCO3 ﹣)+ c(CO3 2﹣)+ c(H2CO3)= 0.1mol•L﹣1 D.溶液④中:c(Na+)> c( )> c(OH-)> c(H+) 13.对下列现象或事实的解释正确的是( ) 选项 现象或事实 解释 序号 ① ② ③ ④ 溶液 NaCl CH3COONH4 NaHCO3 pH 7.0 7.0 8.4 9.9 A 室温下,向明矾溶液中加入足量的浓氨水 证明氢氧化铝溶于氨水 B 室温下,用 pH 试纸测得:0.1mol·L-1 Na2SO3 溶液的 pH 约为 10;0.1mol·L-1 NaHSO3 溶液的 pH 约为 5 HSO3 -结合 H+的能力比 SO3 2-的强 C 室温下,向浓度均为 0.1 mol·L-1 的 BaCl2 和 CaCl2 混合溶液中滴加 Na2SO4 溶液,出现白色沉淀 Ksp(BaSO4)<Ksp(CaSO4) D 施肥时,草木灰(有效成分为 K2CO3)不能与 NH4Cl 混 合使用 K2CO3 与 NH4Cl 反应会损失氮肥 14.分别向等体积 1mol/L 盐酸和 1mol/L 醋酸溶液中加入等量的镁条,反应时间与溶液 pH 变化关系如右图。下列说法中不正确...的是( ) A.Y 代表盐酸与镁条的反应 B.a 点时反应 Y 消耗镁条的量少 C.b 点表示此时两溶液 pH 相等 D.c 点表示此时反应结束 15.燃料电池是燃料(如 CO、H2、CH4)等跟 O2(或空气)起反应将化学能转变为电能的装 置,电解质溶液是强碱(如 KOH)溶液,下列关于甲烷燃料电池的说法中不正确...的是( ) A.通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应 B.负极的电极反应式为 CH4+10OH﹣﹣8e﹣═CO3 2﹣+7H2O C.随着反应的进行,电解质溶液的 pH 保持不变 D.甲烷燃料电池比甲烷燃烧的能量利用率大 16.下列有关溶液中微粒的物质的量浓度关系正确的是( ) A.物质的量浓度相等的 HCN 溶液和 NaCN 溶液等体积混合后的溶液中: c(CN-)+2c(OH-)=2c(H+)+c(HCN) B.0.1 mol·L-1CH3COONa 溶液与 0.05 mol·L-1 盐酸等体积混合后的酸性溶液中: c(CH3COO-)> c(CH3COOH) > c(Cl-) >c(H+) C.某弱酸的酸式盐 NaHA 溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A) D.0.1 mol·L-1(NH4)2Fe(SO4)2 溶液中:c(NH4 +)+c(NH3·H2O)+c(Fe2+)=0.3 mol·L-1 17.某锂碘电池以 LiI-Al2O3 固体为电解质传递离子,其基本结构示意图如下,电池总反应 b c a XY 反应时间(t) 溶 液 pH • •• 0 可表示为:2Li+PbI2=2LiI+Pb。下列说法正确的是[( ) A.电子由 b 极经用电器流向 a 极 B.I-由 a 极通过固体电解质传递到 b 极 C.b 极上的电极反应式为:PbI2-2e-=Pb+2I- D.b 极质量减少 1.27 g 时,a 极转移的电子数约为 6.02×1021 18. 30℃时,利用右图装置进行实验,结果记录如下表所示: 实验 a 电极 b 电极 电解质溶液 现象 I Cu Zn 稀 H2SO4 检流计指针向左偏转 II Fe Al 稀 H2SO4 检流计指针向左偏转 III Fe Al 浓 H2SO4 检流计指针先向左偏转,后逐渐归零,a 电极表面逐渐变黑,b 电极表面逐渐变白 IV Fe Al 浓 HNO3 检流计指针迅速向右偏转,a 电极逐渐溶 解,b 电极表面逐渐变白 下列说法不.正确..的是( ) A.II 中 Al 为负极,其电极反应是:Al - 3e- = Al3+ B.III 中的现象说明 Fe 和 Al 表面形成致密的氧化膜,阻止了电极反应的进行 C.IV 中 Fe 为负极,发生了氧化反应 D.上述实验表明:相同条件下,Fe 在浓 HNO3 中更稳定,Al 在浓 H2SO4 中更稳定 第Ⅱ卷(共 46 分) 二、填空题: 19.(12 分)氮和硫的化合物在生产生活中广泛存在。研究发现,NOx 和 SO2 是雾霾的主要成 分。 Ⅰ.(1)已知: 2CO(g)+O2(g) 2CO2(g) △H1=﹣566.00kJ•mol-1 2SO2(g)+O2(g) 2SO3(g) △H2=﹣196.6kJ•mol-1 2NO(g)+O2(g) 2NO2(g) △H3=﹣113.0kJ•mol-1 则反应 2NO2(g)+SO2(g)+ CO(g) SO3(g)+2NO(g)+ CO2(g)的△H= kJ•mol-1。 (2)NOx 主要来源于汽车尾气。T℃时,模拟汽车尾气催化转化:2NO+2CO 2CO2+N2,将等物 质的量的 NO 和 CO 充入容积为 2L 的密闭容器中,保持温度和体积不变,反应过程(0~15min) 中 NO 的物质的量随时间变化如右图所示: ①T℃时该化学反应的平衡常数 K= ; ②图中 a、b 分别表示使用同种催化剂时,达 到平衡过程 中 n(NO)的变化曲线,其中表示催化剂表面积 较大的曲线 是 (填“a”或“b”)。 Ⅱ.科学家发明了 NH3 燃料电池,以 KOH 为电解质,原理如右图 所示。该燃料电池的负极反应式为__________________。 Ⅲ.SO2 主要来源于煤的燃烧。 25℃时,电离平衡常数: 化学式 H2CO3 H2SO3 电离平衡常数 K1=4.30×10-7 K2=5.61×10-11 K1=1.54×10-2 K2=1.02×10-7 回答下列问题: (1)常温下,pH 相同的下列溶液:①Na2CO3、②NaHCO3、③Na2SO3。物质的量浓度由大到小的 排列顺序为 > > 。(用序号表示) (2)已知 NaHSO3 溶液显酸性,下列说法正确的是 。 A. c(Na+)=2c(SO3 2-)+2c(HSO3 -)+2c(H2SO3) B. c(Na+)+c(H+)=c(OH-)+c(HSO3 -)+c(SO3 2-) C. c(HSO3 -)> c(H+)> c(H2SO3)> c(SO3 2-) D. c(H+)+c(H2SO3)=c(SO3 2-)+c(OH-) 20.(10 分)工业废水中常含有一定量的 Cr2O7 2-和 CrO4 2-,它们会对人类及生态系统产生很 大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为: CrO4 2- Cr2O7 2- Cr3+(紫色) Cr(OH)3(蓝色) 其中第①步存在平衡:2CrO4 2-(黄色)+2H+ Cr2O7 2-(橙色)+H2O (1)若平衡体系的 pH=2,则溶液显 色。 (2)第②步中,还原 0.1mol Cr2O7 2-离子,需要________g 的 FeSO4。 (3)Cr3+与 Al3+的化学性质相似,在 Cr2(SO4)3 溶液中逐滴加入 NaOH 溶液直至过量,可 观察到的现象是________ ______。 第③步生成的 Cr(OH)3 在溶液中存在以下沉淀溶解平衡: Cr(OH)3(s) Cr3+(aq)+3OH-(aq) (4)常温下,Cr(OH)3 的溶度积 Ksp=c(Cr3+)·c3(OH-)=10-32,要使 c(Cr3+)降 至 10-5mol/L,溶液的 pH 应调至 。 (5)已知 AgCl、Ag2CrO4(砖红色)的 Ksp 分别为 2×10-10 和 1.12×10-12。分析化学中,测定 含氯的中性溶液中 Cl-的含量,以 K2CrO4 作指示剂,用 AgNO3 溶液滴定。滴定过程 中首先析出沉淀___ _____。 21.(12 分) 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓 度的还原剂溶液或反之)。测血钙的含量时,进行如下实验: ①可将 2mL 血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4 晶体,反应生成 CaC2O4 沉淀,将沉淀用稀硫酸处理得 H2C2O4 溶液。 ②将①得到的 H2C2O4 溶液,再用酸性 KMnO4 溶液滴定,氧化产物为 CO2,还原产物为 Mn2+。 ③终点时用去 20mL l.0×l0﹣4 mol/L 的 KMnO4 溶液。 (1)写出用 KMn04 滴定 H2C2O4 的离子方程式 。 (2)滴定时,将 KMnO4 溶液装在________(填“酸式”或“碱式”)滴定管中。 (3)判断滴定终点的方法是 。 (4)误差分析:(填“偏高”、“偏低”或“无影响”) H+ ①转化 Fe2+ ②还原 OH- ③沉淀 ①如果滴定管用蒸馏水洗后未用酸性 KMnO4 标准液润洗,则测量结果 。 ②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果 。 (5)计算:血液中含钙离子的浓度为 mol/L。 22.(12 分)LiFePO4 用于锂离子二次电池的电极材料,可由 LiI 和 FePO4 制备。 (1)FePO4 难溶于水,制备方法如下: Ⅰ.用稍过量的稀 H2SO4 溶解废铁屑,加热,搅拌,过滤; Ⅱ.向滤液中加入一定量的 H2O2; Ⅲ.向含 Fe3+的溶液加入 Na2HPO4 溶液,过滤后经进一步处理得 FePO4。 ①Ⅰ中反应进行完全的现象是 。 ②用离子方程式说明 H2O2 的作用是 。 ③Na2HPO4 溶液显碱性的原因是 。 (2)制备 LiFePO4:将 FePO4 与 LiI 混合,在惰性气氛中加热,制得 LiFePO4 。 化合物 LiI 中碘离子的作用是 。 (3)锂离子二次电池的负极材料为金属锂和石墨的复合材料(石墨作为金属锂的载体),电 池反应为: FePO4(s) +Li(s) LiFePO4(s) ,装置如下: ①该电池不能 用电解质水溶液,原因 是 。 ②放电时,b 极的电极反应式是 。 化学参考答案 1.D 2.A 3.B 4.C 5.B 6.B 7.D 8.C 9.B10.D 11.C 12.B13.D14.B 15.C16.A 17.D18.D 19.(12 分) Ⅰ.(1)﹣268.3 (2 分) (2)① 5(mol/L) -1 (单位可写可不写) (2 分)②b (2 分) Ⅱ. 2NH3+6OH--6e-=N2+6H2O (2 分) Ⅲ.(1)②>③>① (2 分) (2)D (2 分) 20.(10 分)(1)橙色(2 分)(2)91.2(2 分)(3)先有蓝色沉淀生成,后沉淀逐渐溶解 (2 分)(4)5(2 分)(5)AgCl(2 分) 21. (12 分) (1)2MnO4 ﹣+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O (2 分)(2)酸式(2 分) (3)当滴入最后一滴酸性 KMnO4 溶液后溶液由无色变为浅紫色,且半分钟内不褪色(2 分) (4)①偏高(2 分) ②偏高 (2 分) (5)2.5×10﹣3(2 分) 22. (12 分) (1)① 不再产生气泡 (2 分) ② 2Fe2+ + 2H+ + H2O2 = 2Fe3+ + 2H2O (2 分) ③ 由于 HPO4 2-可以电离:HPO4 2- PO4 3- + H+ ,又可以水解:HPO4 2- +H2O H2PO4 - + OH-, 且水解程度大于电离程度,所以溶液溶解显碱性。(2 分 (2)作还原剂 (2 分) (3)① 金属 Li 可与水发生反应(或 2Li + 2H2O =2LiOH + H2↑)(2 分) ②FePO4 +Li+ +e- =LiFePO4 (2 分)查看更多