2020学年高一化学下学期期末模拟试题人教 版
2019高一年级期末模拟考试
化学试题
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上
第I卷(选择题 共45分)
选择题答案请用2B铅笔规范填涂在答题卡上规定位置
一.选择题(本大题共15个小题,每小题3分,共45分,每个小题的4个选项中只有一个是符合题意的)
1.中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于的叙述错误的是( )
A. 原子序数116 B. 中子数177 C. 核外电子数116 D. 相对原子质量293
2.X元素的阳离子和Y元素的阴离子具有与氖原子相同的电子层结构,下列说法正确的是( )
A. 原子序数X
Y C. 原子的最外层电子数X>Y D. 元素的最高正价XMg
B. 铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱:Cu>Na
C. 酸性H2CO3Cl
4.下列离子方程式书写不正确的是( )
A. 盐酸与Na2SiO3溶液混合: SiO32-+2H+=H2SiO3↓
B. 浓盐酸和二氧化锰共热制取Cl2: MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
C. NO2通入水中: H2O+3NO2=2H++2NO3-+NO
D. 向澄清石灰水中通人过量SO2: SO2+Ca2++2OH-=CaSO4↓+H2O
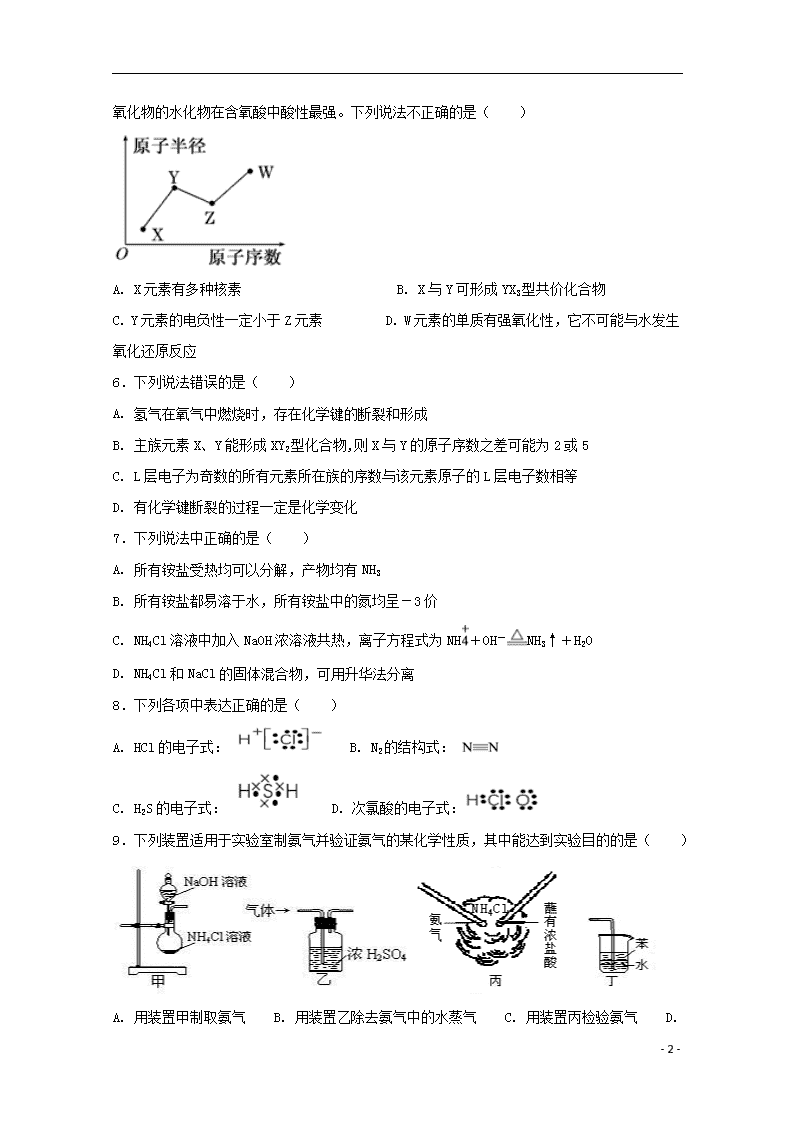
5.X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化关系如图所示。已知X的原子半径在所有原子中最小;Y的一种核素的质量数为15,中子数为8;W
- 7 -
的最高价氧化物的水化物在含氧酸中酸性最强。下列说法不正确的是( )
A. X元素有多种核素 B. X与Y可形成YX3型共价化合物
C. Y元素的电负性一定小于Z元素 D. W元素的单质有强氧化性,它不可能与水发生氧化还原反应
6.下列说法错误的是( )
A. 氢气在氧气中燃烧时,存在化学键的断裂和形成
B. 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5
C. L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
D. 有化学键断裂的过程一定是化学变化
7.下列说法中正确的是( )
A. 所有铵盐受热均可以分解,产物均有NH3
B. 所有铵盐都易溶于水,所有铵盐中的氮均呈-3价
C. NH4Cl溶液中加入NaOH浓溶液共热,离子方程式为NH+OH-NH3↑+H2O
D. NH4Cl和NaCl的固体混合物,可用升华法分离
8.下列各项中表达正确的是( )
A. HCl的电子式: B. N2的结构式:
C. H2S的电子式: D. 次氯酸的电子式:
9.下列装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的的是( )
A. 用装置甲制取氨气 B. 用装置乙除去氨气中的水蒸气 C. 用装置丙检验氨气 D.
- 7 -
用装置丁吸收尾气
10.俄罗斯科学家在利用回旋加速器进行的实验中,用含20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果成功制得4个第115号元素的原子。其与N元素同主族.这4个原子在生成数微秒后衰变成第113号元素.前者的一种核素为。下列有关叙述正确的是( )
A. 115号元素衰变成113号元素是化学变化
B. 115号元素X的近似相对原子质量为288
C. 113号元素的原子最外层有3个电子
D. 因115号元素与N元素同主族,所以是非金属元素
11.已知R2+离子核外有a个电子,b个中子.表示R原子符号正确的是( )
A.R B.R C.R D.R
12.已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是( )
A. 原子序数:Y>X>Z>W B. 离子半径:X+>Y2+>Z->W2-
C. 原子最外层电子数:Z>W>Y>X D. 还原性:X>Y,W2->Z-
13.通常人们把拆开1 mol某化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热。下列是一些化学键的键能。
化学键
C—H
C—F
H—F
F—F
键能/(kJ·mol)
414
489
565
155
根据键能数据估算反应CH4+4F2=CF4+4HF每消耗1mol CH4的热效应( )
A. 放热1940 kJ B. 吸热1940 kJ C. 放热485 kJ D. 吸热485 kJ
14.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的 2倍,X、Y的核电荷数之比为3:4,W的最外层为7电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是( )
A. X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B. 原子半径大小:X<Y,Z>W
- 7 -
C. 化合物Z2Y和ZWY3都只存在离子键
D. Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
15.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法中,不正确的是( )
A. 1molNH5中含有5molN-键 B. NH5的熔沸点高于NH3
C. NH5固体投入少量水中,可产生两种气体 D. NH5中既有离子键又有共价键
第II卷(非选择题 共55分)
试题答案请用0.5毫米黑色签字笔规范书写答题卡上
16.(14分)下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是________,只有负价而无正价的元素是________。(填元素符号)
(2)最高价氧化物的水化物酸性最强的是________,呈两性的是________。
(3)在B、C、E、F中,原子半径最大的是________。
(4)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式:________。
(5)与C元素同族的第5周期元素X的价电子排布式________________
17.(14分)有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
(1)加热前通入氮气的目的是 1分 ,操作方法为 2分 。
- 7 -
(2)装置A、C、D中盛放的试剂分别为A 1分 ,C 1分 ,D 1分 。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将 2分 (填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将 2分 ;若撤去E装置,则测得Na2CO3·10H2O的含量将 2分 。
(4)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,由此可知混合物中NaHCO3的质量分数为 2分 (用含w、m1、m2的代数式表示)
18.(10分)某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。
(1)装置A中烧瓶内试剂可选用 2分 (填序号)。
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱固体
(2)若探究氨气的溶解性,需在K2的导管末端连接下表装置中的 1分 (填序号)装置,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是 1分 。
备选装置(其中水中含酚酞溶液)
Ⅰ
Ⅱ
Ⅲ
(3)若探究氨气的还原性,需打开K1、K3,K,2处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气生成气体必须通过盛有 1分 试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为 2分 。
③从K3处导管逸出的气体中含有少量C12,则C装置中应盛放 1分 溶液(填化学式),反应的离子方程式为 2分 。
- 7 -
19.(17分)用A+、B-、C2-、D、E、F分别表示含有18个电子的几种微粒(离子或分子),请回答下列问题:
(1)A元素是 1分 、B元素是 1分 、C元素是 1分 (用元素符号表示)。
(2)B的单质可用来制“84”消毒液的主要成分,写出反应的离子方程式 3分 。
(3)用文字描述比较B、C两元素的非金属性强弱的方法(必要时可用方程式,至少一条): 3分 。
(4)D是由两种元素组成的双原子分子,用电子式表示其形成过程 3分 。
(5)E是所有含18个电子的微粒中氧化能力最强的分子,其与水反应的化学方程式为 3分 。
(6)F分子中含有4个原子,既有极性键又有非极性键,其电子式是 2分 。
- 7 -
2019高一年级期末模拟考试
化学试题参考答案
1.D 2.B 3.B 4.D 5.D 6.D 7.C 8.B
9.C 10.C 11.C 12.B 13.A 14.D 15.A
16. Ar F HClO4 Al(OH)3 Na Al(OH)3+NaOH===NaAlO2+2H2O 5s25p1
17. 除去装置中的水蒸气和二氧化碳 关闭b,打开a,缓缓通入氮气,直至a处出来的气体不再使澄清石灰水变浑浊为止 碱石灰 无水CaCl2或P2O5 碱石灰 偏低 无影响 偏低
18. ace II或III 用热毛巾将烧瓶捂热片刻(其他合理答案均可) 饱和食盐水、浓硫酸 3C12+8NH3=6NH4Cl+N2 NaOH Cl2+2OH-=Cl-+ClO-+H2O
19. K Cl S Cl2+2OH-=Cl-+ClO-+H2O Cl2+S2-=2Cl-+S或Cl2+H2S=2HCl+S2- + 2F2+2H2O=4HF+O2
- 7 -