- 2021-08-06 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年宁夏中卫市第一中学高二上学期第一次月考化学试题(A卷) Word版无答案
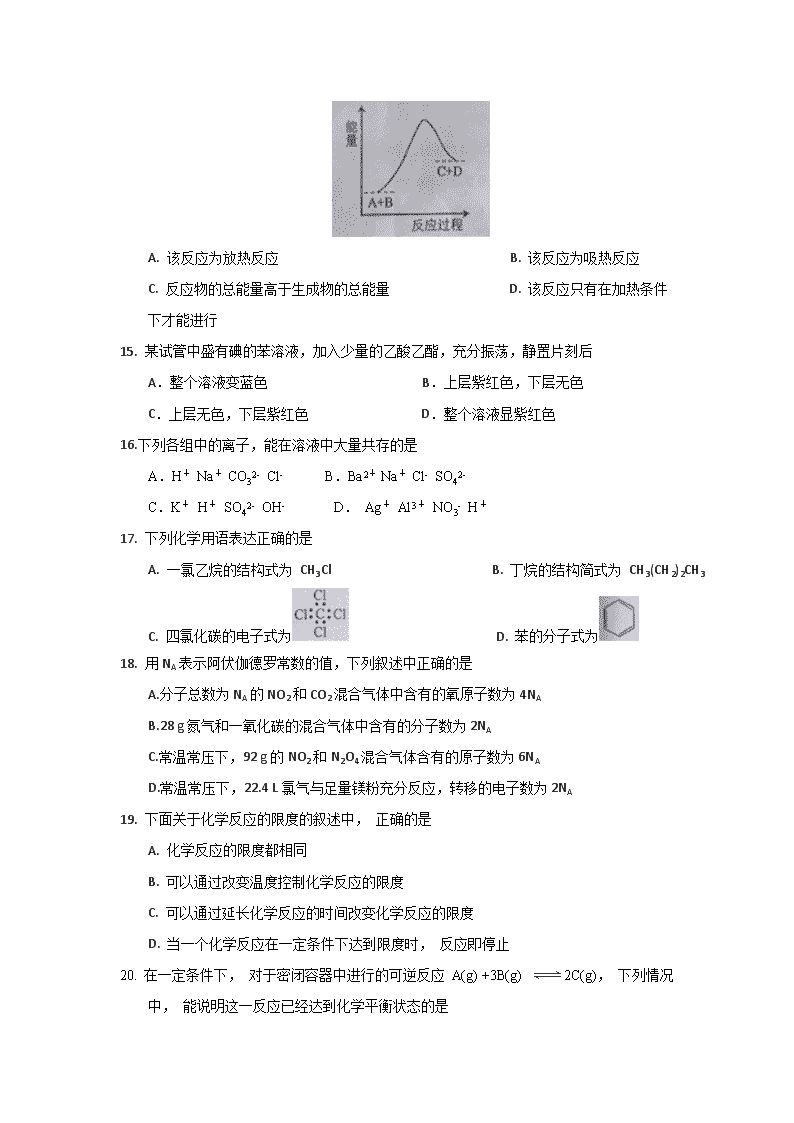
第Ⅰ卷(选择题,将答案对应选项涂在答题卡中2×21=42分) 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Cl-35.5 Fe-56 1.海水是巨大的化学资源库,下列有关海水综合利用说法正确的是 A.海水的淡化,只需经过化学变化就可以得到 B.海水蒸发制海盐的过程中只发生了化学变化 C.从海水中可以得到NaCl,电解熔融NaCl可制备金属Na D.利用海水、铝、空气的航标灯的原理是将电能转化为化学能 2.32He可以作为核聚变材料。下列关于32He的叙述中,正确的是 A.质子数为 2 B.电子数为 3 C.中子数为 2 D.质量数为 2 3.可逆反应A(g)+3B(g) 2C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率v最大的是 A.v(A)=0.9mol/(L·min) B.v (B)=0.6 mol/(L·min) C.v (C)=0.3mol/(L·min) D.v (D)=1.0 mol/(L·s) 4.下列物质中,属于天然气有机高分子化合物的是 A.葡萄糖 B.蔗糖 C.淀粉 D.油脂 5.鉴别某种白色织物是否是蚕丝制品,可选用的方法是 A.滴加盐酸 B.滴加浓硫酸 C.滴加氢氧化钠溶液 D.滴加浓硫酸 6.卤素元素随着原子序数的增大,下列递变规律正确的是 A. 单质熔、 沸点逐渐降低 B.单质的氧化性逐渐增强 C. 原子半径逐渐增大 D.气态氢化物稳定性逐渐增强 7.下列说法中正确的是 A.化学性质不同的有机物是同分异构体 B.互为同分异构体的两种有机物的物理性质有差别 C.若烃中碳、氢元素的质量分数相同,它们是同类有机物 D.分子组成相差一个或几个CH2原子团的有机物是同系物 8.下列反应的离子方程式书写中,正确的是 A.少量金属钠投入到CuSO4溶液中:2Na+Cu2+=2Na++Cu B.硫酸与氢氧化钡在溶液中反应:Ba2++SO42-= BaSO4↓ C. BaCO3与盐酸反应:CO32-+2H+=H2O+CO2↑ D.用C12将苦卤中的Br-氧化:C12+2Br-=2Cl-+Br2 9.下列关于反应能量的说法正确的是 A.A.Zn(s)+CuSO4 (aq)=ZnSO4 (aq)+Cu(s);△H=-216kJ•mol-1 B.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2.则2E1>E2 C.l0lkPa 时,2H2 (g)+O2(g)=2H2O(1);△H=-571.6 kJ•mol-1,H2的燃烧热为571.6 kJ/mol D.氧化还原反应一定是放热反应 10.废电池必须进行集中处理的首要原因是 A.充电后可再使用 B.回收利用石墨电极和金属材料 C.防止电池中汞、锅和铅等重金属离子污染土壤和水源 D.防止电池中的电解质溶液腐蚀其他物品 11.山梨酸(CH3—CH=CH—CH=CH—COOH) 是一种常用的食品防腐剂。下列关于山梨酸性质的叙述中,不正确的是 A.可与钠反应 B.可与碳酸钠溶液反应 C.可与溴的四氯化碳溶液发生取代反应 D.可生成高分子化合物 12.下列关于右图所示原电池装置的叙述中,正确的是 A. 铜片是负极 B. 铜片质量逐渐减少 C. 电流从锌片经导线流向铜片 D. 氢离子在铜片表面被还原 13. 可以用分液漏斗分离的一组混合物是 A. 酒精和碘 B. 苯和水 C. 乙酸和水 D. 溴和四氯化碳 14.已知反应 A+B=C+D 的能量变化如图所示, 下列说法正确的是 A. 该反应为放热反应 B. 该反应为吸热反应 C. 反应物的总能量高于生成物的总能量 D. 该反应只有在加热条件下才能进行 15. 某试管中盛有碘的苯溶液,加入少量的乙酸乙酯,充分振荡,静置片刻后 A.整个溶液变蓝色 B.上层紫红色,下层无色 C.上层无色,下层紫红色 D.整个溶液显紫红色 16.下列各组中的离子,能在溶液中大量共存的是 A.H+ Na+ CO32- Cl- B.Ba2+ Na+ Cl- SO42- C.K+ H+ SO42- OH- D. Ag+ Al3+ NO3- H+ 17. 下列化学用语表达正确的是 A. 一氯乙烷的结构式为 CH3Cl B. 丁烷的结构简式为 CH3(CH2)2CH3 C. 四氯化碳的电子式为 D. 苯的分子式为 18. 用NA表示阿伏伽德罗常数的值,下列叙述中正确的是 A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为4NA B.28 g氮气和一氧化碳的混合气体中含有的分子数为2NA C.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA D.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA 19. 下面关于化学反应的限度的叙述中, 正确的是 A. 化学反应的限度都相同 B. 可以通过改变温度控制化学反应的限度 C. 可以通过延长化学反应的时间改变化学反应的限度 D. 当一个化学反应在一定条件下达到限度时, 反应即停止 20. 在一定条件下, 对于密闭容器中进行的可逆反应 A(g) +3B(g) 2C(g), 下列情况中, 能说明这一反应已经达到化学平衡状态的是 A. 生成 C 的速率与 C 分解的速率相等 B. A、 B、 C 的浓度相等 C. 单位时间生成 n mol A, 同时生成 3n mol B D. A、 B、 C 的分子数之比为 1∶ 3∶ 2 21.在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质:①FeCl3;②Fe2O3;③Cu(NO3)2;④KNO3,铜粉溶解的是 A.只有①或② B.只有②或④ 22.(8分)请将下列物质的转化或分离方法的序号填写在横线上(每一项只填写一种方法),并指出属于物理变化还是化学变化。 ①溶解 ②裂解 ③分馏 ④裂化 ⑤干馏 ⑥蒸馏 ⑦电解 ⑧过滤 ⑨萃取 (1)把煤转化为焦炉气、煤焦油和焦炭等________。 (2)从原油中分离出汽油、煤油、柴油等________。 (3)将重油转化为汽油________。 (4)从海水中得到的无水MgCl2中提取金属镁________。 23.(12分)有下列物质:①乙烯 ②乙酸 ③硝基苯 ④乙酸乙酯 (1)写出①和③的官能团的名称: 和 (2)①能使溴的四氯化碳溶液褪色,其反应原理是 (用方程式表示)。 (3)实验室制取④时,饱和Na2CO3的作用是: ; ; 。 24.(8分)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。 (1)在通常状况下,金刚石和石墨中 (填“金刚石”或“石墨”)更稳定,石墨的燃烧热为 。 (2)①已知:N2、O2分子中化学键的键能分别是946KJ/mol、947KJ/mol。 N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1。 NO分子中化学键的键能为 kJ·mol-1。(键能:1mol理想气体分子AB断裂为中性气态原子A核B所需要的能量) ②综合上述有关信息,请写出CO与NO2反应的热化学方程式:________。 25.(12分)A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素,又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体. 请回答下列问题: (1)元素D在周期表中的位置 。 (2)C、D、F三种元素形成的原子的半径由大到小的顺序是 (用元素符号表示)。 (3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有 。 (4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出该反应的化学方程式: 。若E使非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: 。 (5)C、D两种元素形成的化合物C2D2常用于潜水器材,其原理是 (用化学方程式表示) 26.(12分)海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了一下实验: 请填写下列空白: (1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是______________ (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。 A.烧杯 B.坩埚 C.表面皿 D.泥三角E.酒精灯 F.干燥器 (2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是______________。 (3)步骤④加入的试剂改为通入氯气,则反应的离子方程式是____________。 (4)步骤⑤中,某学生选择用苯来提取碘的理由是_______________。 (5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:______________。 27.(6分)计算题 常温常压下,向100mL 含HCl 14.6g的盐酸力放入5.6g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至两min末,收集到1.12L(STP)氢气。在此之后,又经过4min,铁粉完全溶解。则 (1)计算前2min内用FeCl3表示的平均反应速率 (2)前2min和后4min相比,反应速率较快的是?(请计算说明,并简述原因)查看更多