- 2021-08-06 发布 |
- 37.5 KB |
- 28页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习原子结构、元素周期表、微粒间的作用力、晶体结构课件(28张)(全国通用)
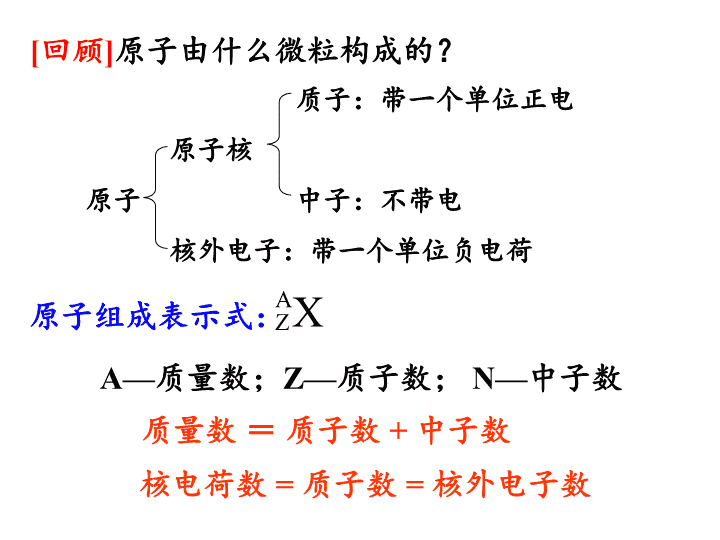
第十一讲 原子结构、元素周期表、微粒间的作用力、晶体结构 [ 回顾 ] 原子由什么微粒构成的? 质子:带一个单位正电 原子核 原子 中子:不带电 核外电子:带一个单位负电荷 核电荷数 = 质子数 = 核外电子数 原子组成表示式: A Z X A— 质量数; Z— 质子数; N— 中子数 质量数 = 质子数 + 中子数 +8 2 6 A BCDE 电子层 该电子层上的电子数 质子数 ( 核电荷数 ) 原子核 原子核带正电 氧原子结构示意图 [ 思考 ] 如何表示核外电子的分层排布? A 、 B 、 C 、 D 、 E 分别代表什么含义? [ 练习 ] 画出 C 、 Ar 、 K 元素的原子结构示意图以及 Mg 、 O 元素的离子结构示意图。 考点一:原子核外电子的排布 [ 小结 ] 原子核外电子排布规律 最多容纳原则: (1) 各电子层最多容纳的电子数为 2n 2 个; (2) 最外层电子数不超过 8 个 (K 层为最外层不超过 2 个 ) ,次外层不超过 18 个 (K 为次外层为 2 个,倒数第三层最多容纳 32 个电子 ) 能量最低原则: (3) 核外电子排布时,按能量由低到高排布,先排满内层,再依次排向外层。 [ 注意 ] 以上规律必须同时遵循! 道尔顿“ 实心球 ” 模型 汤姆森“ 葡萄干面包式 ”模型 卢瑟福“ 行星式 ”模型 玻尔“ 量子化轨道 ” 模型 [ 回顾 ] 原子结构模型的演变过程是怎样的?分别是由哪些科学家提出的? 电子云 模型 考点二:原子结构模型、原子符号、核素、同位素 考点二:原子结构模型、原子符号、核素、同位素 [ 例 ] 写出下列原子符号 1 、质量数分别为 16 、 18 的氧原子 2 、质量数都为 40 的钾原子和钙原子 [ 思考 ] 上述有几种元素?几种核素?是否有同位素? 质子数相同 中子数不同,质量数不同 属同种元素 不同种原子 (不同的核素) 质子数相同 而中子数不同的核素 互称 同位素 [ 练习 ] 下列粒子半径大小的比较正确的是 ( ) A 、 Na + < Mg 2 + < Al 3 + < O 2 - B 、 S 2 - > Cl - > Na + > Al 3 + C 、 Na < Mg < Al < S D 、 Cs < Rb < K < Na B 正确应如何排序? 考点三:微粒半径大小比较 考点四:元素周期律 1 、含义: 2 、周期性变化的体现: 3 、引起元素性质周期性变化的本质原因 元素原子核外电子排布的周期性变化。 (1) 最外层电子数:从 1 → 8 【H 、 He 除外 】 (2) 原子半径:大 → 小 【 除稀有气体外 】 (3) 元素化合价:最高正价 +1 → +7 ;最低负价 -4 → -1 (4) 元素的金属性、非金属性的强弱呈现周期性变化 元素的性质随着元素原子序数的递增而呈周期性的变化的规律 。 Na Mg Al Si P S Cl 最外层 电子数 原子半径 最高正价 最低负价 气态氢化物 最高价氧化物 对应水化物 元素性质变化 [ 练习 ] 以第三周期元素为例填写下列表格。 1 2 3 4 5 6 7 从左到右,逐渐减小 +1 +2 +3 +4 +5 +6 +7 -4 -3 -2 -1 HCl SiH 4 PH 3 H 2 S Cl 2 O 7 Na 2 O MgO Al 2 O 3 SiO 2 P 2 O 5 SO 3 Mg(OH) 2 NaOH Al(OH) 3 H 3 PO 4 H 4 SiO 4 H 2 SO 4 HClO 4 从左到右,金属性减弱,非金属性增强 金属元素 无气态氢化物 主要化合价: 最高正价 = 最外层电子数 最低负价 = 最外层电子数 - 8 [ 练习 ] 某短周期非金属元素 A 最外层电子数为 n , (1) 写出其气态氢化物、最高价氧化物的化学式; (2) 若其气态氢化物能与其最高价氧化物对应的水化物反应生成盐。请画出该元素的原子结构示意图。 [ 思考 ] 某元素最外层电子数为 7 ,则该元素最高正价一定是 +7 ? [ 注意 ] F 无正价 ! (1) 与水或酸置换氢的难易 (2) 最高价 氧化物对应水化物的碱性强弱 (3) 单质的还原性强弱 [ 金属间的置换 ] (4) 电化学反应 原电池反应中,作负极的金属 ; 在电解池的阴极上先析出的金属 。 活泼 不活泼 (1) 单质与氢气化合的难易 (2) 气态氢化物的稳定性 (3) 最高价 氧化物对应水化物酸性的强弱 (4) 单质的还原性强弱 [ 非金属单质间的置换反应 ] [ 回顾 ] 元素金属性强弱的实验依据有哪些? [ 回顾 ] 元素非金属性强弱的实验依据有哪些? [ 练习 ] 下列事实能说明氯元素原子得电子能力比硫元素原子强的是 __________________ 。 ① HCl 的溶解度比 H 2 S 大 ② HCl 的酸性比 H 2 S 强 ③ HCl 的稳定性比 H 2 S 大 ④ HCl 的还原性比 H 2 S 弱 ⑤ HClO 4 的酸性比 H 2 SO 4 强 ⑥ Cl 2 与铁反应生成 FeCl 3 ,而 S 与铁反应生成 FeS ⑦ Cl 2 能与 H 2 S 反应生成 S ⑧在周期表中 Cl 处于 S 同周期的右侧 ⑨还原性: Cl - < S 2- ⑩ 氯原子达稳定结构所需电子比硫原子少 [ 思考 ] 请从微粒间作用力的角度解释: HCl 的稳定性比 H 2 S 大。 [ 思考 ] 请从原子结构的角度解释:还原性 Cl - < S 2 - ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ [ 练习 ] 甲、乙两种非金属:①甲比乙容易与氢气化合;②甲原子能与乙的阴离子发生置换反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质的熔、沸点比乙的低。能说明甲比乙的非金属性强的是 ( ) A 、只有④ B 、只有⑤ C 、 ①②③ D 、 ①②③④⑤ C [ 练习 ] 下列各组化合物中的性质比较,不正确的是 ( ) A 、酸性: HClO 4 > HBrO 4 > HIO 4 B 、 热稳定性: H 2 O > HF > H 2 S C 、碱性: Ba(OH) 2 > Ca(OH) 2 > Mg(OH) 2 D 、还原性: F – > Cl – > Br – BD 判断非金属性: 根据得电子的 难易 判断,而非根据得电子的数目判断。 考点五:元素周期表的结构 [ 思考 ] 元素周期表中周期,族如何划分,元素数目有多少? 周期: 7 个 族: 16 个 ( 共 18 个纵列 ) 短周期:第 1 、 2 、 3 周期, 分别有 2 、 8 、 8 种元素 长周期:第 4 、 5 、 6 、 7 周期, 分别有 18 、 18 、 32 、 32 种元素 主族: 7 个 (Ⅰ A~Ⅶ A) 副族: 7 个 (Ⅰ B~Ⅶ B) 第 Ⅷ 族: 1 个 ( 第 8 、 9 、 10 三个纵列 ) 零族: 1 个 ( 稀有气体 ) [ 练习 ] 已知某主族元素的原子结构示意图如下,判断其位于周期表的位置。 +19 2 8 8 1 +53 2 8 18 18 7 [ 思考 ] 元素在周期表中的位置由什么决定? 对主族元素而言, 最外层电子数 = 族序数 电子层数 = 周期序数 [ 思考 ] 请描述元素周期表中原子半径、元素金属性和非金属性的递变规律。 H Li Be B C N O F Na Mg Al Si P S Cl K Ca Ga Ge As Se Br Rb Sr In Sn Sb Te I Cs Ba Tl Pb Bi Po At 半径 减小 、 非金属性 增强 、 金属性 减弱 半径 增大 、 非金属性 减弱 、 金属性 增强 (1) 推测未学元素的某些性质。 如砹 (At 2 ) 应为有色 ( 气体 / 液体 / 固体 ) ,与氢气 化合 ( 易 / 难 ) , HAt ( 稳定 / 不稳定 ) ,水溶液呈 性 ( 酸 / 中 / 碱 ) , AgAt 溶于水 ( 易 / 难 ) 。 (2) 启发人们在一定区域内寻找新物质 [ 农药、半导体、催化剂等 ] 。 农药 半导体 催化剂 考点六:元素周期表的应用 固体 难 不稳定 酸 难 非金属元素区域 金属、非金属元素交界线附近 过渡元素区域 考点七:“位 — 构 — 性”综合运用 结构 位置 性质 反映 决定 反映 决定 判断元素推出位置 通过位置运用递变规律推出 [ 练习 ] X 、 Y 、 Z 和 W 代表原子序数依次增大的四种短周期元素,它们满足以下条件: ① 元素周期表中, Z 与 Y 相邻, Z 与 W 也相邻; ②Y 、 Z 和 W 三种元素的原子最外层电子数之和为 17 。 请填空 : (1)Y 、 Z 和 W 三种元素是否位于同一周期 ( 填“是”或“否” ) : _______ ,理由是 __________________________________________________ ; (2)Y 是 _______ , Z 是 _______ , W 是 ________ ; (3)X 、 Y 、 Z 和 W 可组成一化合物,其原子个数之比为 8:2:4:1 。写出该化合物的名称及化学式是 _________________________ 。 否 如果位于同一周期,则其电子数之和应该是 3 的倍数 N O S 硫酸铵 (NH 4 ) 2 SO 4 [ 练习 ] 几种短周期元素的原子半径及主要化合价见下表: 元素代号 K L M Q R T N 原子半径/ nm 0.183 0.160 0.143 0.102 0.089 0.074 0.152 主要化合价 +1 +2 +3 +6 、- 2 +2 - 2 +1 下列叙述正确的是 ( ) A . K 、 L 、 M 三元素的金属性逐渐增强 B .在 RCl 2 分子中,各原子均满足 8 电子的稳定结构 C . Q 元素的最高价氧化物为电解质,其水溶液能够导电 D . K 在 T 单质中燃烧所形成的化合物中含有共价键和离子键 D O S Be Mg Na Al Li [ 练习 ] 根据周期表对角线规则,金属 Be 与 Al 单质及其化合物性质相似,又已知 AlCl 3 熔沸点较低,易升华。试回答下列问题: (1) 写出 Be 与 NaOH 溶液反应生成 Na 2 BeO 2 的离子方程式 。 (2)Be(OH) 2 与 Mg(OH) 2 可用试剂 鉴别,其离子方程式为 。 (3)BeCl 2 是 化合物 ( 填写“离子”或“共价” ) 。 (4)Li 与 Mg 根据对角线规则,性质也相似,则 Li 在空气中燃烧,主要产物的化学式是 。 Be + 2OH - = BeO 2 2- + H 2 ↑ NaOH 溶液 Be(OH) 2 + 2OH - = BeO 2 2- + 2H 2 O 共价 Li 2 O 考点八:微粒间的作用力 [ 思考 ] 请分析微粒间作用力、化学键、共价键、离子键、金属键、分子间作用力、氢键这些概念间的关系? 微粒间作用力 化学键 分子间作用力 共价键 离子键 金属键 包含氢键 ( 强烈 ) ( 微弱 ) [ 思考 ] 除了稀有气体原子,其他原子是如何达到稳定结构的? [ 练习 ] 下列物质中 ①晶体硅 ②石英 ③ H 2 SO 4 ④NaHSO 4 ⑤Na 2 O 2 ⑥H 2 O 2 ⑦ 液氨 ⑧ NH 4 Cl ⑨Ar 含离子键的是 , 含共价键的是 , 既含离子键又含共价键的是 , 不存在化学键的是 , 存在分子间作用力的是 , 存在氢键的的是 。 ④⑤⑧ ①②③④⑤⑥⑦⑧ ④⑤⑧ ⑨ ③⑥⑦⑨ ⑦ [ 练习 ] 判断下列说法的对错 1 、含有共价键的化合物一定是共价化合物。 2 、共价化合物只含共价键。 3 、含有离子键的化合物一定是离子化合物。 4 、离子化合物可以含共价键。 5 、只含有共价键的物质一定是共价化合物。 6 、由分子构成的物质一定含共价键。 7 、共价化合物一定是共价分子。 错(如 NaOH 、 NH 4 Cl ) 错(如 H 2 ) 对 错(稀有气体分子) 对 对 错(如 SiO 2 等) [ 练习 ] 判断下列物质融化或溶于水过程中克服哪些作用力? 1 、干冰与石英融化 2 、单质碘与单质硅融化 3 、 NaOH 与 NaHSO 4 固体融化 4 、氯化氢与乙醇溶于水 5 、 NaOH 与 NaHSO 4 溶于水 分子间作用力;共价键 分子间作用力;共价键 均是离子键 共价键;分子间作用力 离子键;离子键和共价键 考点九:晶体结构 [ 思考 ] 请分析原子晶体、金属晶体分别是由什么微粒通过什么作用力聚集而成的? [ 思考 ] 阴阳离子、分子是如何聚集成宏观晶体的? [ 思考 ] 稀有气体原子聚集成的宏观晶体属于什么晶体? [ 思考 ] 如何区分哪些物质属于哪种晶体类型? 角度 1 :物质的类别 角度 2 :物质的性质 ( 熔融态的导电性、熔沸点高低等 ) [ 思考 ] 结构决定性质,请从晶体的微观结构解释为什么熔沸点、硬度一般都是:原子晶体 > 离子晶体 > 分子晶体? [ 思考 ] 比较下列物质在相同条件下的熔沸点高低。 ① 金刚石 晶体硅 SiC NaCl ② H 2 O H 2 S H 2 Se ③ CH 3 OH C 3 H 6 正丁烷 异丁烷 [ 练习 ] 判断下列说法的正误,说明理由。 1 、 HCl 、 HBr 、 HI 的分子间作用力依次 增大,分子稳定性依次增强。 2 、由于水分子间存在氢键,所以水分子非常稳定。 3 、 NaOH 与 MgBr 2 化学键类型相同、晶体类型也相同。 4 、 C 60 与金刚石化学键类型相同、晶体融化时克服微粒间的作用力类型也相同。 5 、干冰、白磷、石英、食盐的熔沸点依次升高。 6 、乙醇与乙醚属于同分异构体,熔沸点相同。 7 、 CCl 4 和 PCl 5 中,每个原子的最外层都具有 8 电子稳定结构。 × × × × × × ×查看更多