- 2021-08-06 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年湖南省郴州市临武一中、嘉禾一中高二12月联考化学试题
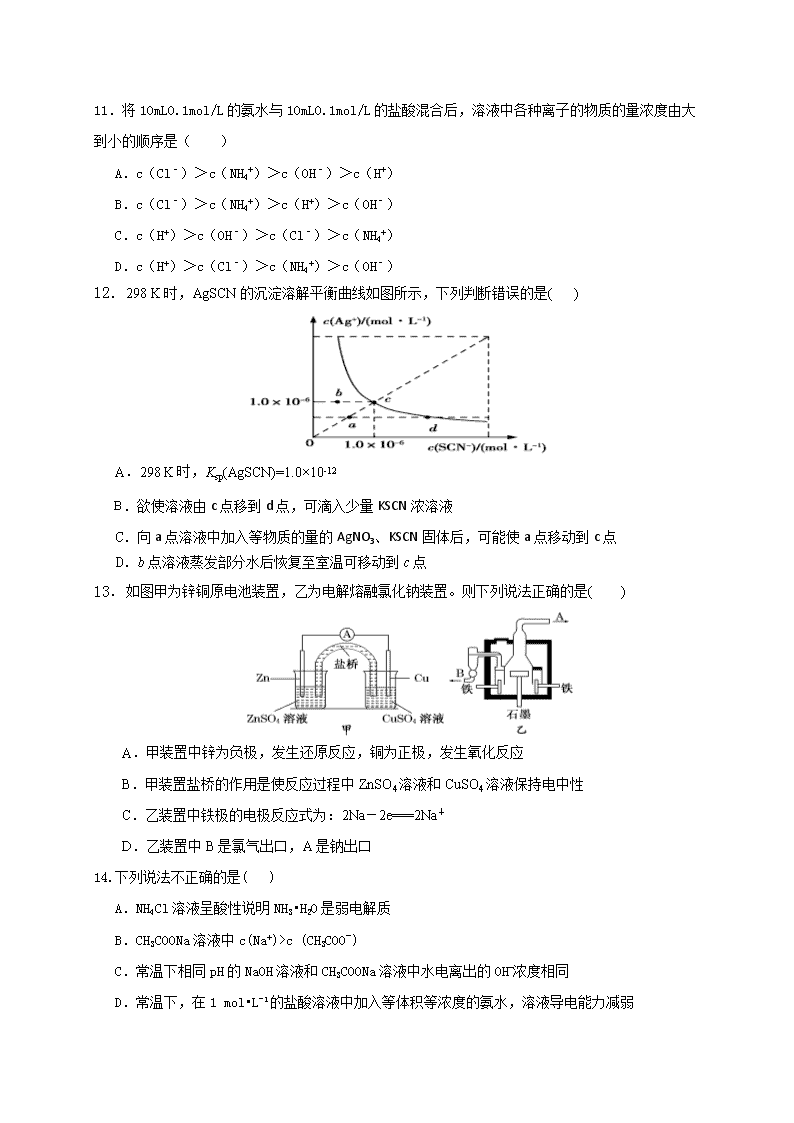
2017-2018学年湖南省郴州市临武一中、嘉禾一中高二12月联考化学 一、选择题(本题包括16小题,每小题3分,共48分。) 1、下列变化中,一定不存在化学能与热能相互转化的是( ) A.铝热反应 B.金属钝化 C.干冰气化 D.燃放爆竹 2、下列有关化学反应速率的说法正确的是( ) A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 B.100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 C.SO2的催化氧化是一个放热的反应,所以,升高温度,反应的速率减慢 D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 3、将纯水加热到较高温度,以下叙述正确的是( ) A.水的离子积变大、pH变小、呈中性 B.水的离子积不变、pH不变、呈中性 C.水的离子积变小、pH变大、呈碱性 D.水的离子积变大、pH变小、呈酸性 4.下列热化学方程式书写正确的是(ΔH的绝对值均正确)( ) A.C2H5OH(l)+3O2(g)2CO2(g)+3H2O(g) ΔH=-1367.0 kJ·mol-1(燃烧热) B.NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热) C.2NO2O2+2NO ΔH=+116.2 kJ·mol-1(反应热) D.S(s)+O2(g)SO2(g) ΔH=-296.8 kJ·mol-1(反应热) 5、某反应由AB、BC两步反应构成,反应的能量变化曲线如图所示,E1、E2、E3、E4表示活化能,下列有关该反应的ΔH的计算正确的是( ) A.ΔH=(E1+E2)-(E4+E3) B.ΔH=(E4+E3)-(E1+E2) C.ΔH=(E1+E2+E3)-E4 D.ΔH=(E1+E3)-(E2+E4) 6.在一个5L的容器里,盛有8.0mol某气态反应物,5min后,测得这种气态反应物还剩余3.0mol,则这种反应物在此时间内的化学反应速率为( ) A.0.1mol/(L•min) B.0.2mol/(L•min) C.0.3mol/(L•min) D.0.4mol/(L•min) 7.研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。有人利用如图所示装置(均为惰性电极)从海水中提取CO2。下列叙述正确的是( ) A.a室产生氢气 B.错误!未找到引用源。由b室向c室迁移 C.b室中提取CO2反应的离子方程式为错误!未找到引用源。+H+CO2↑+H2O D.c室溶液pH减小 8.可逆反应2NO2(g) 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( ) ①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态 A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部 9.为更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,.下列叙述中正确的是( ) ①任何温度下,纯水的AG等于0; ②溶液的AG越小,酸性越强; ③常温下,0.1mol/l盐酸的AG=12; ④25℃时,某溶液的AG=-10,其pH=10. A.①③ B.②④ C.①② D.③④ 10.有4种混合溶液,分别由等体积0.1 mol·L-1的2种溶液混合而成:①CH3COONa与HCl,②CH3COONa与NaOH,③CH3COONa与NaCl,④CH3COONa与NaHCO3。下列关系正确的是( ) A.pH:②>③>④>① B.c(CH3COO-):②>④>③>① C.c(H+):①>③>②>④ D.c(CH3COOH):①>④>③>② 11.将10mL0.1mol/L的氨水与10mL0.1mol/L的盐酸混合后,溶液中各种离子的物质的量浓度由大到小的顺序是( ) A.c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+) B.c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣) C.c(H+)>c(OH﹣)>c(Cl﹣)>c(NH4+) D.c(H+)>c(Cl﹣)>c(NH4+)>c(OH﹣) 12.298 K时,AgSCN的沉淀溶解平衡曲线如图所示,下列判断错误的是( ) A.298 K时,Ksp(AgSCN)=1.0×10-12 B.欲使溶液由c点移到d点,可滴入少量KSCN浓溶液 C.向a点溶液中加入等物质的量的AgNO3、KSCN固体后,可能使a点移动到c点 D.b点溶液蒸发部分水后恢复至室温可移动到c点 13.如图甲为锌铜原电池装置,乙为电解熔融氯化钠装置。则下列说法正确的是( ) A.甲装置中锌为负极,发生还原反应,铜为正极,发生氧化反应 B.甲装置盐桥的作用是使反应过程中ZnSO4溶液和CuSO4溶液保持电中性 C.乙装置中铁极的电极反应式为:2Na-2e===2Na+ D.乙装置中B是氯气出口,A是钠出口 14.下列说法不正确的是( ) A.NH4Cl溶液呈酸性说明NH3•H2O是弱电解质 B.CH3COONa溶液中c(Na+)>c (CH3COO-) C.常温下相同pH的NaOH溶液和CH3COONa溶液中水电离出的OH-浓度相同 D.常温下,在1 mol•L-1的盐酸溶液中加入等体积等浓度的氨水,溶液导电能力减弱 15、硫酸生产中炉气转化反应为2SO2(g)+O2(g)2SO3(g)。研究发现,SO3的体积分数 (SO3%)随温度(T)的变化如曲线I所示。下列判断不正确的是 ( ) A.该反应的正反应为放热反应 B.曲线I上A、C两点反应速率的关系是:VA查看更多