河北省邯郸市大名中学2019-2020学年高一(清北班)下学期6月第三周周测化学试题
化学试卷
考试范围:必修二专题一至专题二 时间:90分钟 满分:100分
相对原子质量:H 1 Li 7 C 12 N 14 O 16 Cl 35.5 Fe 56 Mn 55 Ba 137
一、单选题(每小题3分,共54分。每小题只有一个选项符合题目要求。)
1.下列化学用语或模型图表示正确的是
A.S2−的结构示意图为:
B.CO2分子比例模型:
C.6个质子8个中子的碳元素的核素符号:12C
D.NH4Cl的电子式:
2.下列关于化学反应中能量变化的说法正确的是
A.断开化学键会释放能量 B.氧化还原反应均为放热反应
C.化学反应过程中一定伴有能量变化 D.需要加热才能发生的反应一定是吸热反应
3.重水(D2O)是重要的核工业原料,下列说法错误的是
A.氘(D)原子核外有1个电子 B.H2O与D2O互称同素异形体
C.1H与D互称同位素 D.1H218O与D216O的相对分子质量相同
4.下列各组物质的分类正确的是( )
①同位素:1H、2H2、3H ②同素异形体:C80、金刚石、石墨
③酸性氧化物:CO2、NO、SO3 ④混合物:水玻璃、水银、水煤气
⑤电解质:明矾、冰醋酸、石膏 ⑥干冰、液氯、乙醇都是非电解质
A.②⑤ B.②⑤⑥ C.②④⑤⑥ D.①②③④⑤⑥
5.下列说法正确的是
A.同一周期相邻主族的两种元素的原子序数之差一定是1
B.同一主族的两种元素的原子序数之差可能是36
C.同一主族相邻周期的两种元素的原子序数之差可能是26
D.同一主族相邻周期的两种元素的原子序数之差都相同
6.在2A+B3C+4D反应中,表示该反应速率最快的是
A.υ(A)=15mol·(L·min)−1 B.υ(B)=18mol·(L·min)−1
C.υ(C)=0.8mol·(L·s)−1 D.υ(D)=1mol·(L·s)−1
7.下列变化属于吸热反应的是
①液态水汽化 ②将胆矾加热变成白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A.①②④ B.②③ C.①④⑤ D.②④
8.在恒温、恒容的密闭容器中进行反应A(g)=B(g)+C(g)。若反应物A的浓度由2mol·L−1降到0.8mol·L−1需20s,那么反应物浓度由0.8mol·L−1降到0.2mol·L−1所需反应时间为
A.10s B.大于10s C.小于10s D.无法判断
9.容积固定的2L密闭容器中进行的某一可逆反应A(g)+B(g) 2C(g),以B的浓度改变表示反应速率,其与时间的关系如图L218所示,已知速率的单位为mol·L-1·s-1,则图中阴影部分的面积表示( )
图L218
A.A浓度的减小 B.B浓度的减小
C.C物质的量增加 D.B物质的量减小
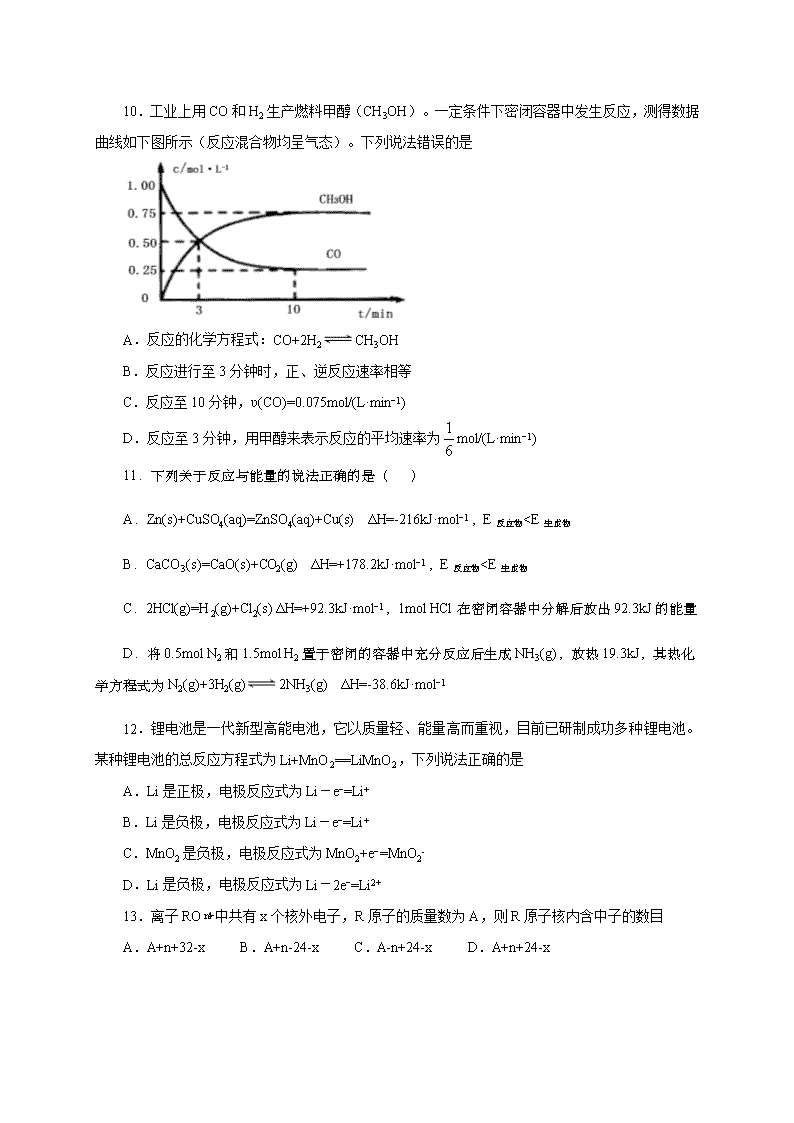
10.工业上用CO和H2生产燃料甲醇(CH3OH)。一定条件下密闭容器中发生反应,测得数据曲线如下图所示(反应混合物均呈气态)。下列说法错误的是
A.反应的化学方程式:CO+2H2CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,ʋ(CO)=0.075mol/(L·min−1)
D.反应至3分钟,用甲醇来表示反应的平均速率为mol/(L·min−1)
11.下列关于反应与能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216kJ·mol−1,E反应物
b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
16.反应8NH3+3Cl2→N2+6NH4Cl的相关描述中正确的是( )
A.N2的电子式是
B.反应物和生成物的化学键类型相同
C.每生成11.2L N2,转移电子数为3NA
D.还原剂与还原产物的物质的量之比是1∶3
17.现有甲、乙、丙三种元素,其原子序数都不超过20。有关信息如下:
元素代号
相关信息
甲
n为电子层数,甲原子最外层电子数为(2n2-1)
乙
在周期表中它的周期数为k,主族序数为(2k+1)
丙
电子层数大于最外层电子数
下列关于甲、乙、丙元素的相关分析正确的是( )
A.甲的单质难溶于水 B.乙的气态氢化物易溶于水
C.丙的最高价氧化物对应的水化物是强碱 D.丙的单质与冷水剧烈反应
18.在两个恒温、恒容的密闭容器中进行下列两个可逆反应:(甲)2X(g)Y(g)+Z(s) (乙)A(s)+2B(g)C(g)+D(g),当下列物理量不再发生变化时:①混合气体的密度;②混合气体的压强;③反应物的消耗速率与生成物的消耗速率之比等于系数之比;④反应容器中生成物的百分含量;⑤混合气体的总物质的量。其中能表明(甲)和(乙)都达到化学平衡状态是
A.①②③ B.①②③④ C.①③④ D.①②③④⑤
二、 非选择题(共46分)
19.(11分)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为该电池的工作原理示意图,该电池的电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定。请回答:
(1)氢氧燃料电池放电时能量转化形式主要是________,在导线中电子流动方向为________(用a、b表示)。
(2)正极反应式为__________________。
(3)电极表面镀铂粉的原因为__________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.Li+H22LiH Ⅱ.LiH+H2O=LiOH+H2↑
①反应Ⅰ中的氧化剂是________,反应Ⅱ中的还原剂是____________。
②已知LiH固体的密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③将由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol。
20.(13分)X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1∶2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:
(1)元素X的最高价氧化物的电子式为________;元素Y、Z、W的原子半径由大到小顺序为________。
(2)单质铜和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为____________________________________。
(3)元素W位于周期表的第 周期第________族,其非金属性比R弱,用原子结构的知识解释原因:_____________________________。元素W和R的气态氢化物的稳定性关系为:________(写出化学式)。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的化学方程式:________________________________。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1∶3,则该反应的化学方程式为______________________________________。
21.(10分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)2NH3(g)。
(1)若反应到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=____mol;
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量_____;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平) =______;
(4)原混合气体中,a∶b=_____;
(5)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=______。
22.(12分)熔融盐燃料电池具有较高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为2C4H10+26CO-52e-===34CO2+10H2O。
请回答下列问题:
(1)该电池的反应方程式为____________________________________________________。
(2)正极电极反应式为________________________________________________________。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是__________,它来自______________。
(4)某学生想用该燃料电池和如图所示装置来电解饱和食盐水:
①写出反应的离子方程式:_________________________________________________
________________________________________________________________________。
②将湿润的淀粉KI试纸放在该装置附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸。该反应的化学方程式为_________________________________________________
________________________________________________________________________。
③若电解后得到200 mL 3.25 mol/L NaOH溶液,则消耗C4H10的体积在标准状况下为________mL。
化学答题纸
姓名:________________ 班级:________________
一.选择题,每题3分,题共54分。
题号
1
2
3
4
5
6
7
8
9
答案
题号
10
11
12
13
14
15
16
17
18
答案
二、非选择题,共46分。
19.(11分)(1)_______________________________________, ________________________________(用a、b表示)。
(2) _________________________________________________________。
(3) ____________________________________________。
(4)① __________________________, __________________________。
②__________________________。
③__________________________mol。
20.(13分)(1)__________________________; ______________________。
(2)___________________________________________。
(3)_____________族, _____________________。
___________________________________________________________________。
________________________(写出化学式)。
(4)___________________________________________。
(5)_________________________________________________。
21.(10分)(1)_______________mol;
(2)________________;
(3)________________;
(4)________________;
(5)_________________。
22.(12分)
(1) ____________________________________________________。
(2) ________________________________________________________。
(3) _____________________, _________________________。
(4)
①: ________________________________________________________________________。
②________________________________________________________________________。
③___________________mL。
化学答案
1.【答案】A
2.【答案】C
【解析】A.断裂化学键吸收热量,形成化学键释放能量,故A错误;B.C或氢气作还原剂的氧化还原反应吸热,多数氧化还原反应放热,故B错误;C.化学变化中有化学键的断裂和生成,则一定有能量变化,故C正确;D.反应条件与反应中能量变化无关,加热进行的反应可能为放热反应,故D错误;故选:C。
3.【答案】B
【解析】A.氘(D)质子数为1,质子数=核外电子数,故原子核外有1个电子,故A正确,但不符合题意;B.H2O与D2O均为水,属于化合物,不互为同素异形体,故B错误,符合题意;C.1H与D质子数都是1,中子数分别为0、1,互称同位素,故C正确,但不符合题意;D.1H218O的相对分子质量为:1×2+18=20,D216O的相对分子质量为:2×2+16=20,故D正确,但不符合题意;故选:B。
4.【答案】A
【解析】①质子数相同而中子数不同的同一种元素的不同核素互为同位素,2H2是单质,不是核素,①错误;②由同一种元素形成的不单质互为同素异形体,C80、金刚石、石墨均是碳元素形成的不同单质,②正确;③能与碱反应生成盐和水的氧化物是酸性氧化物,NO不是酸性氧化物,③
错误;④水银是单质,④错误;⑤溶于水或熔融状态下能导电的化合物是电解质,明矾、冰醋酸、石膏均是电解质,⑤正确;⑥溶于水和熔融状态下不能导电的化合物是非电解质,液氯是单质,不是非电解质,⑥错误。答案选A。
5.【答案】B
6.【答案】B
7.【答案】D
【解析】①液态水汽化是吸热过程,是物理变化,不属于化学反应,不符合题意;②将胆矾加热变成白色粉末,失去结晶水发生化学反应,是吸热反应,符合题意;③浓硫酸稀释过程放热,不符合题意;④在加热条件下氯酸钾发生分解反应制氧气,是吸热反应,符合题意;⑤生石灰跟水反应生成熟石灰,是放热反应,不符合题意;据此回答;答案选D。
8.【答案】B
【解析】反应物的浓度越大,反应速率越大;反应物A的浓度由2mol·L−1降到0.8mol·L−1需20s,那么反应物浓度由0.8mol·L−1降到0.2mol·L−1的这个过程中,A的浓度比前一段的小,故反应速率也小,则所需时间增加,故该过程的时间要大于10s,故选B。
9.【答案】B [解析] 物理上,v=。因此,物质运动速率与时间的关系图中,一段时间内,速率曲线扫过的阴影是位移,那么化学上v=,因此化学反应速率与时间的关系图中,一段时间内,反应速率曲线扫过的阴影面积是浓度的变化,本题图中的阴影面积为正反应速率与逆反应速率扫过的阴影面积之差,即B浓度的减小。
10.【答案】B
【解析】由图可知,CO的浓度减小,甲醇浓度增大,且平衡时c(CO)=0.25mol/L,c(CH3OH)=0.75mol/L,转化的c(CO)=0.75mol/L,结合质量守恒定律可知反应为CO+2H2CH3OH,3min时浓度仍在变化,浓度不变时为平衡状态,以此来解答。A.用CO和H2生产燃料甲醇,反应为CO+2H2CH3OH,故A正确;B.反应进行至3分钟时浓度仍在变化,没有达到平衡状态,则正、逆反应速率不相等,故B错误;C.反应至10分钟,ʋ(CO)==0.075mol/(L·min),故C正确;D.反应至3分钟时,ʋ(CH3OH)==mol/(L·min−1);故答案为B。
11.【答案】B
【解析】A.当反应物总能量<生成物总能量,则反应是吸热反应,但该反应ΔH<0,A项错误;B.当反应物总能量<生成物总能量,则反应是吸热反应,该反应ΔH>0,B项正确;C.根据热化学方程式2HCl(g)=H2(g)+Cl2(s) ΔH=+92.3kJ·mol−1可知HCl分解是吸热反应,C项错误;D.反应N2(g)+3H2(g)
2NH3(g)是可逆反应,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g)小于1.0mol,放热19.3kJ,则热化学方程式应为N2(g)+3H2(g)2NH3(g) ΔH<-38.6kJ·mol−1,D项错误;答案选B。
12.【答案】B
【解析】在原电池中,失电子的金属为负极,发生失电子的氧化反应,得电子的物质在正极发生还原反应,锂电池是一种体积小,储存能量较高的可反复充电的环保电池。A.根据锂电池的总反应式Li+MnO2=LiMnO2,失电子的金属Li为负极,电极反应为:Li-e−=Li+,故A错误;B.根据锂电池的总反应式Li+MnO2=LiMnO2,失电子的金属Li为负极,电极反应为:Li-e−=Li+,故B正确; C.MnO2是正极,电极反应为MnO2+e−=MnO,故C错误;D.负极电极反应为:Li-e−=Li+,故D错误;故答案为B。
13.【答案】A
14.【答案】A
15.【答案】C
【解析】装置1:a极质量减小,b极质量增加,a极为负极,b极为正极,说明金属的活动性顺序a>b;装置2:b极有气体产生,c极无变化,说明金属的活动性顺序b>c;装置3:d极溶解,则d是负极,c极有气体产生,c是正极,所以金属的活动性顺序d>c;装置4:电流从a极流向d极,则a极为正极,d极为负极,因此金属的活动性顺序d>a;所以这四种金属的活动性顺序d>a>b>c,故合理选项是C。
16.【答案】D
【解析】A.氮气的电子式为:;B.反应物氨气和氯气均只含有共价键,生成物NH4Cl中铵根和氯离子为离子键,故B错误;C.未指明温度和压强,无法确定11.2L N2的物质的量,无法确定转移电子数,故C错误;D.反应中NH3为还原剂,NH4Cl为还原产物,由方程式可知,当有8mol NH3参加反应,有2mol被氧化,生成6mol NH4Cl,则该反应中还原剂与还原产物的物质的量之比是1∶3,故D正确;故答案为D。
17.【答案】B
【解析】选B。根据原子最外层电子数不超过8,K层为最外层时电子数不超过2以及原子序数不超过20,确定可能的电子层数,分别讨论对应的元素。对于甲元素,若n=1、2,则甲原子最外层电子数依次为1、7,即甲为氢、氟元素。对于乙元素,若k=2、3,乙原子最外层电子数分别为5、7,对应元素分别为氮、氯。对于丙元素,若电子层数为2,则丙为锂;若电子层数为3,则丙为钠、镁;若电子层数为4,则丙为钾、钙。甲的单质有氢气和氟气,其中氟气与水剧烈反应:2F2+2H2O===4HF+O2,A错误; B正确;丙的最高价氧化物对应的水化物有氢氧化锂、氢氧化镁、氢氧化钙、氢氧化钠、氢氧化钾,其中氢氧化镁属于中强碱,C错误;丙的单质有钠、镁、锂、钾和钙,镁与冷水反应很慢,D错误。
18.【答案】C
19.【答案】(1)由化学能转变为电能(1分) 由a到b(表达形式合理均可)(1分)
(2)O2+2H2O+4e−=4OH−(2分)
(3)增大电极单位面积吸附H2、O2的分子数,加快电极反应速率(1分)
(4)H2(1分) LiH(1分) 8.71×10−4∶1(2分) 32(2分)
20.【答案】(1)(1分) Al>P>N(1分)
(2)4HNO3(浓)+Cu=2NO2↑+Cu(NO3)2+2H2O(2分)
(3)三(1分) ⅤA(1分) P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱(2分) H2S>PH3(1分)
(4)SO2+NH3·H2O=NH4HSO3(或SO2+NH3+H2O=NH4HSO3也合理)(2分)
(5)Al2O3+3C+N22AlN+3CO(2分)
21.【答案】(1)16mol (2)8mol (3)5∶4 (4)2∶3 (5)3∶3∶2
【解析】(1)根据N2(g)+3H2(g)2NH3(g)反应可推知:反应某时刻t时,n(NH3)=6mol,则消耗n(N2)=3mol,开始加入n(N2)=13mol+3mol=16mol;(2)反应达平衡时,混合气体的体积为716.8 L(标况下),则气体的物质的量是32mol,NH3的含量(体积分数)为25%,所以氨气的物质的量是32mol×25%=8mol;(3)设反应后气体物质的量减少n;
N2(g)+3H2(g)2NH3(g) Δn
n=8mol;所以原混合气体的物质的量是32mol+8mol=40mol,原混合气体与平衡混合气体的总物质的量之比40∶32=5∶4;(4)根据(1)可知a=16,根据(3)可知原混合气体的物质的量是40mol,所以b=40mol-16mol=24mol;a∶b=16∶24=2∶3;(5)根据(5)三段式计算可得达到平衡时,平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=12∶12∶8=3∶3∶2。
22.【答案】(1)2C4H10+13O2―→8CO2+10H2O (2分)
(2)O2+2CO2+4e-===2CO (2分)
(3)CO2 (1分) 负极反应产物 (1分)
(4)①2Cl-+2H2OCl2↑+H2↑+2OH- (2分)
②5Cl2+I2+6H2O===10HCl+2HIO3 (2分)
③560 (2分)
[解析] (1)燃料电池的化学反应方程式即有机物的燃烧方程式。(2)用总化学方程式减去负极电极反应式即得正极电极反应式。(3)因为负极消耗CO而生成CO2,所以要保持稳定,正极需要生成CO,所需CO2可以由负极反应产物提供。(4)电解饱和食盐水即电解电解质和水,据此写出离子方程式;根据氧化还原反应中化合价升降总数相等,可以配平Cl2和I2的反应;根据串联电路中各电极得失电子总数相等,电解后得到NaOH 3.25 mol/L×0.2 L=0.65 mol,即电解池阴极有0.65 mol H+得到了0.65 mol电子,所以燃料电池的负极消耗C4H10的体积为(0.65 mol÷26)×22.4 L/mol=0.56 L=560 mL。