- 2021-08-06 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2016-2017学年高二化学人教版选修3(第1
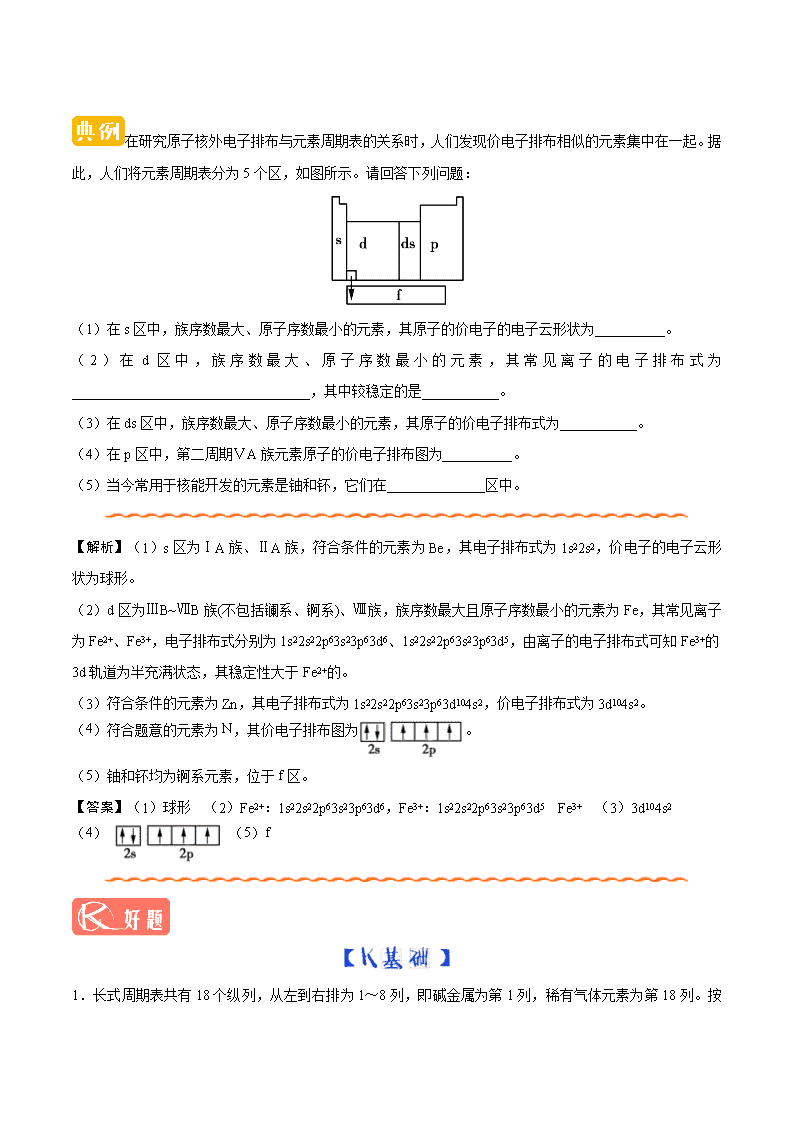
第一章 原子结构与性质 第二节 原子结构与元素的性质 第1课时 原子结构与元素周期表 一、元素周期表的结构 1. 2. 3.元素的分区 (1)按电子排布,把周期表里的元素划分成______个区,分别为______、______、______、______、______。 (2)元素周期表共有______个族,其中s区包括______族,p区包括______族,d区包括______族及______族,ds区包括______族,f区包括______元素和______元素。 二、元素周期系 1.碱金属元素基态原子的核外电子排布 名称 原子序数 周期 基态原子的电子排布式 锂 3 二 1s22s1或[He]2s1 钠 11 三 1s22s22p63s1或______ 钾 19 四 ______或[Ar]4s1 铷 37 五 1s22s22p63s23p63d104s24p65s1或______ 铯 55 六 1s22s22p63s23p63d104s24p64d105s25p66s1或______ 2.元素周期系的形成 (1)周期系的形式 随着元素原子的核电荷数递增,每到出现______,就开始建立一个新的电子层,随后最外层上的电子逐渐增多,最后达到8个电子,出现______;形成一个周期,循环往复形成周期系。 (2)原因 元素的______的周期性变化。 (3)特点 元素周期表的周期不是______的,每一周期的元素数目并不总是相同,而是随周期序号的增多而______,同时金属元素的数目也逐渐______。 【答案】一、1.2 8 长 18 32 2.ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB 8、9、10 ⅦB ⅠB 3.(1)5 s d p ds f (2)16 ⅠA、ⅡA ⅢA~ⅦA、0 ⅢB~ⅦB Ⅷ ⅠB、ⅡB 镧系 锕系 二、1.[Ne]3s1 1s22s22p63s23p64s1 [Kr]5s1 [Xe]6s1 2.(1)碱金属 稀有气体 (2)原子核外电子排布 (3)单调 增多 增多 原子结构与元素周期表的分区 (1)s区元素原子的价电子排布式为ns1~2,价电子数等于主族序数;d区元素原子的价电子排布式为(n−1)d1~9ns1~2(钯除外),价电子总数等于副族序数;ds区元素原子的价电子排布式为(n−1)d10ns1~2,价电子总数等于所在的列序数;p区元素原子的价电子排布式为ns2np1~6,价电子总数等于主族序数,若价电子总数为2或8,则为0族元素。 (2)s区有2个纵列,d区有8个纵列,ds区有2个纵列;从元素原子的价电子排布可以看出,s区、d区、ds区的元素在发生化学反应时容易失去最外层电子及倒数第二层的d电子,呈现金属性,所以s区(H除外)、d区、ds区元素都是金属元素。 在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起。据此,人们将元素周期表分为5个区,如图所示。请回答下列问题: (1)在s区中,族序数最大、原子序数最小的元素,其原子的价电子的电子云形状为__________。 (2)在d区中,族序数最大、原子序数最小的元素,其常见离子的电子排布式为__________________________________,其中较稳定的是___________。 (3)在ds区中,族序数最大、原子序数最小的元素,其原子的价电子排布式为___________。 (4)在p区中,第二周期ⅤA族元素原子的价电子排布图为__________。 (5)当今常用于核能开发的元素是铀和钚,它们在______________区中。 【解析】(1)s区为ⅠA族、ⅡA族,符合条件的元素为Be,其电子排布式为1s22s2,价电子的电子云形状为球形。 (2)d区为ⅢB~ⅦB族(不包括镧系、锕系)、Ⅷ族,族序数最大且原子序数最小的元素为Fe,其常见离子为Fe2+、Fe3+,电子排布式分别为1s22s22p63s23p63d6、1s22s22p63s23p63d5,由离子的电子排布式可知Fe3+的3d轨道为半充满状态,其稳定性大于Fe2+的。 (3)符合条件的元素为Zn,其电子排布式为1s22s22p63s23p63d104s2,价电子排布式为3d104s2。 (4)符合题意的元素为N,其价电子排布图为。 (5)铀和钚均为锕系元素,位于f区。 【答案】(1)球形 (2)Fe2+:1s22s22p63s23p63d6,Fe3+:1s22s22p63s23p63d5 Fe3+ (3)3d104s2 (4) (5)f 1 .长式周期表共有18个纵列,从左到右排为1~8列,即碱金属为第1列,稀有气体元素为第18列。按这种规定,下列说法正确的是 A.第14列元素中未成对电子数是同周期元素中最多的 B.只有第2列的元素原子最外层电子排布为ns2 C.第四周期第8列元素是铁元素 D.第15列元素原子的价电子排布为ns2np5 2.外围电子构型为4f75d16s2的元素在周期表中位置应是 A.第四周期第ⅦB族 B.第五周期第ⅢB族 C.第六周期第ⅦB族 D.第六周期第ⅢB族 3.下列说法中正确的是 A.所有非金属元素都分布在p区 B.最外层电子数为2的元素都分布在s区 C.元素周期表中第ⅢB族到第ⅡB族10个纵行的元素都是金属元素 D.同一主族元素从上到下,非金属性呈周期性变化 4.某元素简化电子排布式为[Xe]4f46s2,其应在 A.s区 B.p区 C.d区 D.f区 5.某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素,关于该元素的判断错误的是 A.电子排布式为1s22s22p63s23p63d34s2 B.该元素为V C.该元素为ⅡA族元素 D.该元素位于d区 6.具有下列电子层结构的原子,其对应元素一定属于同一周期的是 A.两种原子的电子层上全部是s电子 B.3p能级上只有一个空轨道的原子和3p能级上只有一个未成对电子的原子 C.最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子 D.原子核外的M层上的s能级和p能级都充满了电子,而d能级上尚未有电子的两种原子 7.已知元素周期表中共有18纵列,如图实线表示元素周期表的边界。按电子排布,可把周期表里的元素划分为下列几个区:s区、p区、d区、ds区等。除ds区外,其他区的名称来自按构造原理最后填入电子的能级的符号。 (1)请在图中用实线画出s区、p区、d区、ds区的边界线,并分别用阴影和表示d区和ds区。 (2)有的同学受这种划分的启发,认为d区内6、7纵列的部分元素可以排在另一区,你认为应排在___区。 (3)请在元素周期表中用元素符号标出4s轨道半充满的元素。 (4)随着科学技术的发展,不断有新的元素被发现。若把第7周期排满,则元素周期表共可以排布______种元素。 1.C 【解析】A中,第14列是碳族元素,价电子排布为ns2np2,未成对电子数为2,不如第15列(氮族元素)未成对电子数多。B中,周期表中第12列(即第ⅡB族)最外层电子排布也为ns2。D中,第15列元素原子价电子排布为ns2np3。 2.D【解析】最大能层数为6,所以在第六周期。由5d16s2知在第ⅢB族。 3.C【解析】非金属元素中氢在s区,其余非金属元素均分布在p区,A项错误;最外层电子数为2的元素可能在s区(如Mg)、p区(如He)或d区(如Ti、Fe)等,B项错误;同主族元素从上到下,金属性增强,非金属性减弱,属递变性质而不是周期性变化,D项错误, 4.D【解析】元素在周期表中的分区,取决于元素原子的最后一个电子所进入的能级,因最后一个电子进入4f能级,所以该元素为f区元素。 5.C【解析】该元素为同族元素中原子序数最小的,所以该元素为第二周期或第四周期元素。又因其价电子数≠最外层电子数,可推出该元素并不是第二周期元素,应为第四周期元素,价电子排布式为3d34s2,故为23号元素V,位于d区。 6.B【解析】电子层上全都是s电子的原子有氢、氦、锂、铍,A错;3p能级上只有一个空轨道的原子是硅,3p能级上只有一个未成对电子的原子是铝和氯,B对;最外层电子排布为2s22p6的原子是氖,最外层电子排布为2s22p6的离子有氟离子、钠离子、镁离子等,C错;M层上的s能级和p能级都填满电子,而d能级上尚未有电子的原子有氩、钾、钙,D错。 7.(1) (2)ds (3)见上表 (4)118 【解析】依据构造原理最后填入电子的能级的符号,将元素周期表划分为几个区,对于24号元素,其核外价电子排布似乎应该是3d44s2,而实际上是3d54s1,原因是能量相同的轨道处于全空、全充满和半充满时能量最低,而29号元素也正是因为这一点而排成3d104s1,而不是3d94s2,故29号、30号元素所在纵列归为ds区,所以该同学认为d区内6、7纵列的部分元素可以排在ds区是有道理的。 烫发发明史——最是那一卷卷的温柔 据说古埃及人最早尝试烫发,那时妇女们把头发卷在木棒上,再涂上含有大量硼砂的碱性泥,在太阳下晒干后洗掉泥,头发就会出现漂亮的涡卷。古罗马人则利用一个中间插入热棍子的空筒来卷头发……后来,人们开始利用化学技术来做卷发,但是卷发使用的化学药品腐蚀性很强,对皮肤和头发伤害很大,渐渐地就被淘汰了。 19世纪初,一家理发店的德国小伙内斯勒在实践中发现卷成的波浪发型只能保持很短的时间,洗过几次或是梳理几次后波浪卷就消失了,但是往头发上喷洒些碱性溶液,再用烧热的金属筒把头发卷起来,可以让卷度保持更长时间。他开始试验这种烫发方法,但总是失败,差点被老板扫地出门。可是他的妻子凯瑟琳一直支持他,甘愿做他的实验品。某次实验中,竟两次被内斯勒烧焦了头发,头皮也被烧伤了。尽管这样,她仍对丈夫充满了信心。终于,在两个人的努力下,到了1909年,内斯勒发明了烫发机并获得了专利。查看更多