- 2021-08-06 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学58个精讲4钠及其化合物的性质
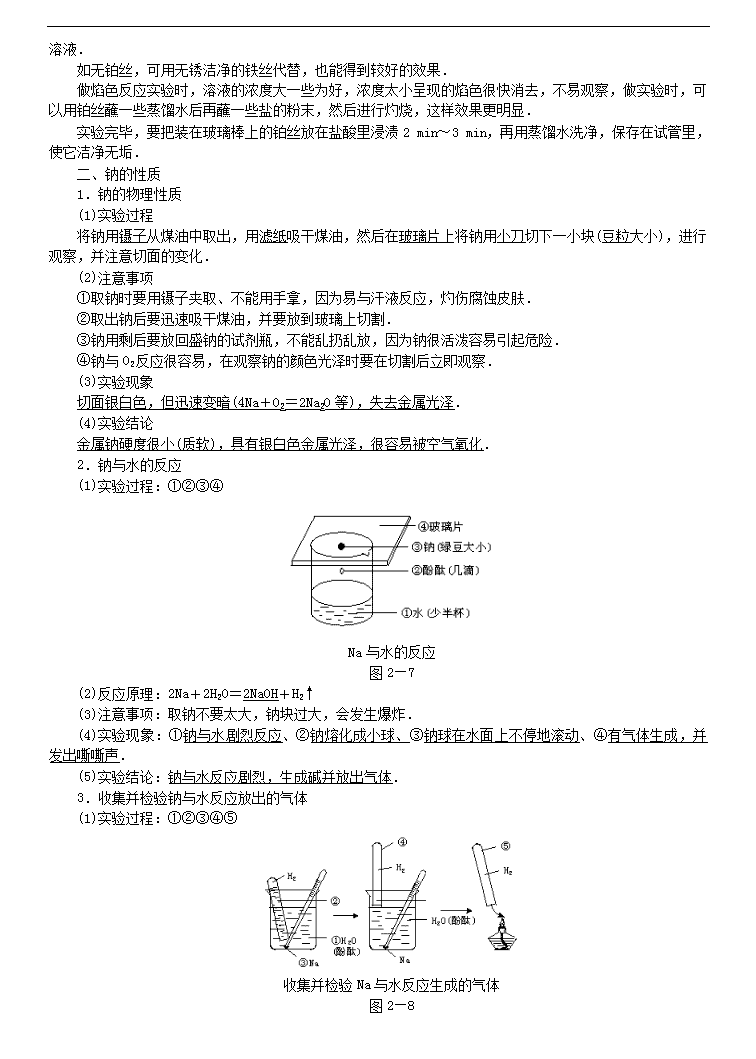
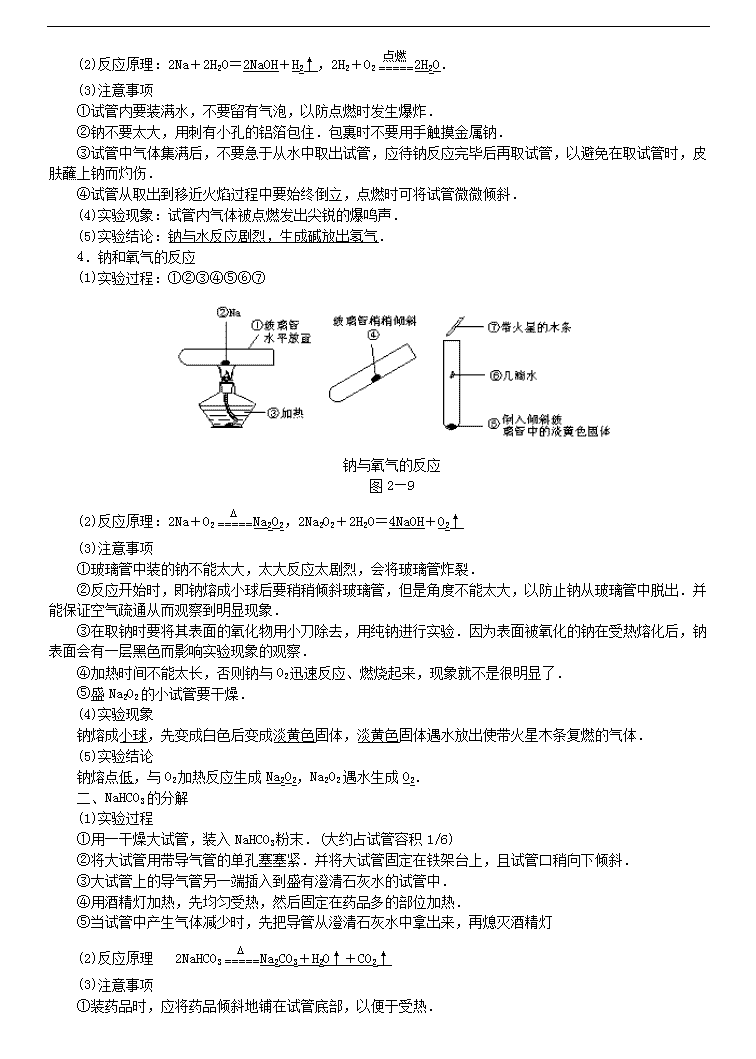
高中化学58个考点精讲 4、 钠及其化合物的性质 1. 复习重点 1.从钠原子结构特征认识钠的化学性质;和的对比,与比较;碱金属元素的原子结构及物理性质比较 2.对实验现象的分析及钠的化学性质;与的鉴别,和之间的除杂问题 2.难点聚焦 一.钠的性质 (1)钠的物理性质及钠跟水的反应 新切开的钠的断面是光亮的银白色,易跟氧起反应,但产物较复杂,如氧化钠(Na2O)、过氧化钠(Na2O2)等. 金属钠跟水反应生成氢气的实验,用拇指堵住试管口倒放入烧杯中,这样的操作对学生来讲,不熟练可能会使一部分空气进入试管.所以在正式做收集气体的实验之前,教师可安排学生练习几次放入试管的操作.如果操作还是有困难,可用一个与试管口大小合适的橡皮塞堵住试管口,放入水中后再拔去橡皮塞.本实验也可以用水槽代替烧杯,这样口径比较大,操作方便. 注意在实验时不能取用较大的钠块.这是因为钠的性质很活泼,它跟水反应时放出大量的热,甚至能使周围的水沸腾,因此钠同时也跟水蒸气反应.如果在水面上游动的钠被容器壁上的油污粘住,不能游动,放出的热不易扩散,会使氢气着火燃烧,甚至还会发生小爆炸,使生成的氢氧化钠飞溅出来. (2)钠与氧气的反应 在做钠与氧气反应的实验时,为了保证倾斜的空气能够流通,玻璃管不能太细,而且装入玻璃管中的钠粒不能太大.待玻璃管中的钠受热溶化并开始燃烧时,稍稍倾斜玻璃管即可看到燃烧后由白色变为黄色的过程.实验时如果没有太粗的玻璃管,也可用去底的试管代替.注意本实验中所用的钠块,应去掉其表面的氧化物,否则燃烧时会使试管壁显黑色,影响对实验现象的观察. 2.碳酸氢钠受热分解 碳酸氢钠粉末在试管中应铺平些,这样受热比较均匀,分解也比较完全,澄清的石灰水变浑浊后,应将盛石灰水的试管移去,因为若通入过多的二氧化碳,会使生成的碳酸钙变成碳酸氢钙而溶解于水中,使浑浊现象消失. 当实验结束时,一定要先移去装有石灰水的烧杯,再熄灭酒精灯,以防止水倒流,使试管炸裂. 3.碳酸钠和碳酸氢钠与酸的反应 本实验也可采用下述方法进行: 取相同式样的100 mL细口瓶两只,各注入25 mL 1.0 moL·L-1 HCl溶液.再取两只气球,一只装入1.0 g无水碳酸钠,另一只装入1.0 g碳酸氢钠,分别套在两只细口瓶的口上. 实验时,掀起两只气球,使里面的固体全部落到细口瓶里的盐酸中,比较反应的剧烈程度,碳酸氢钠的反应剧烈得多,碳酸氢钠放出的气体也比碳酸钠多. 4.焰色反应 这个实验是以不同的碱金属盐类呈现各自的特征焰色为基础的,为了能够便于观察,最好用无色火焰,所以用煤气灯较好,因煤气灯的火焰本身颜色较微弱,干扰较小.一般酒精灯火焰呈杂色,可向学生作适当说明,每做一次实验,都要把铂丝重新用稀盐酸和蒸馏水反复洗净,再在火焰上灼烧至无色,才可继续做实验.做焰色反应实验时,要把蘸有金属化合物溶液的铂丝放在灯焰外焰上灼烧,使形成的火焰较长,焰色反应现象比较明显. 焰色反应实验也可采用下述方法进行: 在铁丝(或玻璃棒)一端捆少量棉花,蘸些酒精,在酒精灯火焰上点燃,向燃着的棉花上滴钠盐或钾盐的溶液. 如无铂丝,可用无锈洁净的铁丝代替,也能得到较好的效果. 做焰色反应实验时,溶液的浓度大一些为好,浓度太小呈现的焰色很快消去,不易观察,做实验时,可以用铂丝蘸一些蒸馏水后再蘸一些盐的粉末,然后进行灼烧,这样效果更明显. 实验完毕,要把装在玻璃棒上的铂丝放在盐酸里浸渍2 min~3 min,再用蒸馏水洗净,保存在试管里,使它洁净无垢. 二、钠的性质 1.钠的物理性质 (1)实验过程 将钠用镊子从煤油中取出,用滤纸吸干煤油,然后在玻璃片上将钠用小刀切下一小块(豆粒大小),进行观察,并注意切面的变化. (2)注意事项 ①取钠时要用镊子夹取、不能用手拿,因为易与汗液反应,灼伤腐蚀皮肤. ②取出钠后要迅速吸干煤油,并要放到玻璃上切割. ③钠用剩后要放回盛钠的试剂瓶,不能乱扔乱放,因为钠很活泼容易引起危险. ④钠与O2反应很容易,在观察钠的颜色光泽时要在切割后立即观察. (3)实验现象 切面银白色,但迅速变暗(4Na+O2=2Na2O等),失去金属光泽. (4)实验结论 金属钠硬度很小(质软),具有银白色金属光泽,很容易被空气氧化. 2.钠与水的反应 (1)实验过程:①②③④ Na与水的反应 图2—7 (2)反应原理:2Na+2H2O=2NaOH+H2↑ (3)注意事项:取钠不要太大,钠块过大,会发生爆炸. (4)实验现象:①钠与水剧烈反应、②钠熔化成小球、③钠球在水面上不停地滚动、④有气体生成,并发出嘶嘶声. (5)实验结论:钠与水反应剧烈,生成碱并放出气体. 3.收集并检验钠与水反应放出的气体 (1)实验过程:①②③④⑤ 收集并检验Na与水反应生成的气体 图2—8 (2)反应原理:2Na+2H2O=2NaOH+H2↑,2H2+O22H2O. (3)注意事项 ①试管内要装满水,不要留有气泡,以防点燃时发生爆炸. ②钠不要太大,用刺有小孔的铝箔包住.包裹时不要用手触摸金属钠. ③试管中气体集满后,不要急于从水中取出试管,应待钠反应完毕后再取试管,以避免在取试管时,皮肤蘸上钠而灼伤. ④试管从取出到移近火焰过程中要始终倒立,点燃时可将试管微微倾斜. (4)实验现象:试管内气体被点燃发出尖锐的爆鸣声. (5)实验结论:钠与水反应剧烈,生成碱放出氢气. 4.钠和氧气的反应 (1)实验过程:①②③④⑤⑥⑦ 钠与氧气的反应 图2—9 (2)反应原理:2Na+O2Na2O2,2Na2O2+2H2O=4NaOH+O2↑ (3)注意事项 ①玻璃管中装的钠不能太大,太大反应太剧烈,会将玻璃管炸裂. ②反应开始时,即钠熔成小球后要稍稍倾斜玻璃管,但是角度不能太大,以防止钠从玻璃管中脱出.并能保证空气疏通从而观察到明显现象. ③在取钠时要将其表面的氧化物用小刀除去,用纯钠进行实验.因为表面被氧化的钠在受热熔化后,钠表面会有一层黑色而影响实验现象的观察. ④加热时间不能太长,否则钠与O2迅速反应、燃烧起来,现象就不是很明显了. ⑤盛Na2O2的小试管要干燥. (4)实验现象 钠熔成小球,先变成白色后变成淡黄色固体,淡黄色固体遇水放出使带火星木条复燃的气体. (5)实验结论 钠熔点低,与O2加热反应生成Na2O2,Na2O2遇水生成O2. 二、NaHCO3的分解 (1)实验过程 ①用一干燥大试管,装入NaHCO3粉末.(大约占试管容积1/6) ②将大试管用带导气管的单孔塞塞紧.并将大试管固定在铁架台上,且试管口稍向下倾斜. ③大试管上的导气管另一端插入到盛有澄清石灰水的试管中. ④用酒精灯加热,先均匀受热,然后固定在药品多的部位加热. ⑤当试管中产生气体减少时,先把导管从澄清石灰水中拿出来,再熄灭酒精灯 (2)反应原理 2NaHCO3Na2CO3+H2O↑+CO2↑ (3)注意事项 ①装药品时,应将药品倾斜地铺在试管底部,以便于受热. ②固定大试管时,应夹在其中上部(离管口1/3处)且要使试管口略向下倾斜.防止反应生成的水冷却回流而将试管炸裂. ③当试管中产生气体减少时,若停止实验,应先将导气管从石灰水中取出来,再撤去酒精灯停止加热,否则,会使石灰水倒吸而引起试管炸裂. (4)实验现象 澄清石灰水变浑浊,大试管内壁有水生成. (5)实验结论 NaHCO3受热易发生分解反应. 三、Na2CO3和NaHCO3与酸的反应 (1)实验步骤 图2—10 (2)反应原理 Na2CO3+2HCl=2NaCl+H2O+CO2↑或CO+2H+=H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑或HCO+H+H2O+CO2↑ (3)注意事项:使用的盐酸浓度不能太大,否则生成的气泡太多太迅速而溢出试管. (4)实验现象和结论 两者都与盐酸反应生成使澄清石灰水变浑浊的气体,但NaHCO3与盐酸反应更剧烈. 三.实验思考 1.若钠、钾等碱金属在空气中失火,可否用水或CO2灭火,为什么?用什么灭火效果好? 答案:钠、钾等碱金属失火不能用水灭火,因为它们与水反应剧烈,且产生易燃气体H2,易导致爆炸发生;也不能用CO2灭火,因为Na、K有还原性,能夺去CO2中的氧继续燃烧. 钠、钾失火可用沙土、抹布扑灭或盖灭. 2.万一被钠灼伤了皮肤,应该怎么办? 答案:万一被钠灼伤了皮肤,应先用稀醋酸洗涤,然后再涂上3%~5%的硼酸溶液.情况严重者速到医院烧伤科救治. 3.用稀盐酸与Na2CO3还是NaHCO3制作的灭火器灭火效果好,有哪些优点? 答案:用稀盐酸与NaHCO3制作的灭火器灭火效果好.优点有二:①产生气体速度快,②产生气体CO2多. 4.实验室中做固体受热生成气体反应的实验注意事项有哪些? 答案:实验室固体受热生成气体的装置都可用制O2装置.注意事项:①试管应夹持在其中上部(或离管口1/3处);②试管口应略向下倾斜,因为实验室中的药品不是很干燥,加热时有水生成,或固体反应时生成水,若不略向下倾斜会使水倒流把试管炸裂;③受热时先均匀加热试管底部,然后固定在药品集中的部位加热. 5.焰色反应操作的注意事项有哪些? 答案:(1)所用火焰本身的颜色要浅,以免干扰观察. (2)蘸取待测物的金属丝本身在火焰上灼烧时应无颜色,同时熔点要高,不易被氧化.用铂丝效果最好,也可用铁丝、镍丝、钨丝等来代替铂丝.但不能用铜丝,因为它在灼烧时有绿色火焰产生. (3)金属丝在使用前要用稀盐酸将其表面的氧化物洗净,然后在火焰上灼烧至无色,以除去能起焰色反应的少量杂质. (4)观察钾的焰色时,要透过蓝色的钴玻璃片,因为钾中常混有钠的化合物杂质,蓝色钴玻璃可以滤去黄色火焰,以看清钾的紫色火焰. 四.知识网络 3. 例题精讲 例1 下列关于钠的说法不正确的是[ ] A、金属钠和氧气反应,条件不同,产物不同 B、钠钾合金通常状况下呈液态,可作原子反应堆的导热剂 C、钠的化学活泼性很强,少量的钠可保存在有机溶剂中 D、由于钠比较活泼,所以它能从溶液中置换出金属活动顺序表中钠后面的金属 解析 ,,A正确;B的说法是正确的,这是钠的重要用途之一;钠的保存原则是将钠与空气和水隔绝,故应保存在密度小于钠的有机溶剂中,,故C不正确;盐溶液中的金属阳离子周围有一定数目的水分子包围着,不能和钠直接接触,另外,钠跟水反应速率很快,故不能从盐溶液中置换出金属。 答案 C、D 例2 将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是[ ] A、 B、 C、 D、 解析 少量钠投入上述四种物质的水溶液中,均有产生,故都满足题目的第一个条件“有气体放出”,而反应后“溶液质量减轻”是指投入的金属钠的质量小于脱离溶液的物质的质量。在A、B、C三个选项中一只有放出,故溶液质量是增加的。D选项中由于与反应生成的NaOH还能继续与反应析出沉淀:,反应后溶液质量减轻。 答案 D 例3 用金属钠制取通常采用下法:,试说明不采用钠在氧气中燃烧而用此法制取的原因: 解析 钠在氧气中燃烧将生成,而题示反应有生成,在氮气流中就不会被进一步氧化成。 答案 钠在氧气中燃烧将得到,利用题给方法制得氧化钠同时生成,作为保护气,防止进一步被氧化为。 例4 将4.6 g钠与1.6g硫粉迅速混合起来,并放在石棉网上加热,反应后生成的固体是[ ] A、黄色固体混合物 B、硫与硫化钠 C、过氧化钠与硫化钠 D、氧化钠与硫化钠 解析 在加热条件下,钠既能与硫化合生成,也能与空气中的氧气反应生成,而钠又是过量的,所以除生成外还有生成。 答案 A、C 例5 A、B、C、D、E五种物质都含有同一元素,它们按下图所示关系相互转化,已知A为单质。 (1)写出A~E的化学式 (2)分别写出有关反应的化学方程式,其中属于氧化还原反应的,请标出电子转移的方向和数目 ①A→B:________ ②A→C:________ ③A→D:________ ④C→D:________ ⑤C→E:________ ⑥D→E:________ 解析 本题属于根据图示转化关系进行物质判断的测试题,该题以第一步转化“A→B”、“A→C”为突破口,即单质与氧气的反应因条件不同(点燃与常温)而产物不同,根据目前所学,很容易想到金属钠,由此推出B为,C为。然后顺其性质往下推,由框图可知A、B、C 3种物质均可转化为D,不难判断D为。最后根据B、C、D在一定条件下都能转化为E,推出E为。 答案 (1) 、、、、 (2)①, ②, ③, ④, ⑤, ⑥(非氧化还原反应)。 例6 2.1g 和组成混合气体与足量的充分反应后,立即通入足量的固体中,固体质量增加[ ] A、2.1g B、3.6 g C、7.2 g D、不可确定 解析 和与燃烧的化学方程式为:,; 、跟的反应分别为: ,。 从4个化学方程式可以看出:增加的质量恰好为和混合气体的质量, 即。 答案 A 例7 根据图示回答,经数小时后,U形管A、B两处的液面会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响) [ ] A、A处上升,B处下降 B、A、B两处都下降 C、A处下降,B处上升 D、A、B两处都不变 解析 小白鼠吸收,呼出,呼出的被溶液吸收,导致内压减小,故A处下降、B处上升。 答案 C 例8 苏打和小苏打有着广泛应用,试从反应物用量角度说明,在下列用途中选(A)苏打,还是(B)小苏打,并说明原因。 (1)做面条时防止面粉较长时间储存变酸味,常加入适量的碱面,选用________,因为________。 (2)作为泡沫灭火器的药品,选用________,因为________。 (3)用于洗涤餐具及实验室的玻璃仪器等,选用________,因为________(提示:二者水溶液均显碱性,且苏打的碱性强)。 (4)治疗胃酸过多时,选用________,因为________。 解析 本题紧扣本节重点,纯碱和小苏打性质联系用途,由课本演示实验可知:,,等量酸耗苏打的质量相对小;产生等量时耗小苏打少;而做洗涤剂和中和胃酸均利用其碱性,前者当然碱性强,洗涤效果好,但碱性太强不利于健康。 答案 (1)A,因为中和等量的,比的用量少(质量比为53∶84)。 (2)B,因为产生等量的时,比的用量少(质量比为84∶106),且产生的速率大。 (3)A,因为碱性强,洗涤效果好。 (4)B,因为适量中和部分胃酸,若用苏打碱性太强,有腐蚀性,不利于人的健康。 例9 某干燥粉末可能由、、、、中的一种或几种组成。将该粉末与足量的盐酸反应,有气体X逸出,X通过足量的溶液后体积缩小(同温、同压下测定)。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量,下列判断正确的是[ ] A、粉末中一定有,, B、粉末中一定不含有和 C、粉末中一定不含有和 D、无法肯定粉末里是否含有和 解析 与盐酸反应产生气体的物质可能有、和,气体X通过足量的溶液后体积缩小(而不是气体全部消失),说明X由和组成,原粉末中、和至少有一种一定存在。将原混合粉末加热,有气体放出,说明混合物中一定有,但受热分解会使混合物粉末质量减少,而实际剩余固体的质量都增加了,原因只能是发生了反应:。综上分析,混合物中有、、,无法确定混合物中是否有和。 答案 A、D 4.实战演练 1.46g金属钠在空气中充分燃烧得到淡黄色粉末,该粉末与足量的水反应放出气体的体积是(标准状况下) ( ) A.44.8L B.11.2L C.22.4L D.5.6L 2.氢化钠(NaH)是一种白色的离子晶体,其中钠是+1价。NaH与水作用放出氢气,下列叙述中正确的是 ( ) A.NaH在水中显酸性 B.NaH中氢离子的电子层排布与氦原子相同 C.NaH中氢离子半径比锂离子半径大 D.NaH中氢离子可被还原成氢气 3.下列物质的溶液既能与H+反应,又能与OH-反应的是 ( ) A.MgSO4 B.Na2CO3 C.NaHCO3 D.(NH4)2SO4 4.将一小块金属钾投入下列物质的溶液中,既能放出气体,又有沉淀析出的是 ( ) A.MgCl2 B.BaCl2 C.CuCl2 D.NaHCO3 5.下列关于碱金属的叙述中,正确的是 ( ) A.碱金属都可以保存在煤油中 B.碱金属与水反应均漂浮在水面上 C.碱金属在空气中加热均可生成多种氧化物 D.碱金属的硬度小、密度小、熔点低 6.下列关于纯碱晶体(Na2CO3·10H2O)的叙述中,错误的是 ( ) A.将晶体放置在空气中质量会减轻 B.加热晶体则生成NaHCO3 C.Na2CO3可作为干燥剂使用 D.晶体溶于水后呈碱性 7.相同质量的Na、Mg、Al分别与过量的盐酸反应,在相同条件下置换出H2的体积比是 ( ) A.36∶69∶92 B.23∶12∶9 C.1∶2∶:3 D.9∶12∶23 8.有关镁的下列叙述中错误的是 ( ) A.能与NH4Cl溶液作用放出氢气 B.与冷水剧烈反应,生成Mg(OH)2沉淀并放出氢气 C.在CO2中能继续燃烧,所以金属镁着火,不能用CO2去灭火 D.在通常情况下其表面有一层致密的氧化膜,所以抗腐蚀能力很强 9.有无色溶液,加入Na2O2时有无色无味气体放出,并有白色沉淀生成,加入Na2O2的量与生成白色沉淀的量如图3-18所示。该无色溶液中含有的物质是 ( ) A.CaCl2和MgCl2 B.Al2(SO4)3 C.Al2(SO4)3和MgSO4 D.Na2SO4和MgSO4 10.相同质量的镁条分别在下列气体中充分燃烧,所得固体物质的质量最大的是 ( ) A.O2 B.N2 C.CO2 D.空气 11.足量的镁粉与一定量的盐酸反应,由于反应速度太快,为了减慢反应速度,但不影响产生氢气的总量,可以加入下列物质中的 ( ) A.CH3COONa B.MgO C.K2CO3 D.NaOH 12.两种固体物质混合后加热分解,残留固体的质量是原混合物质量的一半,这组混合物可能是下列的 ( ) A.Na2CO3和NaHCO3 B.MgCO3和Mg(OH)2 C.Fe(OH)3和Cu(OH)2 D.Cu(NO3)2和CaCO3 13.把含有某一种氯化物杂质的氯化镁粉末95mg溶于水后,与足量的硝酸银溶液反应,生成氯化银沉淀300mg,则该氯化物中的杂质可能是 ( ) A.氯化钠 B.氯化铝 C.氯化钾 D.氯化钙 14.将4.34g Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672mL混合气体。该混合气体通过电火花引燃,恰好完全反应,则混合物中Na、Na2O和Na2O2的物质的量之比为 ( ) A.1∶1∶1 B.1∶1∶2 C.1∶2∶2 D.4∶3∶2 15.取镁铝合金粉末若干,用足量的盐酸溶解后,再向溶液中加入过量的NaOH溶液,将生成的沉淀过滤、洗涤、灼烧,得到的白色粉末与原合金粉末质量相等,则原合金中镁的质量分数是 ( ) A.30% B.40% C.50% D.60% 二、非选择题 16.现有X、Y、Z、W等4种钠的化合物,它们之间的相互关系如下: X W+CO2↑+H2O,Z+CO2→W+O2↑,Z+H2O→Y+O2↑,W+Ca(OH)2→CaCO3↓+Y。 则X、Y、Z、W的化学式依次为____、____、____、____。 17.用金属钠制取Na2O通常采用下法:2NaNO2+6Na 4Na2O+N2↑。试说明为什不采用钠在氧气中燃烧而采用此法制取Na2O的原因___________________。 18.有一块合金中含有金、铁、铝、铜、镁,取其样品加过量稀硝酸,反应后溶液中存在的阳离子有_________,在溶液中加入过量的NaOH溶液,溶液中减少的离子有_______________,增多的离子有______________。 19.有一硫化钠、亚硫酸钠和硫酸钠的混合物,经测定含硫25.6%,则混合物中含氧量为________________。 20.A、B、C是三种溶于水的白色固体,它们的水溶液都呈碱性,焰色反应都显紫色(透过蓝色的钻玻璃观察)。①A和B的水溶液反应时生成C。②固态B受热时产物之一为D。③C的水溶液和D反应生成B。④A的水溶液和D反应时,如果条件不同,可分别生成B或C。由此可推断出A、B、C的化学式依次是A______、B______、C______。 21.把一定量的Na2CO3、NaHCO3、Na2SO4混合物加到200mL 1.00mol/L的HCl中完全反应后生成2016mL干燥的CO2(标准状况),然后加入400mL 0.10 mol/L的Ba(OH)2溶液,使SO42-完全沉淀,再加40 mL 1.00 mol/L的HCI恰好中和过量的碱。最后把沉淀分离出来,干燥称量为1.48g,求混合物中各组分的质量分数。 22.将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5 mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图3-19所示。由图中数据计算 (1)原合金中镁和铝的质量。 (2)盐酸的物质的量浓度。 答 案 一、选择题 1.B 2.B、C 3.C 4.A、C 5.D 6.B、C 7.A 8.B 9.C 10.C 11.A 12.B、D 13.B 14.D 15.D 二、非选择题 16.NaHCO3、NaOH、Na2O2、Na2CO3。 17.钠在氧气中燃烧得到的是Na2O2。用此法,Na在N2的环境中反应,可避免生成Na2O2。 18.H+、Fe3+、Al3+、Cu2+、Mg2+ H+、Fe3+、Al3+、Cu2+、Mg2+ OH-、AlO2- 19.37.6% 20.A:KOH B:KHCO3或KHSO3 C:K2CO3或K2SO3 21.w(Na2CO3)74.2% w(NaHCO3)=16.8% w(Na2SO4)=9% 22.(1)合金中镁的质量是4.8g,铝的质量是2.7g (2)盐酸的物质的量浓度是8mol/L查看更多