- 2021-08-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021新高考化学鲁科版一轮复习突破精练:第7章 第23讲 化学平衡移动原理及应用
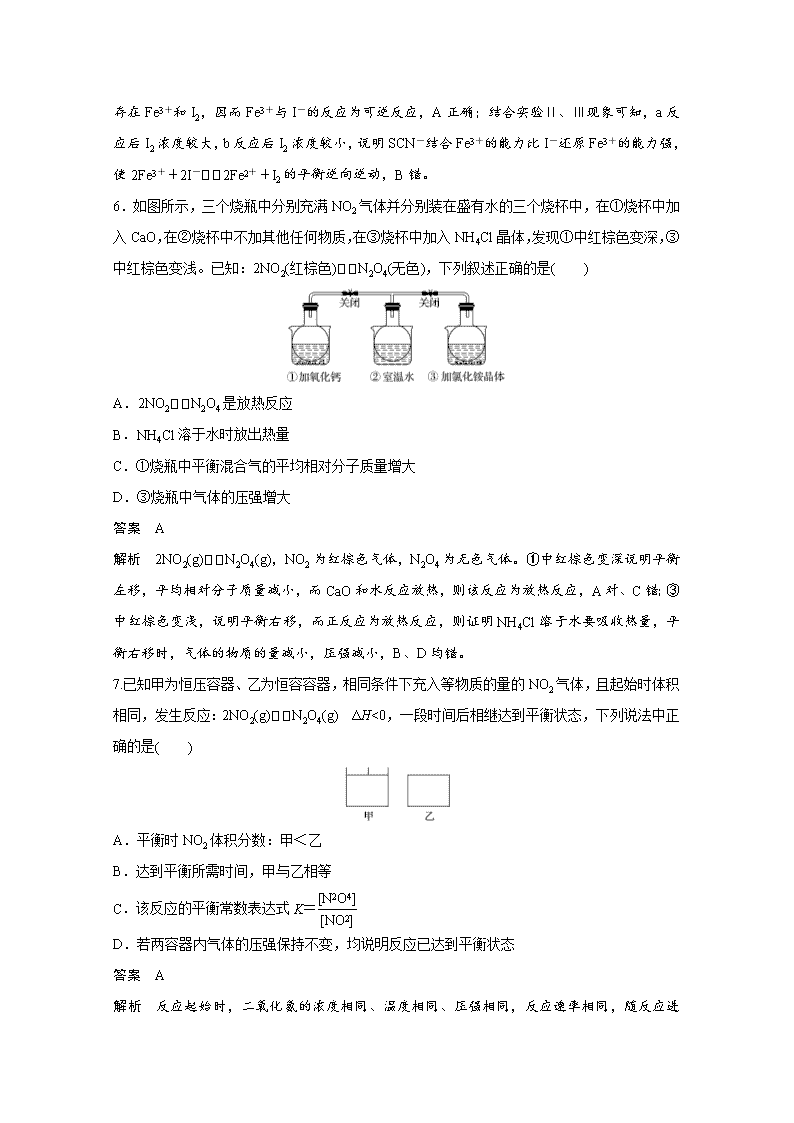
www.ks5u.com 一、选择题:每小题只有一个选项符合题意。 1.下列事实不能用化学平衡移动原理解释的是( ) A.在强碱存在的条件下,酯的水解反应进行较完全 B.加催化剂,使N2和H2在一定条件下转化为NH3 C.可用浓氨水和NaOH固体快速制取氨气 D.加压条件下有利于SO2与O2反应生成SO3 答案 B 解析 应注意区别化学平衡移动原理和化学反应速率理论的应用范围,加催化剂只能提高反应速率,故B项不能用化学平衡移动原理解释。 2.已知反应CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( ) A.升高温度,K增大 B.减小压强,n(CO2)增加 C.更换高效催化剂,α(CO)增大 D.充入一定量的氮气,n(H2)不变 答案 D 解析 A项,ΔH<0,正反应放热,升高温度平衡向逆反应方向移动,平衡常数减小,错误;B项,比较方程式气体的计量数关系,反应前气体的化学计量数之和等于反应后气体的计量数之和,则减小压强,平衡不移动,n(CO2)不变,错误;C项,催化剂能改变反应速率,但不会引起化学平衡的移动,所以α(CO)不变,错误;D项,充入一定量的氮气,平衡向气体体积增大的方向移动,但该反应前后气体体积不变,平衡不移动,n(H2)不变,正确。 3.纳米钴(Co)常用于CO加氢反应的催化剂:CO(g)+3H2(g)CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( ) A.纳米技术的应用,优化了催化剂的性能,提高了反应的转化率 B.缩小容器体积,平衡向正反应方向移动,CO的浓度增大 C.温度越低,越有利于CO催化加氢 D.从平衡体系中分离出H2O(g)能加快正反应速率 答案 B 解析 催化剂不能改变反应的转化率,A项错误;压强增大,平衡正向移动,但移动的结果不能抵消条件的改变,CO的浓度还是增大的,B项正确;工业生产的温度应考虑催化剂的活性温度,C项错误;从平衡体系中分离出水蒸气,反应速率减慢,D项错误。 4.将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是( ) A.2v(NH3)=v(CO2) B.密闭容器中c(NH3)∶c(CO2)=2∶1 C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变 答案 C 解析 该反应为有固体参与的非等体积反应,且容器体积不变,所以压强、密度均可作化学反应是否达到平衡状态的标志,该题应特别注意D项,因为该反应为固体的分解反应,所以NH3、CO2的体积分数始终为定值,NH3占,CO2占。 5.探究浓度对化学平衡的影响,实验如下: Ⅰ.向5 mL 0.05 mol·L-1 FeCl3溶液中加入5 mL 0.05 mol·L-1KI溶液(反应a),反应达到平衡后将溶液分为两等份。 Ⅱ.向其中一份中加入饱和KSCN溶液,变红(反应b);加入CCl4,振荡、静置,下层显极浅的紫色。 Ⅲ.向另一份中加入CCl4,振荡、静置,下层显紫红色。 结合实验,下列说法不正确的是( ) A.反应a为2Fe3++2I-2Fe2++I2 B.实验Ⅱ中,反应a进行的程度大于反应b进行的程度 C.实验Ⅱ中变红的原理是Fe3++3SCN-Fe(SCN)3 D.比较水溶液中c(Fe2+):实验Ⅱ<实验Ⅲ 答案 B 解析 由药品用量看,Fe3+与I-能恰好反应,再依据实验Ⅱ、Ⅲ 现象,可知,反应混合物中存在Fe3+和I2,因而Fe3+与I-的反应为可逆反应,A正确;结合实验Ⅱ、Ⅲ现象可知,a反应后I2浓度较大,b反应后I2浓度较小,说明SCN-结合Fe3+的能力比I-还原Fe3+的能力强,使2Fe3++2I-2Fe2++I2的平衡逆向逆动,B错。 6.如图所示,三个烧瓶中分别充满NO2气体并分别装在盛有水的三个烧杯中,在①烧杯中加入CaO,在②烧杯中不加其他任何物质,在③烧杯中加入NH4Cl晶体,发现①中红棕色变深,③中红棕色变浅。已知:2NO2(红棕色)N2O4(无色),下列叙述正确的是( ) A.2NO2N2O4是放热反应 B.NH4Cl溶于水时放出热量 C.①烧瓶中平衡混合气的平均相对分子质量增大 D.③烧瓶中气体的压强增大 答案 A 解析 2NO2(g)N2O4(g),NO2为红棕色气体,N2O4为无色气体。①中红棕色变深说明平衡左移,平均相对分子质量减小,而CaO和水反应放热,则该反应为放热反应,A对、C错;③中红棕色变浅,说明平衡右移,而正反应为放热反应,则证明NH4Cl溶于水要吸收热量,平衡右移时,气体的物质的量减小,压强减小,B、D均错。 7.已知甲为恒压容器、乙为恒容容器,相同条件下充入等物质的量的NO2气体,且起始时体积相同,发生反应:2NO2(g)N2O4(g) ΔH<0,一段时间后相继达到平衡状态,下列说法中正确的是( ) A.平衡时NO2体积分数:甲<乙 B.达到平衡所需时间,甲与乙相等 C.该反应的平衡常数表达式K= D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态 答案 A 解析 反应起始时,二氧化氮的浓度相同、温度相同、压强相同,反应速率相同,随反应进 行,容器乙中压强降低。容器甲体积可变,压强不变,故反应达平衡时,两容器内的压强关系是p(甲)>p(乙),甲中平衡正向进行,平衡时NO2体积分数减小,故A正确;容器乙体积不变,随反应进行,反应混合气体的物质的量减小,容器乙中压强降低,而容器甲体积可变、压强不变,由压强越大反应速率越快,可知达到平衡所需时间甲短,故B错误;反应为2NO2(g)N2O4(g),平衡常数K=,故C错误;甲容器中压强始终不变,而乙中压强不变可判断平衡状态,故D错误。 二、选择题:每小题有一个或两个选项符合题意。 8.在密闭容器中进行反应:A(g)+3B(g)2C(g),下列有关图像的说法不正确的是( ) A.依据图a可判断正反应为放热反应 B.在图b中,虚线可表示使用了催化剂时的变化情况 C.若ΔH<0,图c可表示升高温度使平衡向逆反应方向移动 D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应吸热 答案 D 解析 根据图a曲线可知,温度越高,逆反应速率与正反应速率差值越大,故升高温度平衡逆向移动,正反应为放热反应,A项正确;催化剂能加快反应速率,缩短达到平衡所用的时间,但不能使平衡发生移动,B项正确;升高温度,平衡向吸热方向移动,C项正确;根据图像曲线可知,温度越高,混合气体的平均相对分子质量越小,故升高温度平衡逆向移动,因此可判断正反应为放热反应,D项错误。 9.(2019·山东烟台期末)I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)I(aq) ΔH。某I2、KI混合溶液中,I-的物质的量浓度c(I-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是( ) A.该反应ΔH<0 B.若在T1、T2温度下,反应的平衡常数分别为K1、K2,则K1<K2 C.若反应进行到状态D时,一定有v正>v逆 D.状态A与状态B相比,状态A的c(I)大 答案 BC 解析 温度升高,c(I-)逐渐增大,说明升高温度,化学平衡逆向移动。I2(aq)+I-(aq)I(aq)的ΔH<0,A项正确;K=,温度升高,平衡向逆反应方向移动,由于T2>T1,则K1>K2,B项错误;从图中可以看出D点并没有达到平衡状态,c(I-)小于该温度下的平衡浓度,所以反应逆向进行,故v逆>v正,C项错误;升高温度,平衡逆向移动,[I]变小,T2>T1,所以状态A的[I]大,D项正确。 10.CO2经催化加氢可合成乙烯:2CO2(g)+6H2(g)C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,测得不同温度下平衡时体系中各物质浓度的关系如图,下列叙述不正确的是( ) A.该反应的ΔH<0 B.曲线b代表H2O的浓度变化 C.N点和M点所处的状态c(H2)不一样 D.其他条件不变,T1 ℃、0.2 MPa下反应达平衡时[H2]比M点小 答案 CD 解析 温度升高,H2的浓度增大,平衡左移,故逆向吸热,正向放热,ΔH<0,则曲线a为CO2的浓度变化,根据方程式的比例关系,可知曲线b为H2O的浓度变化,曲线c为C2H4的浓度变化,故A、B正确;N点和M点均处于同一T1 ℃下,所处的状态的c(H2)是一样的,C 项错误;其他条件不变,T1 ℃、0.2 MPa相对0.1 MPa,增大了压强,体积减小,[H2]增大,反应达平衡时[H2]比M点大,D项错误。 11.(2020·西安调研)已知反应:CO(g)+3H2(g)CH4(g)+H2O(g)。起始以物质的量之比为1∶1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为▲)。下列有关说法正确的是( ) A.上述反应的ΔH<0 B.N点时的反应速率一定比M点的快 C.降低温度,H2的转化率可达到100% D.工业上用此法制取甲烷应采用更高的压强 答案 A 解析 根据图像,随着温度的升高,H2的转化率降低,说明平衡向逆反应方向移动,根据勒·夏特列原理,正反应为放热反应,ΔH<0,A项正确;此反应是可逆反应,不能完全进行到底,C项错误;控制合适的温度和压强,既能保证反应速率较快,也能保证H2有较高的转化率,采用更高的压强对设备的要求更高,增加经济成本,D项错误。 三、非选择题 12.用尿素[CO(NH2)2]吸收氮氧化物是一种可行的方法。 (1)尿素在高温条件下与NO2反应转化成无毒气体,该反应的化学方程式为_____________; 用尿素溶液也可吸收氮氧化物,研究表明,氮氧化物气体中NO的体积分数越大,总氮被还原率越低,可能的原因是__________________________________________________________。 (2)在一个体积固定的真空密闭容器中充入等物质的量的CO2和NH3,在恒定温度下使其发生反应2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)并达到平衡,混合气体中氨气的体积分数随时间的变化如图所示: 则A点的v正(CO2)________(填“>”“<”或“=”)B点的v逆(H2O),原因是_________ ____________________________________________________________________________。 答案 (1)4CO(NH2)2+6NO27N2+4CO2+8H2O NO不溶于水,难以与尿素接触反应 (2)> 由图像知,A点反应在起始到平衡的反应过程之中,此过程中v正逐渐减小,B点反应已达平衡状态,故A点的v正(CO2)>B点的v正(CO2)=B点的v逆(CO2)=v逆(H2O) 13.CO2和H2充入一定体积的密闭容器中,反应过程和在两种温度下CH3OH的物质的量随时间的变化如图1所示。 (1)已知图1所示反应每消耗1 mol H2,热量变化是16.3 kJ,则反应的热化学方程式为________________________________________________________________________。 曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“>”“=”或“<”)。 (2)一定温度下,若此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是________(填字母)。 a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH) d.容器中密度不变 e.2个C==O断裂的同时有3个H—H断裂 (3)一定比例的合成气在装有催化剂的反应器中反应12小时,体系中甲醇的产率和催化剂的催化活性与温度的关系如图2所示。 当温度为470 K时,图中P点________(填“是”或“不是”)处于平衡状态。490 K之后,甲醇产率下降的原因是____________________________________________________________。 答案 (1)CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-48.9 kJ·mol-1 > (2)bd (3)不是 反应为放热反应,升高温度,平衡逆向移动,且催化剂活性降低 解析 (1)由题意知每消耗1 mol H2,热量变化是16.3 kJ,又由图1中CH3OH的物质的量随时间的变化图像可知该反应的正反应为放热反应,则该反应的热化学方程式为CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-48.9 kJ·mol-1;该反应的正反应为放热反应,温度越高该反应的平衡常数越小,所以对应的平衡常数大小关系为KⅠ>KⅡ。 (2)一定温度下发生反应CO2(g)+3H2(g)===CH3OH(g)+H2O(g)。因为此反应是在恒压容器中进行,容器中压强始终不变,所以压强不变不能判断反应达到化学平衡状态,a项错误;因为压强恒定,且化学方程式两边计量数之和是不等的,所以H2的体积分数不变能说明反应达到化学平衡状态,b项正确;c(H2)=3c(CH3OH)不能说明正、逆反应速率相等,所以不能判断化学反应是否达到平衡状态,c项错误;容器中密度ρ=,反应物和生成物都是气体,因为反应是在恒压容器中进行且反应后气体体积减小,所以密度不变可以说明反应达到化学平衡状态,d项正确;CO2和H2都是反应物,只要2个C==O断裂的同时就有3个H—H断裂,不能说明正反应速率和逆反应速率相等,e项错误。 (3)在490 K之前,甲醇产率随着温度升高而增大的原因是:反应尚未达到平衡,温度越高化学反应速率越快;490 K之后,甲醇产率下降的原因是:反应达到平衡后升高温度,平衡逆向移动,且催化剂活性降低。 14.(2020·焦作检测)汽车尾气中CO、NO2在一定条件下可以发生反应:4CO(g)+2NO2(g)4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1。在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。 (1)0~10 min内该反应的平均速率v(CO)=________,从11 min起其他条件不变,压缩容器的容积变为1 L,则n(NO2)的变化曲线可能为图中的________(填字母)。 (2)恒温恒容条件下,不能说明该反应已达到平衡状态的是________(填字母)。 A.容器内混合气体颜色不再变化 B.容器内的压强保持不变 C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变 (3)对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像表示正确的是_______(填序号)。 答案 (1)0.03 mol·L-1·min-1 d (2)CD (3)乙 解析 (1)0~10 min内v(CO)=2v(NO2)=×2=0.03 mol·L-1·min-1。从11 min起压缩容器容积,压强增大,平衡正向移动,n(NO2)应逐渐减小直至达到新的平衡。(2)混合气体颜色不再变化,说明各物质的浓度不变,可以说明达到平衡,A不符合题意;反应前后气体分子总数不相等,因此压强保持不变,可以说明达到平衡,B不符合题意;v逆(NO2)=2v正(N2)才能说明达到平衡,C符合题意;反应体系中物质全部为气体,密度始终保持不变,不能说明达到平衡,D符合题意。(3)甲,温度升高,v正、v逆应该均出现突增,错误;乙,温度升高,平衡逆向移动,NO2的转化率降低,正确;丙,温度不变时,增大压强,平衡正向移动,平衡时CO的体积分数应该减小,错误。查看更多