山东省泰安市新泰市第二中学2019-2020高一化学诊断性检测(二)试卷(Word版附答案)
化学
本试卷分选择题和非选择题两部分,共100分。考试时间90分钟。
可能用到的相对原子质量:H -1 C -12 O -16 N -14 S -32 Al -27 Cl -35.5
注意事项:
1、考生务必将自己的姓名、班级、准考证号填写在试卷上。
2、所有题用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定答题区相应位置上。不按要求作答的答案无效。
第 I 卷 (选择题 共50分)
一、选择题(本题包括20小题,1-15单选每小题2分,16-20,不定项选择,每小题4分,选不全得2分,选错0分,共50分。 )
1.美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子核内的中子数和核外电子数之差为( )
A.57 B.47 C.61 D.293
2.下列反应中,属于取代反应的是 ( )
A. 乙烯在空气中燃烧 B. 乙烷在空气中燃烧
C. 乙烯使氯水褪色 D. 乙烷与氯气在光照下颜色变浅
3.下列物质中,只含有离子键,不含有共价键的是 ( )
A.HCl B.KOH C.CaCl2 D.NH4 NO3
4.有关化学用语正确的是( )
A.乙烯的结构简式CH2CH2 B.乙醇的结构简式C2H6O
C.四氯化碳的电子式 D.乙酸的分子式C2H4O2
5.下列微粒中: 其核外电子数相同的是( )
A.①②③ B.②③④ C.①②④ D.①③④
6.下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被活性炭吸附
C.酒精溶于水 D.HCl气体溶于水
7.X2+和Y-与氩的电子层结构相同,下列判断中不正确的是:( )
A.原子半径 X>Y B.原子序数 X>Y
C.最外层电子数 X>Y D.电子层数 X>Y
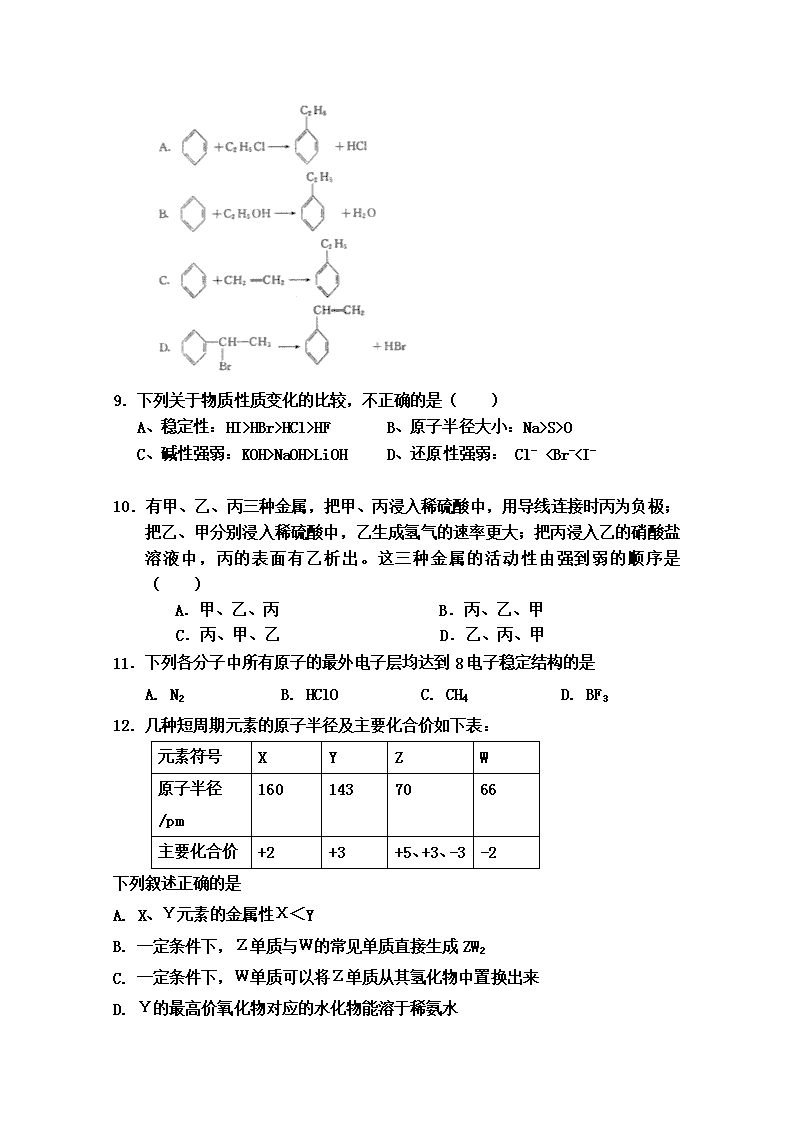
8.绿色化学对于化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料中的原子全部转变成所需产物。不产生副产物,实现零排放。下列几种生产乙苯的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
9.下列关于物质性质变化的比较,不正确的是( )
A、稳定性:HI>HBr>HCl>HF B、原子半径大小:Na>S>O
C、碱性强弱:KOH>NaOH>LiOH D、还原性强弱: Cl-
H2YO4>H3ZO4,则下列判断中正确的是 ( )
A.单质的氧化性按X、Y、Z的顺序增强
B.阴离子的还原性按X、Y、Z的顺序减弱
C.气态氢化物的稳定性按X、Y、Z的顺序增强
D.元素非金属性按X、Y、Z的顺序减弱
18.对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述中正确的是
( )
A.达到化学平衡时4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达平衡状态
C.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
D.平衡时混合物中可能各物质的浓度相等,且保持不变。
19.拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )
A.属于芳香烃 B.能发生水解反应
C.能发生取代反应 D.任何条件下都不能发生加成反应
20.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均减小
D.产生气泡的速度甲比乙快
第II卷(非选择题 共50分)
21.(20分)(一)已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436kJ、151k J、299k J。则由氢气和碘反应生成1 mol HI需要 _________(填“放出”或“吸收”) _____________k J的热量。
(二)现有如下两个反应:
(A) Cu2++Zn=Cu+Zn2+ (B)2FeCl3+Cu=2FeCl2+CuCl2。
(1)分别画出两个实验装置图,注明电解质溶液名称和正负极材料,标出电子流动方向。
(2)写出下列电极反应式:
①(A)中___ _是负极,负极反应式:_____
_____________;
②(B)中___ ___是负极,负极反应式:___________
_______。
22.(8分)下表是元素周期表的一部分,回答下列问题:
(1)写出③、⑤两种元素形成的化合物有两种,电子式分别是:____ , __________。
(2)写出①元素形成最简单有机物是____ ,它和氯气反应的一个方程式____ ______________________________。
(3)这些元素的最高价氧化物的对应水化物中________酸性最强;________碱性最强;能形成两性氢氧化物的元素是________。
23.(10分)乙烯的产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:
(1)可以用来鉴别甲烷和乙烯的试剂是 。
A. 水 B. 稀硫酸
C. 溴水 D. 酸性高锰酸钾溶液
(2)在一定条件下,乙烯能与水反应生成有机物A,则A的结构简式是 。
(3)某同学在学习A的知识后,设计了如下实验。操作步骤为:
①在试管里加入2 mL A;
②把一端弯成螺旋状的铜丝放在酒精灯外焰中加热;
③立即将铜丝插入盛有A的试管里,反复操作几次;
④闻生成物的气味,观察铜丝表面的变化。
第④步操作中,铜丝表面的变化是 ;写出第③
步操作中发生反应的化学方程式: 。
(4)A在一定条件下可以被氧化成乙酸,用化学方程式说明乙酸和碳酸的酸性强弱:
。
24.(12分)现将0.1mol某烃完全燃烧生成的气体全部依次通过浓硫酸和氢氧化钠溶液,经测定,前者增重10.8g ,后者增重22g(假定气体全部吸收)。试通过计算推断该烃的分子式(要有简单计算过程)并写出所有同分异构体。若该烃的一氯代物只有一种,试写出该氯代烃的结构简式。
化学参考答案
题号
1
2
3
4
5
6
7
8
9
10
选项
A
D
C
D
C
D
C
C
A
B
题号
11
12
13
14
15
16
17
18
19
20
选项
A
C
D
A
A
C
D
AD
BC
D
21.(20分)放出 5.5k J
22.(8分)
23.(10分)
(1)C D (2分) (2)CH3CH2OH (2分)
(3)由黑色变成红色 (2分)CH3CH2OH +CuOCH3CHO+Cu+H2O (2分)
(4)CH3COOH+NaHCO3=CH3COONa+H2O+CO2↑(2分)
24.(12分)
解0.1mol的该烃完全燃烧生成的:n(H2O)=10.8g/18g·mol�1=0.6mol
n(CO2)=22g/44g·mol�1=0.5mol