陕西省宁陕中学2020届高三化学下学期仿真试题(Word版附答案)
宁陕中学 2020 届高三全仿真考试 化学试卷
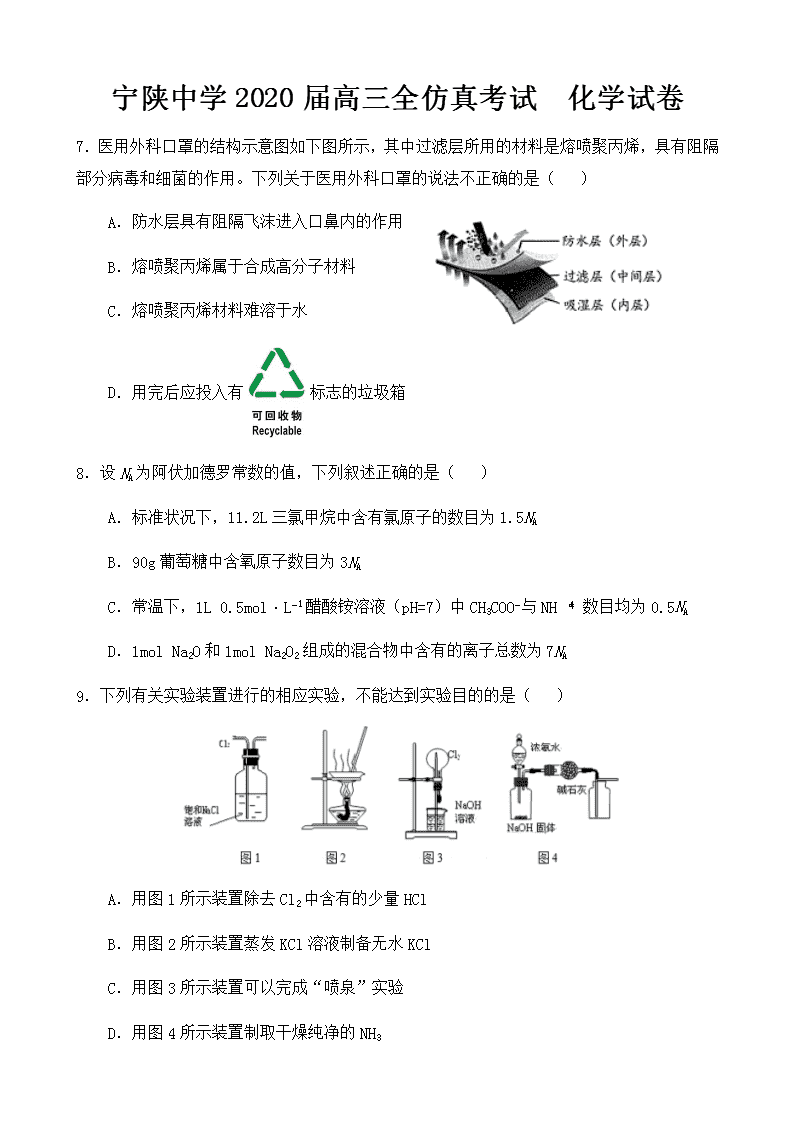
7.医用外科口罩的结构示意图如下图所示,其中过滤层所用的材料是熔喷聚丙烯,具有阻隔
部分病毒和细菌的作用。下列关于医用外科口罩的说法不正确...的是( )
A.防水层具有阻隔飞沫进入口鼻内的作用
B.熔喷聚丙烯属于合成高分子材料
C.熔喷聚丙烯材料难溶于水
D.用完后应投入有 标志的垃圾箱
8.设 NA 为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,11.2L 三氯甲烷中含有氯原子的数目为 1.5NA
B.90g 葡萄糖中含氧原子数目为 3NA
C.常温下,1L 0.5mol·L−1 醋酸铵溶液(pH=7)中 CH3COO−与 NH +
4数目均为 0.5NA
D.1mol Na2O 和 1mol Na2O2 组成的混合物中含有的离子总数为 7NA
9.下列有关实验装置进行的相应实验,不能..达到实验目的的是( )
A.用图 1 所示装置除去 Cl2 中含有的少量 HCl
B.用图 2 所示装置蒸发 KCl 溶液制备无水 KCl
C.用图 3 所示装置可以完成“喷泉”实验
D.用图 4 所示装置制取干燥纯净的 NH3
10.我国中草药文化源远流长,通过临床试验,从某中草药中提取的有机物具有较好的治疗
癌症的作用,该有机物的结构如图所示。下列说法中错误..的是( )
A.分子式为 C13H12O6
B.该有机物能发生取代反应、加成反应、氧化反应
C.1mol 该有机物与 NaOH 反应最多消耗 2mol NaOH
D.1mol 该有机物与溴水反应最多消耗 3mol Br2
11.前四周期元素 A、B、C、D、E 原子序数依次增大。已知:A、C 同主族,A 的原子最外层
电子数是次外层的 3 倍,B 的氧化物既能溶于强酸,又能溶于强碱,D 的原子半径是第 3 周期
中最小的,E 是形成骨骼和牙齿的主要元素,且 E 单质能和水反应。则下列分析错误..的是( )
A.A 和 B 形成的化合物可作为耐火材料
B.A 和 C 的氢化物的沸点:C>A
C.简单离子半径:E
Q
D.M 点所示溶液中 c(Na+)=c(R−)
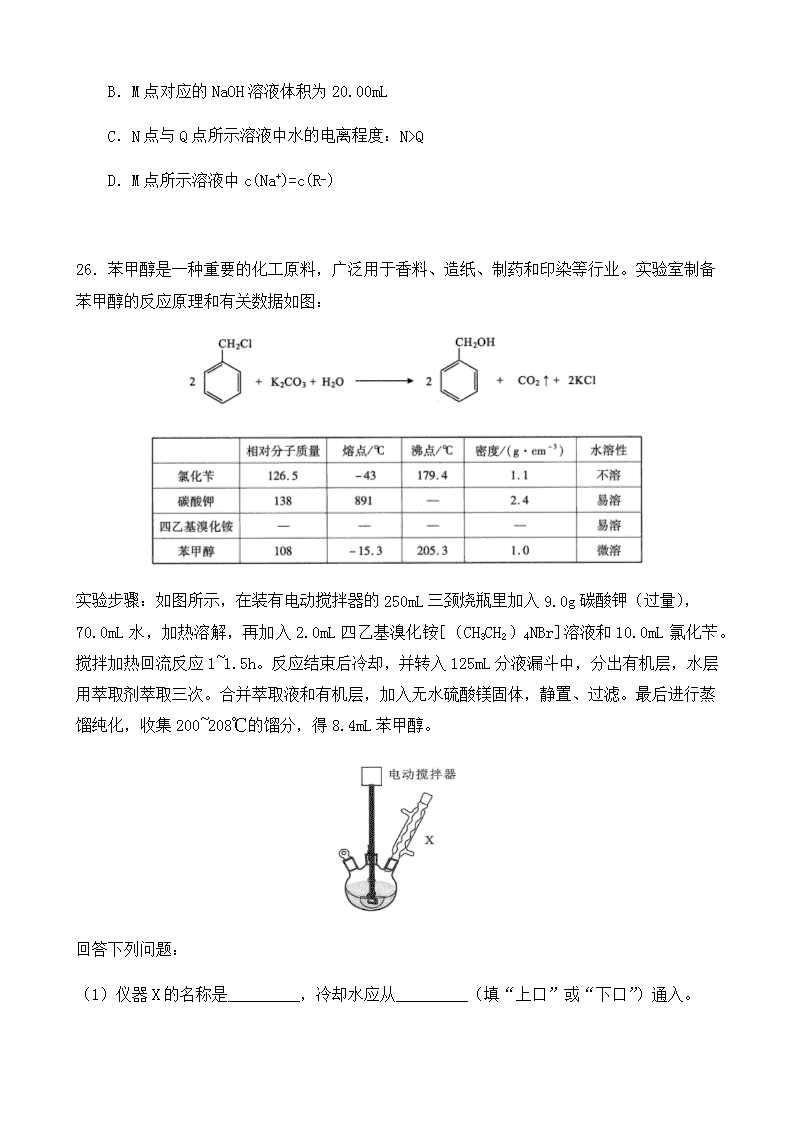
26.苯甲醇是一种重要的化工原料,广泛用于香料、造纸、制药和印染等行业。实验室制备
苯甲醇的反应原理和有关数据如图:
实验步骤:如图所示,在装有电动搅拌器的 250mL 三颈烧瓶里加入 9.0g 碳酸钾(过量),70.0mL
水,加热溶解,再加入 2.0mL 四乙基溴化铵[(CH3CH2)4NBr]溶液和 10.0mL 氯化苄。搅拌加
热回流反应 1~1.5h。反应结束后冷却,并转入 125mL 分液漏斗中,分出有机层,水层用萃取
剂萃取三次。合并萃取液和有机层,加入无水硫酸镁固体,静置、过滤。最后进行蒸馏纯化,
收集 200~208℃的馏分,得 8.4mL 苯甲醇。
回答下列问题:
(1)仪器 X 的名称是_________,冷却水应从_________(填“上口”或“下口”)通入。
(2)本实验中加入无水硫酸镁的目的是_________。从绿色化学角度考虑,萃取剂宜采用___
(填字母)。
A.乙醇 B.乙酸乙酯 C.苯 D.氯仿
(3)某同学认为该装置中的电动搅拌器可以换成沸石,以防暴沸。该说法______(填“是”
或“否”)正确,其理由是_______________。
(4)四乙基溴化铵没有直接参与反应,但大大提高了反应速率,其原因可能是____________。
(5)本实验苯甲醇的产率为______%(计算结果保留一位小数)。
27.高纯 MnCO3 在电子工业中有重要的应用,工业上利用软锰矿(主要成分是 MnO2,还含有 Fe2O3、
CaCO3、CuO 等杂质)制取碳酸锰的流程如图所示:
已知:还原焙烧主反应为 2MnO2+C
焙烧
2MnO+CO2↑。
可能用到的数据如下:
根据要求回答下列问题:
(1)在实验室进行步骤 A,混合物应放在__________中加热。
(2)步骤 E 中调节 pH 的范围为____________,其目的是______________________________。
(3)步骤 G,温度控制在 35℃以下的原因是____________________________________,若 Mn2+
恰好沉淀完全(当离子浓度≦10-5mol/L 认为该离子沉淀完全)时测得溶液中 CO3
2-的浓度为 2.2
×10-6mol/L,则 Ksp(MnCO3)=____________。
(4)步骤 D 中氧化剂与还原剂的物质的量之比为__________;步骤 C 中的滤渣为__________。
(5)生成的 MnCO3 沉淀需经充分洗涤,检验洗涤是否干净的方法是_____________________。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取 3.300 g 试样,向其中加入稍过量
的磷酸和硝酸,加热使产品中 MnCO3 完全转化为[Mn(PO4)2]3-(其中 NO3
-完全转化为 NO2
-);加入
稍过量的硫酸铵,发生反应 NO2
-+NH4
+=N2↑+2H2O 以除去 NO2
-;加入稀硫酸酸化,再加入 60.00
mL 0.500 mol·L-1 硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO4
3-;
用 5.00 mL 0.500 mol·L-1 酸性 K2Cr2O7 溶液恰好除去过量的 Fe2+。
①酸性 K2Cr2O7 溶液与 Fe2+反应的离子方程式为_____________________________________。
②试样中锰元素的质量分数为____________。
28.二甲醚(CH3OCH3)重整制取 H2,具有无毒、无刺激性等优点。回答下列问题:
(1) CH3OCH3 和 O2 发生反应 I:CH3OCH3(g)+1/2O2(g)=2CO(g)+3H2(g) △H
已知:CH3OCH3(g) CO(g)+H2(g)+CH4 (g) △H1
CH4 (g)+3/2O2(g)=CO(g)+2H2O (g) △H2
H2(g)+1/2O2(g)=H2O (g) △H3
①则反应 I 的△H=____________________(用含△H1、△H2、△H3 的代数式表示)。
②保持温度和压强不变,分别按不同进料比通入 CH3OCH3 和 O2,
发生反应 I。测得平衡时 H2 的体积百分含量与进料气中
n(O2)/n(CH3OCH3)的关系如图所示。当 n(O2)/n(CH3OCH3)>0.6 时,
H2 的体积百分含量快速降低,其主要原因是____(填标号)。
A.过量的 O2 起稀释作用
B.过量的 O2 与 H2 发生副反应生成 H2O
C .n(O2)/n(CH3OCH3)>0.6 平衡向逆反应方向移动
(2)T℃时,在恒容密闭容器中通入 CH3OCH3,发生反应 II:CH3OCH3(g) CO(g)+H2(g)+CH4(g),
测得容器内初始压强为 41.6 kPa,反应过程中反应速率 v(CH3OCH3)时间 t 与 CH3OCH3 分压
P(CH3OCH3)的关系如图所示。
①t=400 s 时,CH3OCH3 的转化率为________(保留 2 位有效数字);反应速率满足
v(CH3OCH3)=kPn(CH3OCH3),k=_________s-1;400 s 时 v(CH3OCH3)=_________kPa.s-1。
②达到平衡时,测得体系的总压强 P 总= 121.6 kPa,则该反应的平衡常数
Kp=________________ kPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③该温度下,要缩短达到平衡所需的时间,除改进催化剂外,还可采取的措施是________。
35.[化学——选修 3:物质结构与性质](15 分)
据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为
材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
(1)锌和镉位于同副族,而锌与铜相邻。现有 4 种铜、锌元素的相应状态,①锌:[Ar]3d10
4s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去 1 个电子需要的能量由大
到小排序是______(填字母)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
(2)硫和碲位于同主族,H2S 的分解温度高于 H2Te,其主要原因是______________________。
在硫的化合物中,H2S、CS2 都是三原子分子,但它们的键角(立体构型)差别很大,用价层电
子对互斥理论解释:__________________;用杂化轨道理论解释:____________________。
(3)Cd2+与 NH3 等配体形成配离子。[Cd(NH3)4]2+中 2 个 NH3 被 2 个 Cl替代只得到 1 种结构,
它的立体构型是___________。1 mol [Cd(NH3)4]2+含___________mol σ键。
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3 的熔点由高到低的排序为____________。
(5)锆晶胞如图 1 所示,1 个晶胞含______个 Zr 原子;这种堆积方式称为_______________。
(6)镉晶胞如图 2 所示。已知:NA 是阿伏加德罗常
数的值,晶体密度为 d g·cm3。在该晶胞中两个镉原
子最近核间距为______nm(用含 NA、d 的代数式表示),
镉晶胞中原子空间利用率为________(用含π的代数
式表示)。
36.[化学——选修 5:有机化学基础](15 分)
两种重要的有机化工合成中间体 F 和 Y 可用甲苯为主要原料采用以下路线制得。
已知:
请回答下列问题:
(1)写出 A 的结构简式___________________。
(2)B→C 的化学方程式是______________________________________。
(3)C→D 的反应类型为___________________。
(4)1 mol F 最多可以和_____________mol NaOH 反应。
(5)在合成 F 的过程中,设计 B→C 步骤的目的是__________________________________
______。
(6)写出符合下列条件的一种 A 的同分异构体的结构简式____________________。
①苯环上只有两种不同化学环境的氢原子
②能发生银镜反应
(7)以 X 和乙醇为原料通过 3 步可合成 Y,请设计合成路线(无机试剂及溶剂任选)。
答案
题号 7 8 9 10 11 12 13
答案 D B D C B D B
26.【答案】(1)球形冷凝管 下口
(2)干燥 B
(3)否 电动搅拌器使不相溶的反应液混合均匀,加快反应速率
(4)提高氯化苄在水中的溶解度,使反应物充分接触(或增大有效碰撞几率)
(5)89.4
【解析】
(1)仪器 X 的名称是球形冷凝管,冷却水采用逆流的方式冷却效果较好,所以冷却水应从下
口通入;由于苯甲醇的沸点较高,易液化,在蒸馏纯化操作中最适宜选用 B 仪器,有利于液
体顺利流下;
(2)加入无水硫酸镁,利用其易水形成结晶水合物,达到干燥的目的;乙醇有刺激性,苯有
毒,氯仿有麻醉作用,而乙酸乙酯有特殊香味,无毒,则从绿色化学角度考虑,萃取剂宜采
用乙酸乙酯,故答案为 B;
(3)不能用沸石代替电动搅拌器,因为使用电动搅拌器,除防暴沸,还可使不相溶的反应液
混合均匀,加快反应速率;
(4)四乙基溴化铵易溶于水,而氯化苄不溶于水,易溶于四乙基溴化铵,则加入四乙基溴化
铵,可提高氯化苄在水中的溶解度,使反应物充分接触,提高反应效率;
(5)10.0mL 氯化苄的质量为 11g,其物质的量为 11
126.5g / mol
g = 11
126.5
mol,理论生成苯甲醇的质量
为 11
126.5 mol×108g/mol=9.39g,则苯甲醇的产率为 8.4mL 1g / mL 100%9.39g
=89.4%。
27.【答案】(1)坩埚 C、 Cu 和 CaSO4 (2) 1∶2
(3)3.7≤pH<8.1 使 Fe3+转化为 Fe(OH)3 而除去,而不影响 Mn2+
(4)减少碳酸氢铵的分解,提高原料利用率 2.2×10-11
(2)取少量最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的 BaCl2 溶液,若无白色沉
淀产生,则表明已洗涤干净
(3)6Fe2++Cr2O7
2-+14H+=6Fe3++2Cr3++7H2O 25%
【解析】
(1)高温焙烧物质应在坩埚中进行;根据分析可知滤渣为 C、Cu 和 CaSO4;
(2)步骤 D 中 MnO2 被还原成 Mn2+,化合价降低 2 价,Fe2+被氧化成 Fe3+,化合价升高 1 价,根据
得失电子守恒,氧化剂与还原剂的物质的量之比为 1:2;
(3)此时溶液中的杂质主要为 Fe3+,结合表中数据可知步骤 E 中调节 pH 的范围为 3.7≤pH<8.3,
其目的是使铁离子转化为氢氧化铁而除去,而不影响 Mn2+;
(4)铵盐不稳定,受热易分解,所以步骤 G 中温度需控制在 35℃以下,减少碳酸氢铵的分解,
提高原料利用率;Mn2+恰好沉淀完全时可认为 c(Mn2+)=10-5mol/L,Ksp(MnCO3)=
c(Mn2+)·c(CO3
2-)=10-5×2.2×10-6=2.2×10-11;
(5)生成的 MnCO3 沉淀可能附着有硫酸盐,所以检验是否含有硫酸根即可确认沉淀是否洗涤干
净,具体操作为:取少量最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的 BaCl2 溶液,
若无白色沉淀产生,则表明已洗涤干净;
(6)①酸性 K2Cr2O7 具有强氧化性,可以把亚铁离子氧化成铁离子,自身被还原成 Cr3+,根据电
子守恒、电荷守恒和原子守恒可得离子方程式为 6Fe2++Cr2O7
2-+14H+=6Fe3++2Cr3++7H2O;
②根据方程式 6Fe2++Cr2O7
2-+14H+=6Fe3++2Cr3++7H2O 可知剩余 n(Fe2+)= 0.500 mol·L-1×
0.005L×6=0.015mol,则与[Mn(PO4)2]3-反应的 n(Fe2+)=0.500 mol·L-1×
0.06L-0.015mol=0.015mol,根据方程式[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO4
3-可知
n(Mn)=0.015mol,所以锰元素的质量分数为 0.015mol 55g/mol 100%3.300g
=25%。
28.【答案】△H1+△H2-2△H3 B 16% 4.4×10-4 1.65×10-2 4×104 增大反
应物的压强 提高反应物的压强,化学反应速率加快
【解析】 (1) ①已知:i.CH3OCH3(g) CO(g)+H2(g)+CH4 (g) △H1
ii.CH4 (g)+3/2O2(g)=CO(g)+2H2O (g) △H2
iiiH2(g)+1/2O2(g)=H2O (g) △H3
根据盖斯定律 i+ii-iii×2 得:CH3OCH3(g)+1/2O2(g)=2CO(g)+3H2(g) △H=△H1+△H2-2△H3,
故答案为:△H1+△H2-2△H3;
②反应 I:CH3OCH3(g)+1/2O2(g) 2CO(g)+3H2(g),由信息可知,过量的 O2 与 H2 发生副反应
生成 H2O,使 H2 的体积百分含量快速降低,A、C 选项不能说明 H2 的体积百分含量快速降低,
故选 B;
故答案为:B;
(2)①设起始时 CH3OCH3 的物质的量为 n,则
CH3OCH3(g) CO(g)+H2(g)+CH4(g),
起始量(mol) n 0 0 0
转化量(mol) nα n α n α nα
400 s 时(mol)n- n α n α nα n α 总物质的量:n+2nα
根据等温等容条件下,压强之比等于物质的量之比,有 = ,解得α=0.16=16%;
由图象可知,当 P(CH3OCH3)=10.0kPa 时,v(CH3OCH3)=4.4×10-3kPa·s-1,
根据 v(CH3OCH3)=kPn(CH3OCH3),n=1,则 k= s-1=4.4 10-4 s-1;
由图象可知,400 s 时 P(CH3OCH3)=35.0kPa,则 v(CH3OCH3)= =1.65×10-2kPa.s-1。
故答案为:16%;4.4 10-4;1.65 10-2;
②达到平衡时,测得体系的总压强 P 总= 121.6 kPa,设平衡转化率为α1,则
CH3OCH3(g) CO(g)+H2(g)+CH4(g),
起始量(mol) n 0 0 0
转化量(mol) nα1 nα1 nα1 nα1
平衡量(mol)n-nα1 nα1 nα1 nα1 总物质的量:n+2nα1
根据等温等容条件下,压强之比等于物质的量之比,有 = ,解得α1=0.96,
则平衡时 CH3OCH3(g)、CO(g)、H2(g)、CH4(g)分压分别为 1.67 kPa、39.98 kPa、39.98 kPa、
39.98 kPa,则该反应的平衡常数 Kp= 4 104kPa2
③除使用催化剂外,提高反应物的压强,能加快化学反应速率;
故答案为:4 104;增大反应物的压强;提高反应物的压强,化学反应速率加快。
35.[化学——选修 3:物质结构与性质](15 分)
(1)A(2 分)
(2)S 原子半径小于 Te,H—S 键的键能较大(1 分) H2S 分子中 S 原子价层有 2 个孤电
子对,孤电子对对成键电子对排斥力大于成键电子对之间排斥力,所以键角较小(1 分);
CS2 分子中 C 原子价层没有孤电子对,成键电子对之间排斥力相同且较小(1 分)
H2S 中 S 采用 sp3 杂化,CS2 中 C 采用 sp 杂化(1 分)
(3)正四面体(1 分) 16(1 分)
(4)AsBr3>AsCl3>AsF3(1 分)
(5)6(1 分) 六方最密堆积(1 分)
(6) 73
A
3 224 102 d N
(2 分) 3 π8
(2 分)
【解析】(1)锌原子的第一电离能大于铜原子第一电离能,有①>③;铜的第二电离能大
于锌的第二电离能,有④>②。锌的第二电离能大于第一电离能,②>①。故选 A。
(2)从原子半径、键能角度分析气态氢化物的热稳定性。原子半径:r(S)<r(Te),键能:
H-S>H-Te,所以 H2S 较稳定。H2S 分子中 S 原子价层有 2 个孤电子对,孤电子对对成键
电子对排斥力大于成键电子对之间排斥力,所以键角较小;CS2 分子中 C 原子价层没有孤
电子对,成键电子对之间排斥力相同,呈直线形最稳定,键角较大。从杂化轨道角度解
释,H2S 中 S 采用 sp3 杂化,CS2 中 C 采用 sp 杂化。
(3)[Cd(NH3)4]2+中 2 个 NH3 被 2 个 Cl替代只得到 1 种结构,说明 Cd2+采用 sp3 杂化,呈正
四面体结构。配位键也是σ键。1 mol [Cd(NH3)4]2+含 16 mol σ键。
(4)它们都是分子晶体,相对分子质量越大,范德华力越大,熔点越高。故熔点排序为 A
sBr3>AsCl3>AsF3。
(5)在六棱柱中,12 个原子位于顶点、2 个原子位于面心,3 个原子位于体内。1 个六棱
柱含 6 个原子。这种堆积方式叫六方最密堆积。
(6)图 2 为体心立方堆积,3 个镉原子位于体对角线且相切,1 个晶胞含 2 个镉原子。设
晶胞参数为 a,d= 3
A
2 112
a N
,a= 73
A
224 10d N
nm。设两镉原子最近核间距为 x,(2x)2=3a2,
x= 73
A
3 224 102 d N
nm。设镉原子半径为 r,则 r= 3
4 a nm,φ=
3
3
42 π3 r
a
= 3 π8
。
36.[化学——选修 5:有机化学基础](15 分)
(1) (2 分)
(2) +(CH3CO)2O +CH3COOH(2 分)
(3)氧化反应(2 分)
(4)3(2 分)
(5)氨基易被氧化,在氧化反应之前需先保护氨基(或其它合理答案也给分)(2 分)
(6) 、 、 (3 分)
(7) (2 分)
【解析】(1)从流程分析得出 A 为 。
(2)乙酸酐与氨基反应形成肽键和乙酸。
(3)苯环上的甲基被氧化为羧基,为氧化反应。
(4)F 分子中含有羧基、氨基和溴原子,其中羧基消耗 1 mol 氢氧化钠,溴原子水解得到
酚羟基和 HBr 各消耗 1 mol 氢氧化钠,共消耗 3 mol。
(5)在流程中先把氨基反应后又生成,显然是在保护氨基。
(6)由①得出苯环中取代基位置对称,由②得出含有醛基或甲酸酯基,还有 1 个氮原子
和 1 个氧原子,故为 、 、 。
(7)根据已知条件②需要把乙醇氧化为乙醛,然后与 X 反应再加热可得出产物。