- 2021-08-06 发布 |
- 37.5 KB |
- 19页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
全国1卷2020届高三化学高考模拟冲刺训练二(解析版)
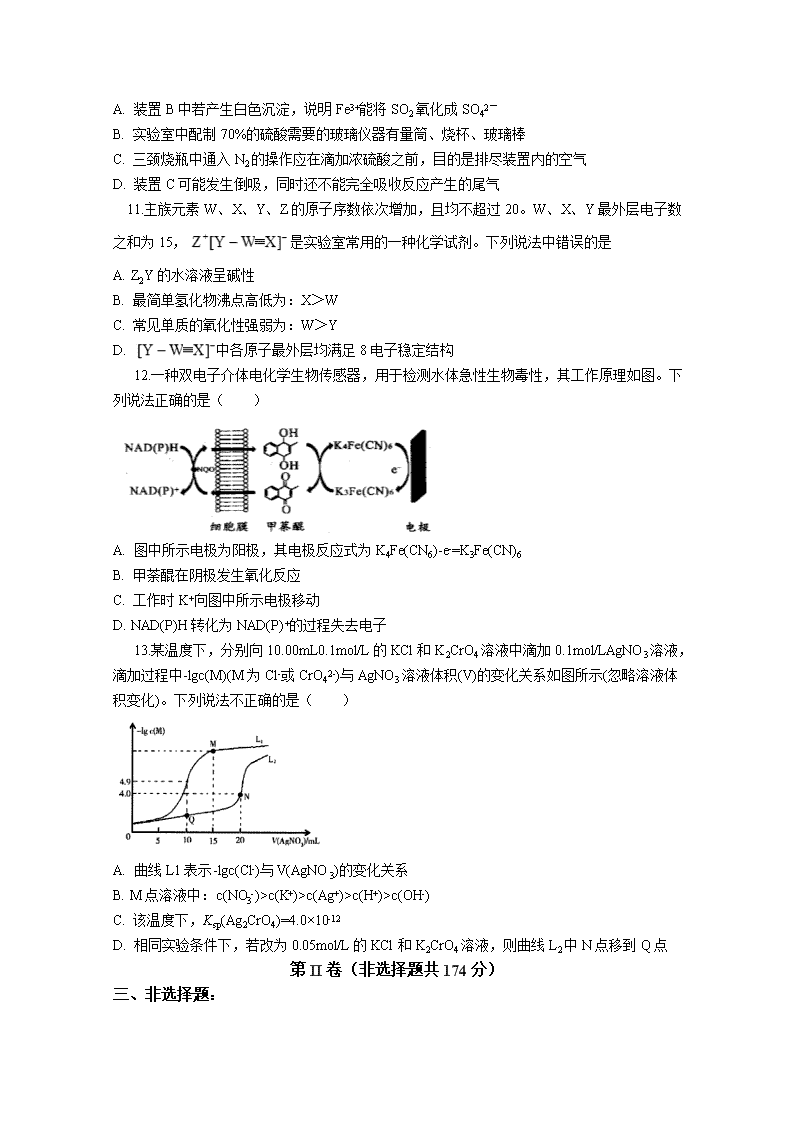
2020 年高三年级化学冲刺训练二 可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Cl-35.5 Ni-59 Zn-65 Ba-137 第Ⅰ卷 一、选择题:(本题共 7 小题,只有一项符合题目要求,每小题 6 分,共 42 分。) 7.化学与生产和生活密切相关。下列有关说法正确的是 A. 古代记载文字的器物“甲骨”与 “丝帛”成分相同 B. 苏打可用于制作发酵粉,在医疗上也可以用作治疗胃酸过多 C. 我国自主研发的“龙芯 4000 系列”CPU 芯片与光导纤维是同种材料 D. 用于制作 N95 型口罩的“熔喷布”主要原料是聚丙烯,聚丙烯的分子长链上有支链 8.多巴胺是一种神经传导物质,会传递兴奋及开心的信息。其部分合成路线如下,下列说法 正确的是 A. 甲在苯环上的溴代产物有 2 种 B. lmol 乙与 H2 发生加成,最多消耗 3molH2 C. 多巴胺分子中所有碳原子可能处在同一平面 D. 甲、乙、多巴胺 3 种物质均属于芳香烃 9.NA 表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用千冶金染料、皮革等工业。 硫化钠的一种制备方法是 Na2SO4+2C Na2S+2CO2↑。下列有关说法正确的是 A. 12 g 石墨晶体中含有碳碳键的数目为 3 NA B. 1 L 0.1 mol•L-1 Na2S 溶液中含阴离子的数目小于 0.l NA C. 生成 1mol 氧化产物时转移电子数为 4 NA D. 常温常压下,11.2LCO2 中含质子的数目为 11 NA 10.某研究小组利用下图装置探究 SO2 和 Fe(NO3)3 溶液的反应原理。下列说法错误的是 A. 装置 B 中若产生白色沉淀,说明 Fe3+能将 SO2 氧化成 SO42- B. 实验室中配制 70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒 C. 三颈烧瓶中通入 N2 的操作应在滴加浓硫酸之前,目的是排尽装置内的空气 D. 装置 C 可能发生倒吸,同时还不能完全吸收反应产生的尾气 11.主族元素 W、X、Y、Z 的原子序数依次增加,且均不超过 20。W、X、Y 最外层电子数 之和为 15, 是实验室常用的一种化学试剂。下列说法中错误的是 A. Z2Y 的水溶液呈碱性 B. 最简单氢化物沸点高低为:X>W C. 常见单质的氧化性强弱为:W>Y D. 中各原子最外层均满足 8 电子稳定结构 12.一种双电子介体电化学生物传感器,用于检测水体急性生物毒性,其工作原理如图。下 列说法正确的是( ) A. 图中所示电极为阳极,其电极反应式为 K4Fe(CN6)-e-=K3Fe(CN)6 B. 甲荼醌在阴极发生氧化反应 C. 工作时 K+向图中所示电极移动 D. NAD(P)H 转化为 NAD(P)+的过程失去电子 13.某温度下,分别向 10.00mL0.1mol/L 的 KCl 和 K2CrO4 溶液中滴加 0.1mol/LAgNO3 溶液, 滴加过程中-lgc(M)(M 为 Cl-或 CrO42-)与 AgNO3 溶液体积(V)的变化关系如图所示(忽略溶液体 积变化)。下列说法不正确的是( ) A. 曲线 L1 表示-lgc(Cl-)与 V(AgNO3)的变化关系 B. M 点溶液中:c(NO3-)>c(K+)>c(Ag+)>c(H+)>c(OH-) C. 该温度下,Ksp(Ag2CrO4)=4.0×10-12 D. 相同实验条件下,若改为 0.05mol/L 的 KCl 和 K2CrO4 溶液,则曲线 L2 中 N 点移到 Q 点 第 II 卷(非选择题共 174 分) 三、非选择题: 26.次硫酸氢钠甲醛(aNaHSO2•bHCHO•cH2O)在印染、医药以及原子能工业中应用广泛。以 Na2SO3、SO2、HCHO 和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下: 步骤 1:在如图所示装置的烧瓶中加入一定量 Na2SO3 和水,搅拌溶解,缓慢通入 SO2,至溶 液 pH 约为 4,制得 NaHSO3 溶液。 步骤 2:将装置 A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在 80~90℃下,反应约 3h,冷却至室温,抽滤。 步骤 3:将滤液真空蒸发浓缩,冷却结晶。 (1)装置 B 的烧杯中应加入的溶液是___。 (2)步骤 2 中加入锌粉时有 NaHSO2 和 Zn(OH)2 生成。 ①写出加入锌粉时发生反应的化学方程式:___。 ②生成的 Zn(OH)2 会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是___。 (3)冷凝管中回流的主要物质除 H2O 外,还有___(填化学式)。 (4)步骤 3 中次硫酸氢钠甲醛不在敞口容器中蒸发浓缩的原因是___。 (5)步骤 2 抽滤所得滤渣的成分为 Zn 和 Zn(OH)2,利用滤渣制备 ZnO 的实验步骤为:将滤 渣置于烧杯中,___,900℃煅烧。(已知:Zn 与铝类似,能与 NaOH 溶液反应;Zn2+开始沉淀 的 pH 为 5.9,沉淀完全的 pH 为 8.9,pH>11 时,Zn(OH)2 能生成 ZnO22-。实验中须使用的试 剂有 1.0mol•L-1NaOH 溶液、1.0mol•L-1HCl 溶液、水) (6)产物组成测定实验: 准确称取 1.5400g 样品,溶于水配成 l00mL 溶液;取 25.00mL 样品溶液经 AHMT 分光光度法 测得溶液吸光度 A=0.4000(如图);另取 25.00mL 样品溶液,加入过量碘水后,加入 BaCl2 溶 液至沉淀完全,过滤、洗涤、干燥至恒重得到 BaSO4 固体 0.5825g。 ①样品溶液 HCHO 浓度为___mol•L-1。 ②通过计算确定 aNaHSO2·bHCHO•cH2O 的化学式为___。 27.以含锂电解铝废渣(主要成分为 LiF、AlF3、NaF,少量 CaO 等)为原料,生产高纯度 LiOH 的工艺流程如图:(已知:常温下,LiOH 可溶于水,Li2CO3 微溶于水) (1)含锂电解铝废渣与浓硫酸在 200~400℃条件下反应 2h。“滤渣 1”主要成分是___(填化学 式)。 (2)“过滤 2”需要趁热在恒温装置中进行,否则会导致 Li2SO4的收率下降,原因是___。 (已知部分物质的溶解度数据见下表) 温度/℃ Li2SO4/g Al2(SO4)3/g Na2SO4/g 0 36.1 31.2 4.9 10 35.4 33.5 9.1 20 34.8 36.5 19.5 30 34.3 40.4 40.8 40 33.9 45.7 48.8 (3)40°C 下进行“碱解”,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝的离子方程式 为___;若碱解前滤液中 c(Li+)=4mol•L-1,加入等体积的 Na2CO3 溶液后,Li+的沉降率到 99%, 则“滤液 2”中 c(CO32-)=___mol•L-1。[Ksp(Li2CO3)=1.6×10-3] (4)“苛化”过程,若氧化钙过量,则可能会造成___。 (5)整个工艺流程中可以循环利用的物质有___。 (6)“电解”原理如图所示。“碳化”后的电解液应从(填“a”或“b”)___口注入。阴极的电极反应 式为___。 (7)高纯度 LiOH 可转化为电池级 Li2CO3。将电池级 Li2CO3 和 C、FePO4 高温下反应,生成 LiFePO4 和一种可燃性气体,该反应的化学方程式为___。 28.乙烯、环氧乙院是重要的化工原料,用途广泛。回答下列问题: 已知:I.2CH2=CH2(g)+O2(g) 2 (g) △H1=-206.6 kJ•mo1-1 II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1) △H2 III.2 (g)+5O2(g)=4CO2(g)+4H2O(1) △H3 (1)反应 III:△S(填“>”“<”或“=”)___0。 (2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已 知乙烯的热值为 50.4kJ•g-1,则△H3=___kJ•mol-1 (3)实验测得 2CH2=CH2(g)+O2(g) 2 (g)中,v 逆=k 逆 c2( ),v 正=k 正 •c2(CH2=CH2)•c(O2)(k 正、k 逆为速率常数,只与温度有关)。 ①反应达到平衡后,仅降低温度,下列说法正确的是( ) A.k 正、k 逆均增大,且 k 正增大的倍数更多 B.k 正、k 逆匀减小,且 k 正减小的倍数更少 C.k 正增大、k 逆减小,平衡正向移动 D.k 正、k 逆均减小,且 k 逆减小的倍数更少 ②若在 1L 的密闭容器中充入 1molCH2=CH2(g)和 1 molO2(g),在一定温度下只发生反应 I,经 过 10 min 反应达到平衡,体系的压强变为原来的 0.875 倍,则 0~10 min 内 v(O2)=___, =___。 (4)现代制备乙烯常用乙烷氧化裂解法: C2H6(g)+ 1 2 O2(g)=C2H4(g)+H2O(g) △H2=-110 kJ•mol-1,反应中还存在 CH4、CO、CO2 等副 产物(副反应均为放热反应),图 1 为温度对乙烷氧化裂解反应性能的影响。 ①乙烷的转化率随温度的升高而升高的原因是___;反应的最佳温度为___(填序号)。 A.650 ℃ B.700 ℃ C.850 ℃ D.900 ℃ [乙烯选择性= ;乙烯收率=乙烷转化率×乙烯选择性] ②工业上,保持体系总压恒定为 l00 kPa 的条件下进行该反应,通常在乙烷和氧气的混合气体 中掺混惰性气体(惰性气体的体积分数为 70%),掺混惰性气体的目的是___。 35.2019 年 10 月 1 曰,在庆祝中华人民共和国成立 70 周年的阅兵仪式上,最后亮相的 DF-31A 洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了 Fe、Cr、 Ni、C 等多种元素。回答下列问题: (1)基态 Cr 原子的价电子排布式为___。 (2)实验室常用 KSCN 溶液、苯酚( )检验 Fe3+。 ①第一电离能:N___O(填“>”或“<”)。 ②1 mol 苯酚中含有的σ数目为___。 ③苯酚中的氧原子和碳原子均采用相同的杂化方式,其类型为___。 ④从结构的角度分析苯酚的酚羟基有弱酸性的原因为___。 (3)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。 如图为一种超导体的面心立方晶胞,C60 分子占据顶点和面心处,K+占据的是 C60 分子围成的 ___空隙和___空隙(填几何空间构型);若 C60 分子的坐标参数分别为 A(0,0,0),B( 1 2 ,0, 1 2 ),C(1,1,1)等,则距离 A 位置最近的阳离子的原子坐标参数为___。 (4)Ni 可以形成多种氧化物,其中一种 NiaO 晶体晶胞结构为 NaCl 型,由于晶体缺陷,a 的 值为 0.88,且晶体中的 Ni 分别为 Ni2+、Ni3+,则晶体 Ni2 与 Ni3+产的最简整数比为___,晶胞 参数为 428 pm,则晶体密度为___g•cm-3(NA 表示阿伏加德罗常数的值,列出表达式)。 36.莫沙朵林是一种镇痛药,它的合成路线如下: (1)B 中手性碳原子数为____________;化合物 D 中含氧官能团的名称为____________。 (2)C 与新制氢氧化铜反应的化学方程式为____________。 (3)写出同时满足下列条件的 E 的一种同分异构体的结构简式:____________ I.核磁共振氢谱有 4 个峰; Ⅱ.能发生银镜反应和水解反应; Ⅲ.能与 FeCl3 溶液发生显色反应. (4)已知 E+X→F 为加成反应,化合物 X 的结构简式为____________。 (5)已知: .化合物 是合成抗病毒药阿昔洛韦的中 间体,请设计合理方案以 和 为原料合成该化合物(用合成路线流程图表示,并注明 反应条件).______________。 合成路线流程图示例如下: 。 2020 年高三年级化学冲刺训练二答案解析 可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Cl-35.5 Ni-59 Zn-65 Ba-137 第Ⅰ卷 一、选择题:(本题共 7 小题,只有一项符合题目要求,每小题 6 分,共 42 分。) 7.化学与生产和生活密切相关。下列有关说法正确的是 A. 古代记载文字的器物“甲骨”与 “丝帛”成分相同 B. 苏打可用于制作发酵粉,在医疗上也可以用作治疗胃酸过多 C. 我国自主研发的“龙芯 4000 系列”CPU 芯片与光导纤维是同种材料 D. 用于制作 N95 型口罩的“熔喷布”主要原料是聚丙烯,聚丙烯的分子长链上有支链 7.D【解析】 “甲骨”主要成分是碳酸盐而“丝帛”主要成分是蛋白质,故二者成分不同,故 A 错 误;用作发酵粉和用于治疗胃酸过多的是小苏打,而不是苏打,故 B 错误;我国自主研发的“龙 芯一号”CPU 芯片主要成分是硅,光导纤维的主要成分是二氧化硅,不是同种材料,故 C 错误; 聚丙烯中的甲基处在支链上,故 D 正确。 8.多巴胺是一种神经传导物质,会传递兴奋及开心的信息。其部分合成路线如下,下列说法正 确的是 A. 甲在苯环上的溴代产物有 2 种 B. lmol 乙与 H2 发生加成,最多消耗 3molH2 C. 多巴胺分子中所有碳原子可能处在同一平面 D. 甲、乙、多巴胺 3 种物质均属于芳香烃 8.C【解析】甲( )在苯环上的一溴代产物有 2 种,还有二溴代产物等,故 A 错误; 乙( )中的苯环和羰基都能与氢气发生加成反应,lmol 乙最多可以与 4molH2 发生加成反应,故 B 错误;多巴胺( )分子中苯环上的 6 个碳 原子共平面,碳碳单键可以旋转,则侧链上的碳原子可能处于苯环所在平面,故 C 正确;甲、 乙、多巴胺中除了还有 C 和 H 元素外,还含有其他元素,均属于烃的衍生物,故 D 错误。 9.NA 表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用千冶金染料、皮革等工业。硫 化钠的一种制备方法是 Na2SO4+2C Na2S+2CO2↑。下列有关说法正确的是 A. 12 g 石墨晶体中含有碳碳键的数目为 3 NA B. 1 L 0.1 mol•L-1 Na2S 溶液中含阴离子的数目小于 0.l NA C. 生成 1mol 氧化产物时转移电子数为 4 NA D. 常温常压下,11.2LCO2 中含质子的数目为 11 NA 9.C【解析】石墨中 1 个 C 对应 1.5 个碳碳键,即 12g 石墨晶体中含有碳碳键的数目为 1.5NA, A 项错误; 1 L 0.1 mol/L Na2S 溶液中含有 0.1mol Na2S,硫离子水解生成 HS-和氢氧根离子,阴离子的数 目大于 0.1NA,B 项错误;根据方程式,氧化产物为二氧化碳,生成 1mol 氧化产物时转移电 子数为 4NA,C 项正确;通常状况下,气体摩尔体积不是 22.4L/mol,故 11.2L CO2 物质的量不 是 0.5mol,所含质子的数目不是 11NA,D 项错误。 10.某研究小组利用下图装置探究 SO2 和 Fe(NO3)3 溶液的反应原理。下列说法错误的是 A. 装置 B 中若产生白色沉淀,说明 Fe3+能将 SO2 氧化成 SO42- B. 实验室中配制 70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒 C. 三颈烧瓶中通入 N2 的操作应在滴加浓硫酸之前,目的是排尽装置内的空气 D. 装置 C 可能发生倒吸,同时还不能完全吸收反应产生的尾气 10.A【解析】装置 A 中 70%的硫酸与亚硫酸钠反应放出二氧化硫,二氧化硫的水溶液显酸性, 在酸性条件下,NO3-能够氧化二氧化硫生成 SO42-,从而在 B 中产生硫酸钡白色沉淀,不能说 明 Fe3+能将 SO2 氧化成 SO42-,故 A 错误;实验室中配制 70%的硫酸,需要用量筒量取适当体 积的浓硫酸,然后慢慢倒入一定量水中,边倒边搅拌,需要的玻璃仪器有量筒、烧杯、玻璃 棒,故 B 正确;二氧化硫能够被氧化,为了排除空气中氧气的干扰,在滴加浓硫酸之前,三 颈烧瓶中需要通入 N2 以排尽装置内的空气,故 C 正确;二氧化硫在水中的溶解度较大,装置 C 可能发生倒吸,且气体与液体的反应接触不充分,会导致产生的尾气不能完全吸收,故 D 正确。 11.主族元素 W、X、Y、Z 的原子序数依次增加,且均不超过 20。W、X、Y 最外层电子数之 和为 15, 是实验室常用的一种化学试剂。下列说法中错误的是 A. Z2Y 的水溶液呈碱性 B. 最简单氢化物沸点高低为:X>W C. 常见单质的氧化性强弱为:W>Y D. 中各原子最外层均满足 8 电子稳定结构 11.C【解析】由题干可知, 为实验室一种常见试剂,由结构式可知,Z 为第 一主族元素,W 为第四主族元素,X 为第五主族元素,由 W、X、Y 最外层电子数之和为 15 可知,Y 为第ⅥA 族元素,因为 W、X、Y、Z 为原子序数依次递增的主族元素,且均不超过 20,因此 W 为碳,X 为氮,Y 为硫,Z 为钾。Z2Y 为 K2S,由于 S2-水解,所以溶液显碱性, 故 A 项正确;X 的最简单氢化物为 NH3,W 的最简单氢化物为 CH4,因为 NH3 分子间存在氢 键,所以沸点高,故 B 项正确;根据非金属性,硫的非金属性强于碳,所以对应单质的氧化 性也强,故 C 项错误; 中三种元素最外层电子均满足 8 电子稳定结构,故 D 项 正确。 12.一种双电子介体电化学生物传感器,用于检测水体急性生物毒性,其工作原理如图。下列 说法正确的是( ) A. 图中所示电极为阳极,其电极反应式为 K4Fe(CN6)-e-=K3Fe(CN)6 B. 甲荼醌在阴极发生氧化反应 C. 工作时 K+向图中所示电极移动 D. NAD(P)H 转化为 NAD(P)+的过程失去电子 12.D【解析】根据图示可知 K4Fe(CN6)在电极表面失电子生成 K3Fe(CN)6,故图示电极为阳极, 其电极方程式为 K4Fe(CN6)-e-=K3Fe(CN)6+K+,A 项错误;甲萘醌应在阴极发生还原反应,B 项错误;工作时在电解池中阳离子应向阴极移动,C 项错误;根据图示,该过程 NAD(P)H 被 甲萘醌氧化,即失去电子,D 项正确。 13.某温度下,分别向 10.00mL0.1mol/L 的 KCl 和 K2CrO4 溶液中滴加 0.1mol/LAgNO3 溶液,滴 加过程中-lgc(M)(M 为 Cl-或 CrO42-)与 AgNO3 溶液体积(V)的变化关系如图所示(忽略溶液体积 变化)。下列说法不正确的是( ) A. 曲线 L1 表示-lgc(Cl-)与 V(AgNO3)的变化关系 B. M 点溶液中:c(NO3-)>c(K+)>c(Ag+)>c(H+)>c(OH-) C. 该温度下,Ksp(Ag2CrO4)=4.0×10-12 D. 相同实验条件下,若改为 0.05mol/L 的 KCl 和 K2CrO4 溶液,则曲线 L2 中 N 点移到 Q 点 13.D【解析】KCl 和硝酸银反应的化学方程式为: 3 3KCl AgNO AgCl KNO ,铬酸钾 和硝酸银反应的化学方程式为: 2 4 3 2 4 3K CrO 2AgNO Ag CrO 2KNO ,根据反应方程 式可知在相同浓度的 KCl 和 2 4K CrO 溶液中加入相同浓度的硝酸银溶液,氯离子浓度减小的 更快,所以 1L 代表是 lgc Cl 与 3V AgNO 的变化关系,故 A 正确;M 点加入的硝酸银 溶液体积是 15mL,根据反应方程式 3 3KCl AgNO AgCl KNO 可知,生成 0.001mol硝 酸钾和 0.001mol氯化银,剩余 0.0005mol 硝酸银,则 3c NO c K c Ag ,银离子 水 解 使 溶 液 表 现 酸 性 , 则 c H c OH , 所 以 M 点 溶 液 中 , 离 子 浓 度 为 : 3c NO c K c Ag c H c OH ,故 B 正确;N 点纵坐标的数值是 4,则 2 4Ag CrO 在 沉 淀 溶 解 平 衡 中 2 4 4c CrO 10 , 4c Ag 2 10 mol / L , 2 2 4 4 2 12 sp 2 4 4K Ag CrO c CrO c Ag 10 (2 10 ) 4.0 10 ,故 C 正确;相同 实验条件下同一种溶液的 spK 相同,平衡时溶液中 2 4 4c CrO 10 ,Q 对应的纵坐标数值是 4.0 ,即 2 4.0 4c CrO 10 ,曲线 2L 中 N 点移到 Q 点上方,故 D 错误。 第 II 卷(非选择题共 174 分) 三、非选择题: 26.次硫酸氢钠甲醛(aNaHSO2•bHCHO•cH2O)在印染、医药以及原子能工业中应用广泛。以 Na2SO3、SO2、HCHO 和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下: 步骤 1:在如图所示装置的烧瓶中加入一定量 Na2SO3 和水,搅拌溶解,缓慢通入 SO2,至溶 液 pH 约为 4,制得 NaHSO3 溶液。 步骤 2:将装置 A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在 80~90℃下,反应约 3h,冷却至室温,抽滤。 步骤 3:将滤液真空蒸发浓缩,冷却结晶。 (1)装置 B 的烧杯中应加入的溶液是___。 (2)步骤 2 中加入锌粉时有 NaHSO2 和 Zn(OH)2 生成。 ①写出加入锌粉时发生反应的化学方程式:___。 ②生成的 Zn(OH)2 会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是___。 (3)冷凝管中回流的主要物质除 H2O 外,还有___(填化学式)。 (4)步骤 3 中次硫酸氢钠甲醛不在敞口容器中蒸发浓缩的原因是___。 (5)步骤 2 抽滤所得滤渣的成分为 Zn 和 Zn(OH)2,利用滤渣制备 ZnO 的实验步骤为:将滤 渣置于烧杯中,___,900℃煅烧。(已知:Zn 与铝类似,能与 NaOH 溶液反应;Zn2+开始沉淀 的 pH 为 5.9,沉淀完全的 pH 为 8.9,pH>11 时,Zn(OH)2 能生成 ZnO22-。实验中须使用的试 剂有 1.0mol•L-1NaOH 溶液、1.0mol•L-1HCl 溶液、水) (6)产物组成测定实验: 准确称取 1.5400g 样品,溶于水配成 l00mL 溶液;取 25.00mL 样品溶液经 AHMT 分光光度法 测得溶液吸光度 A=0.4000(如图);另取 25.00mL 样品溶液,加入过量碘水后,加入 BaCl2 溶 液至沉淀完全,过滤、洗涤、干燥至恒重得到 BaSO4 固体 0.5825g。 ①样品溶液 HCHO 浓度为___mol•L-1。 ②通过计算确定 aNaHSO2·bHCHO•cH2O 的化学式为___。 26. (1)NaOH 溶液(或 Na2CO3 溶液) (2)①Zn+NaHSO3+H2O=NaHSO2+Zn(OH)2 ②加快 搅拌的速度 (3)HCHO (4)次硫酸氢钠甲醛被空气中氧气氧化 (5)向烧杯中加入 1.0mol·L-1HCl 溶液,充分搅拌至固体完全溶解。向所得溶液中滴加 1.0mol·L-1NaOH 溶液,调 节 溶 液 pH 约 为 10( 或 8.9≤pH≤11) 。 过 滤 、 用 水 洗 涤 固 体 2 ~ 3 次 [ 或 向 烧 杯 中 加 入 1.0mol·L-1NaOH 溶液,充分搅拌至固体完全溶解。向所得溶液中滴加 1.0mol·L-1HCl 溶液,调 节溶液 pH 约为 10(或 8.9≤pH≤11)。过滤、用水洗涤固体 2~3 次 (6)①0.1000 ② NaHSO2·HCHO·2H2O 【解析】(1)实验中未反应的二氧化硫会通过导管进入装置 B,可以用 NaOH 溶液(或 Na2CO3 溶液)吸收二氧化硫,以防止污染空气,故答案为:NaOH 溶液(或 Na2CO3 溶液); (2)①NaHSO3 溶液与锌粉反应生成 NaHSO2 和 Zn(OH)2,反应中 S 元素的化合价由+4 价降为+2 价,Zn 元素的化合价由 0 价升至+2 价,根据得失电子守恒、原子守恒,化学反应方程式为: Zn+NaHSO3+H2O=NaHSO2+Zn(OH)2,故答案为:Zn+NaHSO3+H2O=NaHSO2+Zn(OH)2; ②为防止生成的 Zn(OH)2 会覆盖在锌粉表面阻止反应进行,可以快速搅拌避免氢氧化锌在锌粉 表面沉积,故答案为:加快搅拌的速度; (3)甲醛易挥发,在 80~90 ℃下会大量挥发,加冷凝管可以使甲醛冷凝回流,提高甲醛利用率, 故答案为:HCHO; (4)次硫酸氢钠甲醛具有强还原性,在敞口容器中蒸发浓缩,遇到空气中的氧气易被氧化变质, 故答案为:次硫酸氢钠甲醛被空气中氧气氧化; (5)为了使 Zn 和氢氧化锌尽可能转化为 ZnO,结合 Zn 和氢氧化锌的性质,可以先加盐酸使滤 渣完全溶解,后加 NaOH 溶液调节 pH 使 Zn 元素完全转化成氢氧化锌沉淀(或先加 NaOH 溶 液使滤渣完全溶解,后加盐酸调节 pH 使 Zn 元素完全转化成氢氧化锌沉淀),故实验步骤为: 向烧杯中加入 1.0mol·L-1HCl 溶液,充分搅拌至固体完全溶解。向所得溶液中滴加 1.0mol·L-1NaOH 溶液,调节溶液 pH 约为 10(或 8.9≤pH≤11)。过滤、用水洗涤固体 2~3 次[或 向烧杯中加入 1.0mol·L-1NaOH 溶液,充分搅拌至固体完全溶解。向所得溶液中滴加 1.0mol·L-1HCl 溶液,调节溶液 pH 约为 10(或 8.9≤pH≤11)。过滤、用水洗涤固体 2~3 次,故 答案为:向烧杯中加入 1.0mol·L-1HCl 溶液,充分搅拌至固体完全溶解。向所得溶液中滴加 1.0mol·L-1NaOH 溶液,调节溶液 pH 约为 10(或 8.9≤pH≤11)。过滤、用水洗涤固体 2~3 次[或 向烧杯中加入 1.0mol·L-1NaOH 溶液,充分搅拌至固体完全溶解。向所得溶液中滴加 1.0mol·L-1HCl 溶液,调节溶液 pH 约为 10(或 8.9≤pH≤11)。过滤、用水洗涤固体 2~3 次; (6)①25.00mL 样品溶液经 AHMT 分光光度法测得溶液吸光度 A=0.4000,根据图示可知,样品 溶液 HCHO 浓度为 0.1000mol•L-1,故答案为:0.1000; ②25.00 mL 溶液中:根据 S 守恒,n(NaHSO2)=n(NaHSO4)=n( BaSO4)= 1 0.5825 g 233g mol - =0.0025 mol,n(HCHO)=0.1000mol/L×0.025L=0.0025 mol;100 mL 溶液中:n(NaHSO2)=4×0.0025mol =0.01mol,n(HCHO)=4×0.0025mol=0.01 mol,n(H2O)= 1 1 1 (1.5400 g 88 g mol 0.01 mol 30 g mol 0.01 mol) 18 g mol - - - - - =0.02 mol,a:b:c= n(NaHSO2):n(HCHO):n(H2O)=0.01mol:0.01mol:0.02 mol=1:1:2,所以次硫酸氢钠甲 醛的化学式为 NaHSO2·HCHO·2H2O,故答案为:NaHSO2·HCHO·2H2O。 27.以含锂电解铝废渣(主要成分为 LiF、AlF3、NaF,少量 CaO 等)为原料,生产高纯度 LiOH 的工艺流程如图:(已知:常温下,LiOH 可溶于水,Li2CO3 微溶于水) (1)含锂电解铝废渣与浓硫酸在 200~400℃条件下反应 2h。“滤渣 1”主要成分是___(填化学 式)。 (2)“过滤 2”需要趁热在恒温装置中进行,否则会导致 Li2SO4的收率下降,原因是___。 (已知部分物质的溶解度数据见下表) 温度/℃ Li2SO4/g Al2(SO4)3/g Na2SO4/g 0 36.1 31.2 4.9 10 35.4 33.5 9.1 20 34.8 36.5 19.5 30 34.3 40.4 40.8 40 33.9 45.7 48.8 (3)40°C 下进行“碱解”,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝的离子方程式 为___;若碱解前滤液中 c(Li+)=4mol•L-1,加入等体积的 Na2CO3 溶液后,Li+的沉降率到 99%, 则“滤液 2”中 c(CO32-)=___mol•L-1。[Ksp(Li2CO3)=1.6×10-3] (4)“苛化”过程,若氧化钙过量,则可能会造成___。 (5)整个工艺流程中可以循环利用的物质有___。 (6)“电解”原理如图所示。“碳化”后的电解液应从(填“a”或“b”)___口注入。阴极的电极反应 式为___。 (7)高纯度 LiOH 可转化为电池级 Li2CO3。将电池级 Li2CO3 和 C、FePO4 高温下反应,生成 LiFePO4 和一种可燃性气体,该反应的化学方程式为___。 27. (1)CaSO4 (2)溶液温度下降,硫酸钠结晶析出时,夹裹了部分的硫酸锂共沉淀 (3)2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ 4 (4)碳酸锂产品的钙离子含量相对升高 ( 或 使 得 氢 氧 化 铝 溶 解 进 入 溶 液 , 导 致 最 终 产 品 的 纯 度 下 降 ) (5)CO2 (6)a 2H2O+2e-=H2↑+2OH- (7)Li2CO3+2C+2FeSO4 高温 2LiFePO4+3CO↑ 【解析】(1)根据分析得到“滤渣 1”主要成分是 CaSO4; (2)“过滤 2”需要趁热在恒温装置中进行,根据表中溶解度曲线得出硫酸钠晶体析出可能会夹带 着硫酸锂,从而导致 Li2SO4 的收率下降;故答案为:溶液温度下降,硫酸钠结晶析出时,夹 裹了部分的硫酸锂共沉淀; (3)40°C 下进行“碱解”,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝主要是碳酸根和 铝离子发生双水解,其离子方程式为 2Al3++3CO32−+3H2O=2Al(OH)3↓+3CO2↑;若碱解前滤 液中 c(Li+)=4mol∙L−1,加入等体积的 Na2CO3 溶液后,Li+的沉降率到 99%,则此时溶液中 c(Li+)= 1 11L (1 99%) =0.022L 4mol L mol L ,根据 2 + 2- 2 2- -3 sp 2 3 3 3Li CO = (Li ) (CO )=0.02 (CO )=1.6 10K c c c ,得到“滤液 2”中 12 3(CO ) l L4moc ; (4)“苛化”过程,若氧化钙过量,溶液中含有多余的钙离子,也可能将生成的氢氧化铝溶解进 入得到溶解中;故答案为:碳酸锂产品的钙离子含量相对升高(或使得氢氧化铝溶解进入溶液, 导致最终产品的纯度下降)。 (5)碱解的过程中生成 CO2,在碳化过程中加入 CO2,因此整个工艺流程中可以循环利用的物 质有 CO2; (6)“电解”原理如图所示,LiOH 是从右边得到,而锂离子通过阳离子交换膜进入到右室,因此 “碳化”后的电解液应从 a 口注入。阴极是水中的氢离子得到电子,其电极反应式为 2H2O+2e- =H2↑+2OH-; (7)将电池级 Li2CO3 和 C、FePO4 高温下反应,根据氧化还原反应,FePO4 中 Fe 化合价降低, 则 C 化合价升高,生成 LiFePO4 和一种可燃性气体即 CO,该反应的化学方程式为 Li2CO3+2C +2FeSO4 高温 2LiFePO4+3CO↑。 28.乙烯、环氧乙院是重要的化工原料,用途广泛。回答下列问题: 已知:I.2CH2=CH2(g)+O2(g) 2 (g) △H1=-206.6 kJ•mo1-1 II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1) △H2 III.2 (g)+5O2(g)=4CO2(g)+4H2O(1) △H3 (1)反应 III:△S(填“>”“<”或“=”)___0。 (2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已 知乙烯的热值为 50.4kJ•g-1,则△H3=___kJ•mol-1 (3)实验测得 2CH2=CH2(g)+O2(g) 2 (g)中,v 逆=k 逆 c2( ),v 正=k 正 •c2(CH2=CH2)•c(O2)(k 正、k 逆为速率常数,只与温度有关)。 ①反应达到平衡后,仅降低温度,下列说法正确的是( ) A.k 正、k 逆均增大,且 k 正增大的倍数更多 B.k 正、k 逆匀减小,且 k 正减小的倍数更少 C.k 正增大、k 逆减小,平衡正向移动 D.k 正、k 逆均减小,且 k 逆减小的倍数更少 ②若在 1L 的密闭容器中充入 1molCH2=CH2(g)和 1 molO2(g),在一定温度下只发生反应 I,经 过 10 min 反应达到平衡,体系的压强变为原来的 0.875 倍,则 0~10 min 内 v(O2)=___, =___。 (4)现代制备乙烯常用乙烷氧化裂解法: C2H6(g)+ 1 2 O2(g)=C2H4(g)+H2O(g) △H2=-110 kJ•mol-1,反应中还存在 CH4、CO、CO2 等副 产物(副反应均为放热反应),图 1 为温度对乙烷氧化裂解反应性能的影响。 ①乙烷的转化率随温度的升高而升高的原因是___;反应的最佳温度为___(填序号)。 A.650 ℃ B.700 ℃ C.850 ℃ D.900 ℃ [乙烯选择性= ;乙烯收率=乙烷转化率×乙烯选择性] ②工业上,保持体系总压恒定为 l00 kPa 的条件下进行该反应,通常在乙烷和氧气的混合气体 中掺混惰性气体(惰性气体的体积分数为 70%),掺混惰性气体的目的是___。 28. (1)< (2)-2615.8 (3)①B ②0.025 mol∙L−1∙min−1 0.75 (4) ①温度升高,反 应速率加快,转化率升高 C ②正反应是气体分子数增多的反应,恒压充入惰性气体相 当于扩大容器体积,降低分压,有利于平衡正向移动 【解析】⑴反应 III 是体积减小的反应,因此△S<0。 (2)已知乙烯的热值为 50.4 kJ·g−1,则△H2=-1411.2 kJ·mol−1 将第 II 个方程式的 2 倍减去第 I 个方程式得到 III,则△H3=-2615.8·mol−1。 (3)①该反应是放热反应,反应达到平衡后,仅降低温度,速率降低,k 正、k 逆匀减小,平衡 向放热方向即正向进行,正反应速率大于逆反应速率,因此 k 正减小的倍数更少;故答案为: B。 ② ,x=0.25mol,则 0~10min 内 , k 逆 c2( )=k 正∙c2(CH2=CH2)∙c(O2), =0.75。 ⑷①由图可知,随温度的升高,乙烷的转化率再升高,考虑化学反应速率的影响因素,温度 升高,反应速率加快,转化率升高;根据图中要使乙烷的转化率尽可能高,而副产物又相对 较少,及乙烯的选择性较高,应找到乙烯收率较高时的温度,对应温度为 850℃;故答案为: 温度升高,反应速率加快,转化率升高;850℃。 ②工业上,保持体系总压恒定为 100kPa 的条件下进行该反应,通常在乙烷和氧气的混合气体 中掺混惰性气体(惰性气体的体积分数为 70%),掺混惰性气体的目的是正反应是气体分子数增 多的反应,恒压充入惰性气体相当于扩大容器体积,降低分压,有利于平衡正向移动;故答 案为:正反应是气体分子数增多的反应,恒压充入惰性气体相当于扩大容器体积,降低分压, 有利于平衡正向移动。 35.2019 年 10 月 1 曰,在庆祝中华人民共和国成立 70 周年的阅兵仪式上,最后亮相的 DF-31A 洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了 Fe、Cr、Ni、C 等多种元素。回答下列问题: (1)基态 Cr 原子的价电子排布式为___。 (2)实验室常用 KSCN 溶液、苯酚( )检验 Fe3+。 ①第一电离能:N___O(填“>”或“<”)。 ②1 mol 苯酚中含有的σ数目为___。 ③苯酚中的氧原子和碳原子均采用相同的杂化方式,其类型为___。 ④从结构的角度分析苯酚的酚羟基有弱酸性的原因为___。 (3)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。 如图为一种超导体的面心立方晶胞,C60 分子占据顶点和面心处,K+占据的是 C60 分子围成的 ___空隙和___空隙(填几何空间构型);若 C60 分子的坐标参数分别为 A(0,0,0),B( 1 2 ,0, 1 2 ),C(1,1,1)等,则距离 A 位置最近的阳离子的原子坐标参数为___。 (4)Ni 可以形成多种氧化物,其中一种 NiaO 晶体晶胞结构为 NaCl 型,由于晶体缺陷,a 的 值为 0.88,且晶体中的 Ni 分别为 Ni2+、Ni3+,则晶体 Ni2 与 Ni3+产的最简整数比为___,晶胞 参数为 428 pm,则晶体密度为___g•cm-3(NA 表示阿伏加德罗常数的值,列出表达式)。 35. (1)3d54s1 (2)①> ②13NA ③sp2 ④酚羟基的氧原子参与形成了大π键,使氧 原子电荷密度下降,氢离子容易电离 (3)正四面体 正八面体 ( 1 4 ,1 4 ,1 4 ) (4)8:3 -10 3 A 4 (59 0.88+16) N (428 10 ) 【解析】⑴基态 Cr 原子有 24 个电子,电子排布式为[Ar]3d54s1,基态 Cr 的价电子排布式为 3d54s1。 ⑵①同周期从左到右第一电离能有增大的趋势,但第 VA 族大于第 VIA 族,因此第一电离能: N >O。 ②1 个苯酚分子含有 5 个 C—H 键,6 个 C—C 键,1 个 O—H 键,即共 13 个σ键,因此 1mol 苯酚中含有的σ数目为 13NA。 ③苯酚中的氧原子和碳原子均采用相同的杂化方式,每个碳原子有 3 个σ键,无孤对电子,因 此其杂化类型为 sp2。 ④从结构的角度分析苯酚的酚羟基有弱酸性的原因为酚羟基的氧原子参与形成了大π键,使氧 原子电荷密度下降,氢离子容易电离;故答案为:酚羟基的氧原子参与形成了大π键,使氧原 子电荷密度下降,氢离子容易电离。 ⑶如图为一种超导体的面心立方晶胞,C60 分子占据顶点和面心处, ,如图, 2 号 K+在三个面心和一个顶点共 4 个 C60 形成的四面体的体心,1 号在上下左右前后 6 个 C60 形成的正八面体的体心,因此 K+占据的是 C60 分子围成的正四面体空隙和正八面体空隙;若 C60 分子的坐标参数分别为 A(0,0,0),B( 1 2 ,0, 1 2 ),C(1,1,1)等,则距离 A 位置最近的 阳离子就是 2 号 K+,其原子坐标参数为( 1 4 , 1 4 , 1 4 )。 ⑷Ni 可以形成多种氧化物,其中一种 NiaO 晶体晶胞结构为 NaCl 型,一个晶胞中含有 4 个 Ni 和 4 个氧,由于晶体缺陷,a 的值为 0.88,且晶体中的 Ni 分别为 Ni2+、Ni3+,设 Ni2+有 x 个, Ni3+有y个,根据电荷守恒和质量守恒得到x + y =0.88,2x + 3y = 2,解得x=0.64,y=0.24,0.64:0.24 =8:3,因此晶体 Ni2+与 Ni3+的最简整数比为 8:3,晶胞参数为 428 pm,则晶体密度为 。 36.莫沙朵林是一种镇痛药,它的合成路线如下: (1)B 中手性碳原子数为____________;化合物 D 中含氧官能团的名称为____________。 (2)C 与新制氢氧化铜反应的化学方程式为____________。 (3)写出同时满足下列条件的 E 的一种同分异构体的结构简式:____________ I.核磁共振氢谱有 4 个峰; Ⅱ.能发生银镜反应和水解反应; Ⅲ.能与 FeCl3 溶液发生显色反应. (4)已知 E+X→F 为加成反应,化合物 X 的结构简式为____________。 (5)已知: .化合物 是合成抗病毒药阿昔洛韦的中 间体,请设计合理方案以 和 为原料合成该化合物(用合成路线流程图表示,并注明 反应条件).______________。 合成路线流程图示例如下: 。 【答案】 (1)3 酯键、羟基 (2) +2Cu(OH)2+NaOH + Cu2O↓+3H2O (3) (4)CH3N=C=O (5) 【 解 析 】( 1 ) 根 据 B 物 质 的 结 构 简 式 可 知 , 分 子 中 含 有 3 个 手 性 碳 原 子 , 即 ,根据 D 的结构简式可知,化合物 D 中含氧官能团的名称为酯基、羟基。 (2)C 中含有醛基,能和新制的氢氧化铜悬浊液反应,则 C 与新制氢氧化铜反应的化学方程 式为 。 (3)能发生银镜反应和水解反应,这说明分子中含有酯基和醛基。能与 FeCl3 溶液发生显色 反应,说明分子中含有酚羟基。又因为核磁共振氢谱有 4 个峰,所以应该是甲酸形成的酯, 则可能的结构简式有 。 (4)根据 EF 的结构简式并根据原子守恒可知,该反应应该是加成反应,所以 X 的结构简式 应该是 CH3N=C=O。 (5) 可发生催化氧化生成 ,然后发生消去反应生成 ,然后发生取 代反应生成 ,进而与 作用可生成目标物,反应流程为 。查看更多