- 2021-08-06 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年湖南省湘东六校高一4月联考化学试题
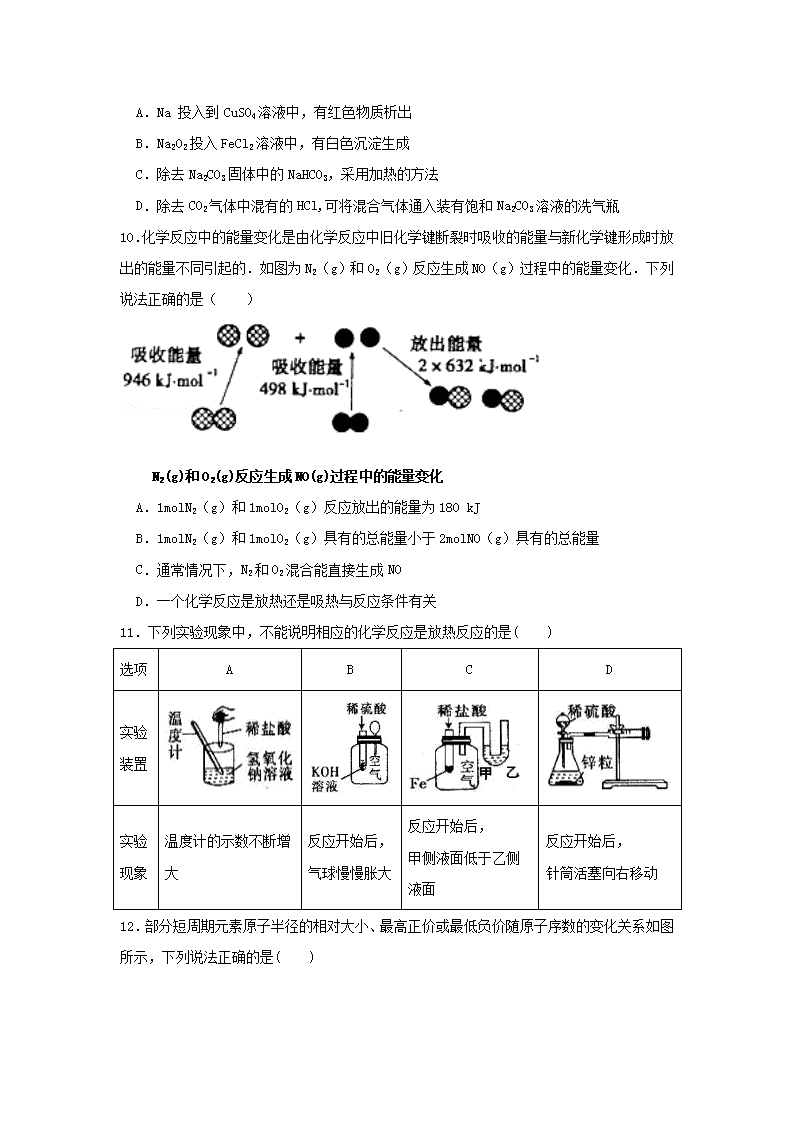
2018-2019学年湖南省湘东六校高一4月联考化学试题 总分:100分 时量:80分钟 考试时间2019年4月2日 由醴陵市一中·浏阳市一中·株洲市二中·株洲市八中·株洲市四中·攸县一中联合命题 姓名: 考号: 可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Cl:35.5 Fe:56 第Ⅰ卷 选择题(共48分) 一、选择题(本题包括16小题,每小题3分,共48分。每小题都只有一个正确答案) 1.化学与生产和生活密切相关,下列说法正确的是( ) A.HClO具有强还原性,可用于自来水的消毒杀菌 B.二氧化硅具有半导体性质,用于制造光导纤维 C.明矾具有消毒杀菌的作用,常用作净水剂 D.“光化学烟雾”、“硝酸型酸雨”的形成与氮氧化物有关 2.下列实验中,所选装置不合理的是( ) A.粗盐提纯,选①和② B.用CCl4提取碘水中的碘,选③ C.分离饱和Na2CO3溶液和CH3COOC2H5(难溶于水)选④ D.用FeCl2溶液吸收Cl2(已知2FeCl2+Cl2=2FeCl3)选⑤ 3.下列化学用语表达正确的是( ) A. R2+离子核外有a个电子,b个中子,R原子表示为:R B.H2O2的电子式: C. 次氯酸的结构式:H-Cl-O D.NaClO的电离方程式:NaClO=Na++Cl-+O2- 4.NA表示阿伏加德罗常数,下列叙述不正确的是( ) A.在标准状况下,22.4LCO与CO2的混合气体中含有NA个碳原子 B.1molCH3-(碳负离子)中含电子数目为10NA C.常温下,在18中含有NA个氧原子 D.22.4LHCl气体配成500 mL溶液,则每升溶液中含2NA个氯离子 5. 表示下列反应的离子方程式正确的是( ) A.实验室用NaOH溶液吸收NO2气体:2OH-+2NO2===NO3-+NO2-+H2O B.用氯化铁溶液腐蚀印刷线路板的反应:Fe3++Cu===Fe2++Cu2+ C.向氯化铝溶液中加入过量氨水:Al3++4NH3·H2O===AlO+4NH+2H2O D.H2O中投入Na2O2固体:2H2O+2O22-===4OH-+O2↑ 6. 在某酸性无色溶液中,能大量共存的离子组是( ) A. Na+、K+、SO42-、AlO2- B. Na+、Ba2+、Cl-、NO3- C. Cu2+、Ca2+、Cl-、NO3- D. Fe3+、K+、NO3-、SCN- 7.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。已知反应: Fe2O3+3Na2O2 2Na2FeO4+Na2O,下列说法正确的是( ) A.Na2O2既是氧化剂又是还原剂 B.Na2FeO4既是氧化产物又是还原产物 C.3molNa2O2发生反应,有12mol电子转移 D.在 Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 8.下列实验操作正确且能达到相应实验目的的是( ) 实验目的 实验操作 A 称取2.0gNaOH固体 先在托盘上各放一张滤纸,然后在左盘上添加2g砝码,右盘上添加NaOH固体 B 制备Fe(OH)3胶体 向氯化铁饱和溶液中逐滴加入少量NaOH溶液,加热煮沸至溶液变为红褐色 C 证明碳酸的酸性强于硅酸 CO2通入Na2SiO3溶液中,析出硅酸沉淀 D 萃取碘水中的碘 将碘水倒入分液漏斗,然后再注入酒精,振荡,静置分层后,下层液体从下口放出,上层液体从上口倒出 9.下列说法正确的是( ) A.Na 投入到CuSO4溶液中,有红色物质析出 B.Na2O2投入FeCl2溶液中,有白色沉淀生成 C.除去Na2CO3固体中的NaHCO3,采用加热的方法 D.除去CO2气体中混有的HCl,可将混合气体通入装有饱和Na2CO3溶液的洗气瓶 10.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化.下列说法正确的是( ) N2(g)和O2(g)反应生成NO(g)过程中的能量变化 A.1molN2(g)和1molO2(g)反应放出的能量为180 kJ B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量 C.通常情况下,N2和O2混合能直接生成NO D.一个化学反应是放热还是吸热与反应条件有关 11.下列实验现象中,不能说明相应的化学反应是放热反应的是( ) 选项 A B C D 实验 装置 实验 现象 温度计的示数不断增大 反应开始后, 气球慢慢胀大 反应开始后, 甲侧液面低于乙侧液面 反应开始后, 针筒活塞向右移动 12.部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是( ) A.离子半径的大小顺序:e > f > g > h B.与a形成简单化合物的稳定性:b > c > d C.a、c、d三种元素形成的化合物可能是酸、碱或盐 D.e、f、g、h四种元素对应最高价氧化物的水化物相互之间均能发生反应 13.下列有关元素周期表的叙述中正确的是( ) A.由短周期元素和长周期元素共同组成的族一定是主族 B.某元素原子最外层电子数为2,则该元素一定位于ⅡA C.同主族相邻周期的两种元素A和B,则A与B的原子序数相差为8 D.元素周期表有七个横行即7个周期和十八个纵行即16个族 14.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( ) X Y ] Z W Q A.元素Y与W的最高化合价与最低化合价之和均等于4 B.非金属性X强于Y C.离子Y2-和Z3+均与氖的电子层结构相同 D.HQ的酸性强于H2W的酸性,证明非金属性Q大于W。 15.A、B、C、D、E是五种短周期主族元素,它们的原子序数依次增大。已知:A的一种原子不含中子;B原子最外层电子数是次外层的3倍;C与A处于同一主族;D的原子序数是B的2倍。下列叙述正确的是( ) A.B与C形成的化合物中一定含有离子键,也可能含有共价键 B.1 mol E的单质与C最高价氧化物对应水化物的溶液完全反应时,转移2 mol电子 C.最高氧化物对应水化物的酸性:D > E D.在B、D、E形成的简单离子中,E离子的还原性最强 16.下列有关说法正确的是( ) A.该组化合物中只含有共价键:H2O、NH4Cl、H2O2 B.由不同种非金属原子间通过共用电子对形成的化合物是共价化合物 C.Na2O、NaOH和Na2SO4为离子化合物,HCl、NH3、NH4NO3、H2SO4为共价化合物 D.非金属原子间以共价键结合的物质都是共价化合物 第II卷(非选择题 每空2分,共52分) 17.(10分)化学就在我们身边,它与我们的日常生活密切相关。按要求回答以下问题: (1)生活中常用到漂白粉,漂白粉的有效成分是 (填化学式)。 (2)以下①Cl2②Fe2O3 ③Na2O2 ④(NH4)2SO4四种物质中,可用做化肥的是________,可做油漆颜料的是________(填序号)。 (3)小苏打通常用来治疗胃酸过多,但同时患有胃溃疡的病人却不能服用,其原因是 _________________________________(用化学方程式表示)。 (4) “84消毒液”与洁厕灵(主要成分是浓盐酸)不能混用,混合会产生有毒气体,请用离子反应方程式解释原因 。 18.(14分)有A、B、C、D、E五种短周期元素,已知:①C+、D3+均与E的气态氢化物分子含有相同的电子数;A2-、B-与B的气态氢化物分子含有相同的电子数;②A单质在空气中燃烧产生气体R;③B的气态氢化物与E的气态氢化物相遇时有白烟生成。 请回答下列问题: (1)元素A在元素周期表中的位置是 。 (2)A、B、C、D的原子半径从大到小顺序为 (用元素符号表示) (3)B的气态氢化物与E的气态氢化物相遇时生成白烟的电子式为 ,其中所含化学键类型为 。 (4)D的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为 。 (5)A元素和B元素以原子个数比1:1形成化合物Q,Q的结构式为 己知Q是一种黄色油状液体,常温下遇水易反应,产生R气体, 且溶液出现浑浊,请写Q与水反应的化学方程式 。 19.( 14分)I.某实验小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置: (1)仪器a的名称是 。 (2)利用图中E装置进行实验室制备Cl2的离子方程式是____________________。 (3)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是____________________________。 (4)装置C的作用是____________________________________。 II.该小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验。 其中装置A制取氯气,装置C制取SO2: (1)甲同学认为若SO2和Cl2反应,则应有Cl-生成,只要检验到生成的Cl-即可,甲取适量B中样品于试管中,向其中滴加少量AgNO3溶液,有白色沉淀生成。 (2)乙同学认为甲同学的结论不合理,认为应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法实验即可得到正确结论。洗气瓶中盛有的试剂是 。 (3)丙同学认为按乙同学的建议改进实验也不合理,理由是: 。 (4)丙同学取BaCl2溶液于试管中,加入少量反应后B中的溶液,生成大量白色沉淀,得出正确结论:SO2与Cl2同时通入水中能相互发生反应,反应的化学方程式是 20.(14分)X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系: (1)若W为一种一元强碱,Y具有两性,X到Y的离子方程式为 。 (2)若X是一种黄绿色的气体,W是一种常见的金属。 ①检验溶液Z是否变质最灵敏的一种试剂是____________________(填名称); ②Y与W转化为Z的离子反应方程式 ; ③一定条件下W与水反应的化学方程式 。 (3)X常温下为气体化合物,Z是一种红棕色气体,则Y的化学式为_________________;Z与水反应的过程中,氧化剂与还原剂的质量比为 。 (4)X为一元强碱溶液,W是形成酸雨的主要气体。 则Y到Z的离子方程式为 ; 湖南省湘东六校2019年上期高一联考 化学答案 一、选择题(本题包括16小题,每小题3分,共48分。每小题都只有一个正确答案) 1 2 3 4 5 6 7 8 D C A D A B B C 9 10 11 12 13 14 15 16 C B D C D C A B 二、非选择题 (每空2分,共52分) 17.(10分) (1) Ca(ClO)2 (2) ④ ② (3) NaHCO3+HCl = NaCl+H2O+CO2↑ (4) ClO - + Cl- + 2H+ = Cl2↑+ H2O 18.(14分) (1) 第三周期 第ⅥA族 (2) Na>Al>S>Cl (3)① , 离子键、共价键(答对一个给1分)(4) Al(OH)3+OH- = AlO2-+2H2O (5) Cl-S-S-C1 , 2S2Cl2+2H2O = SO2↑+3S↓+4HCl 19.(14分) I.(1) 分液漏斗 (2) MnO2+4H++2Cl- Mn2++2H2O +Cl2↑ (3) 溶液由无色变为红色 (4) 吸收多余的氯气和二氧化硫,防止污染环境。 II.(2) 饱和食盐水 (3) Cl2和水反应也会生成Cl- (4) SO2+Cl2+2H2O=2HCl+H2SO4 20.(14分) (1) Al3++ 3OH-= Al(OH)3 ↓ (2) ① 硫氰化钾 ②2Fe3++Fe=3Fe2+ ③ 3Fe+4H2OFe3O4+4H2 (3) NO 1:2 (4) SO32-+SO2+H2O=2HSO3-查看更多