2018-2019学年广西梧州市高二下学期期末考试理科综合化学试题 解析版
梧州市2018~2019学年高二年级期末联合考试理科综合(化学部分)
可能用到的相对原子质量:H~1 C~12 O~16 S~32 K~39 Cu~64 I~127
一、选择题:本大题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列说法错误的是
A. 静置后的淘米水能产生丁达尔效应,这种淘米水具有胶体的性质
B. 商代后期铸造出工艺精湛的后母戊鼎,该鼎属于铜合金制品
C. 石油裂解和油脂皂化都是由高分子物质生成小分子物质的过程
D. 将浸泡过高锰酸钾溶液的硅藻土放入新鲜的水果箱内可以延长水果的保鲜期
【答案】C
【解析】
【详解】A项、丁达尔效应为胶体特有的性质,静置后的淘米水能产生丁达尔效应,这种“淘米水”是胶体,具有胶体的性质,故A正确;
B项、后母戊鼎是迄今世界上出土最大、最重的青铜礼器,为铜锡合金,故B正确;
C项、油脂不是高分子化合物,油脂皂化不是高分子生成小分子的过程,故C错误;
D项、乙烯是水果的催熟剂,乙烯中含有碳碳双键,能与高锰酸钾溶液发生氧化反应被吸收,延长水果的保鲜期,故D正确;
故选C。
【点睛】本题考查物质的性质与应用,侧重分析与应用能力的考查,把握物质的组成、性质、应用为解答的关键。
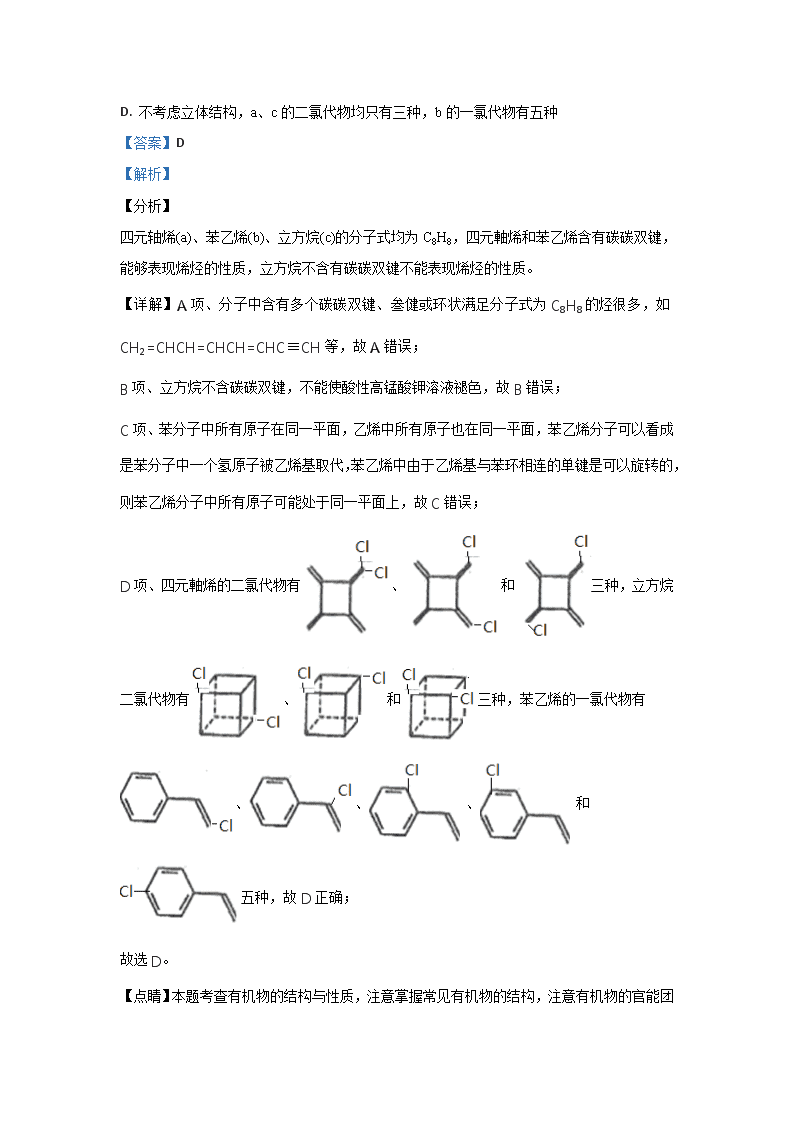
2.四元轴烯(a)、苯乙烯(b)、立方烷(c)的分子式均为C8H8,下列说法正确的是
A. a的同分异构体只有b和c两种
B. a、b、c均能使溴的四氯化碳溶液褪色
C. a、b分子中的所有原子一定处于同一平面
D. 不考虑立体结构,a、c的二氯代物均只有三种,b的一氯代物有五种
【答案】D
【解析】
【分析】
四元轴烯(a)、苯乙烯(b)、立方烷(c)的分子式均为C8H8,四元軸烯和苯乙烯含有碳碳双键,能够表现烯烃的性质,立方烷不含有碳碳双键不能表现烯烃的性质。
【详解】A项、分子中含有多个碳碳双键、叁健或环状满足分子式为C8H8的烃很多,如CH2=CHCH=CHCH=CHC≡CH等,故A错误;
B项、立方烷不含碳碳双键,不能使酸性高锰酸钾溶液褪色,故B错误;
C项、苯分子中所有原子在同一平面,乙烯中所有原子也在同一平面,苯乙烯分子可以看成是苯分子中一个氢原子被乙烯基取代,苯乙烯中由于乙烯基与苯环相连的单键是可以旋转的,则苯乙烯分子中所有原子可能处于同一平面上,故C错误;
D项、四元軸烯的二氯代物有、和三种,立方烷二氯代物有、和三种,苯乙烯的一氯代物有、、、和五种,故D正确;
故选D。
【点睛】
本题考查有机物的结构与性质,注意掌握常见有机物的结构,注意有机物的官能团对性质的影响,能够正确判断同分异构体的数目是解答关键。
3.根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
实验结论
A
向同体积同浓度的H2O2溶液中,分别加入1mol·L-1的氯化铜和氯化铁溶液,加氯化铁溶液的H2O2分解的快
铁离子对H2O2分解速率的影响比铜离子大
B
向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊
析出了NaHCO3
C
向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜,加热,得到蓝色溶液
蔗糖水解产物没有还原性
D
向NaCl和NaBr的混合溶液中滴入少量AgNO3溶液,产生淡黄色沉淀(AgBr)
Ksp(AgBr)
X,Y>M
D. 气态氢化物的稳定性:Y>M
【答案】A
【解析】
【分析】
由题意可知,X是短周期中金属性最强的元素,则X为Na元素;由Y原子的最外层电子数是最内层电子数的3倍,是电子层数的2倍可知,Y原子最外层电子数为6,原子有3个电子层,则Y为S元素;M的单质是一种有色气体,可用于自来水的消毒,则M为Cl元素;N的最高价氧化物对应的水化物是药物胃舒平的有效成分,该药物用于治疗胃酸过多,则N为Al元素。
【详解】A项、N与M形成的化合物为氯化铝,铝离子在溶液中水解,使溶液呈酸性,故A正确;
B项、X的两种常见氧化物为氧化钠和过氧化钠,氧化钠中只含有离子键,过氧化钠中含有离子键、共价键,故B错误;
C项、电子层结构相同,核电荷数越大,离子半径越小,则离子半径:N(Al3+)<(Na+),Y(S2-)>(Cl-),故C错误;
D项、元素非金属性越强,气态氢化物的稳定性越强,非金属性Y(S)”或“<”),CH4的平衡转化率为____%(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>”或“<”)T2,t=______s。
②列式计算反应2CH4(g)C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=____(用平衡分压代替平衡浓度计算,lg0.05=-1.3)。
③由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有___________。
【答案】 (1). CaC2+2H2O→Ca(OH)2+C2H2↑ (2). +376.4kJ/mol (3). > (4). 66.7% (5). > (6). 5 (7). 5×104 (8). 可以充入适量的乙烯
【解析】
【分析】
(1)碳化钙和水反应生成氢氧化钙和乙炔;
(2)根据盖斯定律来分析;
(3)①分解反应绝大多数为吸热反应;设出CH4的转化浓度,然后根据三段式,利用c(C2H4)=c(CH4)来解答;根据改变温度后,CH4的浓度升高来判断温度的变化;表示出变化后的CH4和C2H4的浓度,然后根据c(CH4)=2c(C2H4)来计算;
②根据平衡常数表达式来计算;
③甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,可以充入适量的乙烯。
【详解】(1)碳化钙和水反应生成氢氧化钙和乙炔,反应的化学方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)将已知反应依次编号为①、②、③,由盖斯定律将①×4-②-③×可得:2CH4(g)=C2H2(g)+3H2(g),则△H=(-890.3kJ•mol-1 )×4-(-1299.6kJ•mol-1)-(-571.6kJ•mol-1)×=+376.4kJ/mol,故答案为:+376.4kJ/mol;
(3)①升高温度,平衡向吸热反应方向移动,由图可知,温度升高,C2H4的平衡分压增大,说明反应2CH4(g)C2H4(g)+2H2(g)向正反应方向移动,则该反应为吸热反应;设平衡时C2H4的平衡浓度为Xmol,由题给数据建立如下三段式:
2CH4(g)C2H4(g)+2H2(g)
起(mol/L)0.3 0 0
变(mol/L)2X X 2X
平(mol/L)0.3—2X X 2X
由c(C2H4)=c(CH4)可得0.3—2X=X,解得X=0.1mol,CH4的平衡转化率=×100%=66.7%;改变温度后,CH4
的浓度升高,说明平衡向正反应方向移动,则温度应为降低,即T1>T2;由于CH4以0.01mol/(L•s)的平均速率增多,经ts后再次达到平衡,故在ts的时间内,CH4的浓度变化为0.01tmol/L,利用三段式来计算:
2CH4(g)C2H4(g)+2H2(g)
起(mol/L)0.1 0.1 0.2
变(mol/L)0.01t 0.005t 0.01t
平(mol/L)0.1+0.01t 0.1—0.005t 0.2—0.01t
由c(CH4)=2c(C2H4)可得0.1+0.01t=2×(0.1-0.005t),解得t=5S,故答案为:>;66.7%;>;5;
②由图中数据可知,A点温度时,C2H2平衡分压为0.05 Pa,H2平衡分压为104Pa,CH4平衡分压为103Pa,则平衡常数K==5×104 Pa,故答案为:5×104;
③甲烷裂解制乙炔有副产物乙烯生成,充入适量的乙烯,可抑制甲烷向乙烯的转化,从而提高甲烷制乙炔的转化率,故答案为:可以充入适量的乙烯。
【点睛】本题考查化学反应原理的综合应用,注意盖斯定律的应用、化学平衡常数以及利用三段式来计算转化率等内容的熟练掌握是解答关键。
10.实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。
(1)“酸浸”时保持H2SO4过量的目的是___________。
(2)已知:Mn2+开始沉淀的pH=8.1。
①写出加入KMnO4溶液除铁的离子方程式:___________。
②流程中调节pH=5.4所加试剂X为____(填化学式);试剂X、KMnO4溶液加入顺序能否互换?请判断并说明理由_____。
(3)上述流程中滤渣的成分为___________(写化学式);“滤液”可以用作化肥,该滤液的主要成分为___________(填化学式)。
(4)检验Zn2(OH)2CO3是否洗涤干净的方法是___________。
(5)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为______。
【答案】 (1). 提高矿石的浸出率(或防止Zn2+、Fe2+、Cu2+等金属离子水解) (2). 3Fe2++MnO4-+7H2O=3Fe(OH)3↓+MnO2↓+5H+ (3). ZnO(或答碱式碳酸锌、碳酸锌、氢氧化锌、氨水等) (4). 不能,强酸性条件下KMnO4被还原成Mn2+,在除去Mn2+时,会使Zn2+同时沉淀 (5). Cu和Zn (6). (NH4)2SO4 (7). 取最后一次洗涤液,向其中加入硝酸酸化的硝酸钡溶液,若无沉淀生成,说明沉淀洗涤干净 (8). Zn2(OH)2CO3+2H2S=2ZnS↓+CO2↑+3H2O
【解析】
【分析】
向氧化锌矿粉(主要含ZnO、FeCO3、CuO等)加入50%~60%硫酸酸浸,氧化锌矿粉溶解,得到溶液中含有Zn2+、Fe2+、Cu2+等金属离子,加入ZnO等调节溶液pH=5.4,然后加入高锰酸钾溶液发生氧化还原反应生成Fe(OH)3沉淀和MnO2沉淀,除铁后在滤液中加入过量Zn,除去铜,加入碳酸铵调节溶液pH6.0~6.5,生成Zn2(OH)2CO3。
【详解】(1)“酸浸”时保持H2SO4过量,可使固体充分溶解,且防止Zn2+、Fe2+、Cu2+等金属离子水解,故答案为:提高矿石的浸出率(或防止Zn2+、Fe2+、Cu2+等金属离子水解);
(2)①由流程图可知,加入高锰酸钾溶液除铁时,Fe元素以氢氧化铁的形式除去,同时生成二氧化锰沉淀,则除铁的离子方程式是3Fe2++MnO4-+7H2O=3Fe(OH)3↓+MnO2↓+5H+,故答案为:3Fe2++MnO4-+7H2O=3Fe(OH)3↓+MnO2↓+5H+;
②向酸浸溶液中加入X调节溶液pH=5.4,目的是中和过量的硫酸调节溶液的pH又不能引入新的杂质,所以X只能是ZnO或碱式碳酸锌、碳酸锌、氢氧化锌等;试剂X与高锰酸钾不能互换,因为在酸性条件下,高锰酸根离子被还原为锰离子,而锰离子沉淀时的pH=8.1>5.4,此时Zn2+也会沉淀,所以不能互换,故答案为:ZnO(或答碱式碳酸锌、碳酸锌、氢氧化锌、氨水等);不能,强酸性条件下KMnO4被还原成Mn2+,在除去Mn2+时,会使Zn2+同时沉淀;
(3)向除铁的滤液中加入过量Zn,用锌还原出铜离子,除去铜,过滤得滤渣为铜和过量的锌;加入碳酸铵调节pH6.0~6.5,可生成Zn2(OH)2CO3,同时生成(NH4)2SO4,(NH4)2SO4可用作化肥,故答案为:Cu和Zn;(NH4)2SO4;
(4)Zn2(OH)2CO3沉淀表面附有可溶性的(NH4)2SO4杂质,检验Zn2(OH)2CO3是否洗涤干净实际上就是检验洗涤液中不含有硫酸根,具体操作是取最后一次洗涤液,向其中加入硝酸酸化的硝酸钡溶液,若无沉淀生成,说明沉淀洗涤干净,故答案为:取最后一次洗涤液,向其中加入硝酸酸化的硝酸钡溶液,若无沉淀生成,说明沉淀洗涤干净;
(5)碱式碳酸锌吸收硫化氢后得到ZnS沉淀,同时又二氧化碳、水生成,过滤后可达到除硫的目的,反应的化学方程式为Zn2(OH)2CO3+2H2S=2ZnS↓+CO2↑+3H2O,故答案为:Zn2(OH)2CO3+2H2S=2ZnS↓+CO2↑+3H2O。
【点睛】本题是化学工艺流程,侧重于分析、实验能力的考查,注意依据流程图中涉及的化学知识、化学原理来分析问题,运用相关知识,采用分析、综合的方法,解决简单化学问题是解答关键。
(二)选考题:共45分。请考生分别从给出的2道物理题、2道化学题、2道生物题中各选一题作答,并用2B铅笔在答题卡上把所选题目题号后的方框涂黑。注意所选题目的题号必须与所涂题目的题号一致,在答题卡选答区域指定位置答题。如果多做,则每学科按所做的第一题计分。
11.I.K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH(未配平)
(1)基态Cr原子的价电子轨道表达式为_________。
(2)甘氨酸的结构简式为NH2CH2COOH,该分子中所含元素的第一电离能由大到小的顺序为___________,碳原子的轨道杂化类型为_______。
(3)已知Cr3+等过渡元素水合离子的颜色如下表所示:
离子
Sr3+
Cr3+
Fe2+
Zn2+
水合离子的颜色
无色
绿色
浅绿色
无色
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为___________。
Ⅱ.ZnCl2浓溶液常用于除去金属表面的氧化物,如与FeO反应可得 Fe[Zn(OH)Cl2]2溶液。
(4) Fe[Zn(OH)Cl2]2的水溶液中不存在的微粒间作用力有________(填选项字母)。
A 离子键 B 共价键 C 金属键 D 配位键 E 范德华力 F 氢键
Ⅲ.某微粒的球棍模型如下图所示。
(5)已知含有1个碳原子和3个氢原子,请写出该微粒的化学式:_____。
Ⅳ.铜与氧元素形成的晶胞如下图所示:
(6)晶胞中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为___________,已知该晶体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数为___________cm(列出计算式即可)。
【答案】 (1). (2). N>O>H>C (3). sp3和sp2 (4). 没有未成对电子(d轨道上电子为全空或全充满) (5). AC (6). CH3— (7). (,,) (8).
【解析】
【详解】(1)Cr元素位于周期表第四周期ⅥB族,原子核外电子数为24,核外电子排布式为1s22s22p63s23p63d54s1,价电子轨道表达式为,故答案为:;
(2)甘氨酸的结构简式为NH2CH2COOH,该分子中所含的元素有H、C、N和O,同周期元素从左到右,元素第一电离能逐渐增大,但N原子的2p能级含有3个电子,为半满稳定状态,第一电离能较相邻元素高,则第一电离能的大小顺序为N>O>H>C;NH2CH2COOH分子中含有饱和碳原子和羧基不饱和碳原子,饱和碳原子为sp3杂化,羧基不饱和碳原子为sp2杂化,故答案为:N>O>H>C;sp3和sp2;
(3)Sc3+的电子排布式为1s22s22p63s23p63d,Cr3+的电子排布式为1s22s22p63s23p63d5,Fe2+的电子排布式为1s22s22p63s23p63d6,Zn2+的电子排布式为1s22s22p63s23p63d10
,由电子排布式可知水合离子的颜色与d轨道未成对电子有关,没有未成对电子,即d轨道上电子为全空或全充满的Sc3+、Zn2+的水合离子为无色,故答案为:没有未成对电子(d轨道上电子为全空或全充满);
(4) Fe[Zn(OH)Cl2]2的水溶液中存在的微粒有Fe2+、[Zn(OH)Cl2]—和H2O,[Zn(OH)Cl2]—离子中存在配位键和氢氧共价键,H2O分子中存在氢氧共价键,H2O分子间存在范德华力和氢键,不存在离子键和金属键,故答案为:AC;
(5)由球棍模型可知,该微粒为三角锥形,说明C原子的价层电子对数为4,孤对电子数为3,则化学式为CH3—,故答案为:CH3—;
(6)由晶胞示意图可知,位于顶点的a和体心的b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),d位于体对角线的处,则d的坐标参数为(,,);晶胞中Cu原子的个数为4,O原子的个数为8×+1=2,则化学式为Cu2O,Cu2O的摩尔质量为144g/mol,设晶胞的参数为a,晶胞的质量为a3ρ=,则a=cm,故答案为:(,,);。
【点睛】本题考查物质结构与性质,侧重于考查学生对所学知识的综合应用能力,注意原子核外电子排布规律、化学键、杂化类型以及晶胞计算的方法是解答关键。
12.具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:
已知:i.RCH2Br
ii.
iii.(以上R,,代表氢,烷基或芳基等)
(1)A属于芳香烃,其名称是___________。
(2)B的结构简式是___________。
(3)C生成D的化学方程式是___________
(4)由G生成H的反应类型是___________,试剂b是___________。
(5)下列说法正确的是______(选填字母序号)。
a.G存在顺反异构体
b.由G生成H的反应是加成反应
c.1molG最多可以与1molH2发生加成反应
d.1molF或1molH与足量NaOH溶液反应,均消耗2 mol NaOH
(6)E有多种同分异构体,其中属于芳香族化合物,并既能发生加聚反应又能发生水解反应的有_____种(不考虑立体异构)。
(7)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成,写出合成路(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。______
【答案】 (1). 1,2-二甲苯(邻二甲苯) (2). (3). +CH3OH+H2O (4). 加成反应 (5). 氢氧化钠醇溶液 (6). bd (7). 7 (8).
【解析】
【分析】
由C的结构简式为逆推可知,与溴在光照条件下发生取代反应生成,则B为;一个侧链发生氧化反应生成,则A为;由流程各物质转化可知,与CH3OH在浓硫酸作用下,共热发生酯化反应生成,则D为;发生信息i反应生成,则E为;发生信息ii反应生成,则F为;由H的结构简式和信息iii可知G为。
【详解】(1)芳香烃是指含有苯环的碳氢化合物,A的结构简式为,名称为1,2-二甲苯(邻二甲苯),故答案为:1,2-二甲苯(邻二甲苯);
(2)与溴在光照条件下发生取代反应生成,则B的结构简式为,故答案为:;
(3)C生成D反应为,与CH3OH在浓硫酸作用下,共热发生酯化反应生成
,反应的化学方程式为+CH3OH+H2O,故答案为:+CH3OH+H2O;
(4)由G生成H的反应为2分子发生加成反应生成;在氢氧化钠醇溶液加热条件下发生消去反应生成,则b为氢氧化钠醇溶液,故答案为:加成反应;氢氧化钠醇溶液;
(5) a、顺反异构体形成的条件是碳碳双键上碳原子都连接两个不同的原子或原子团,由G的结构简式可知双键的一个碳原子连接2个氢原子,故错误;
b、由G生成H的反应为2分子发生加成反应生成,故正确;
c、含有的苯环和碳碳双键均能与氢气发生加成反应,则1molG最多能与4 mol H2发生加成反应,故错误;
d、F的结构简式为,其中酯基和碘原子均可与NaOH发生反应,则1 mol 的
F最多可与2 molNaOH反应,H的结构简式为,分子中含有两个酯基,1mol的H与NaOH发生水解反应最多可消耗2 molNaOH,故正确;
bd正确,故答案为:bd;
(6)E的同分异构体属于芳香族化合物说明含有苯环,能发生加聚反应说明含有碳碳双键,能发生水解反应说明含有酯基,苯环上有1个侧链,侧链可能为CH2=CHCOO—、CH2=CHOOC—、—CH=CHOOCH和,含有2个侧链,侧链可能为CH2=CH—和HCOO—,在苯环上有邻、间、对3中结构,则共有7种同分异构体,故答案为:7;
(7)由合成物质的结构简式,运用逆推法可知,一定条件下,乙烯与水发生加成反应生成乙醇,与溴化氢发生加成反应生成溴乙烷,在铜做催化剂作用下,乙醇发生催化氧化反应生成乙醛,乙醛与溴乙烷发生信息i反应生成CH3CH=CHCH3,CH3CH=CHCH3发生信息iii反应生成,合成路线如下: ,故答案为:。
【点睛】本题考查有机物推断与合成,对比物质的结构明确发生的反应,侧重对有机化学基础知识和逻辑思维能力考查,有利于培养自学能力和知识的迁移能力,需要熟练掌握官能团的结构、性质及相互转化。