- 2021-08-06 发布 |
- 37.5 KB |
- 4页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
西航一中2008~2009学年第二学期模块考试试题正式稿
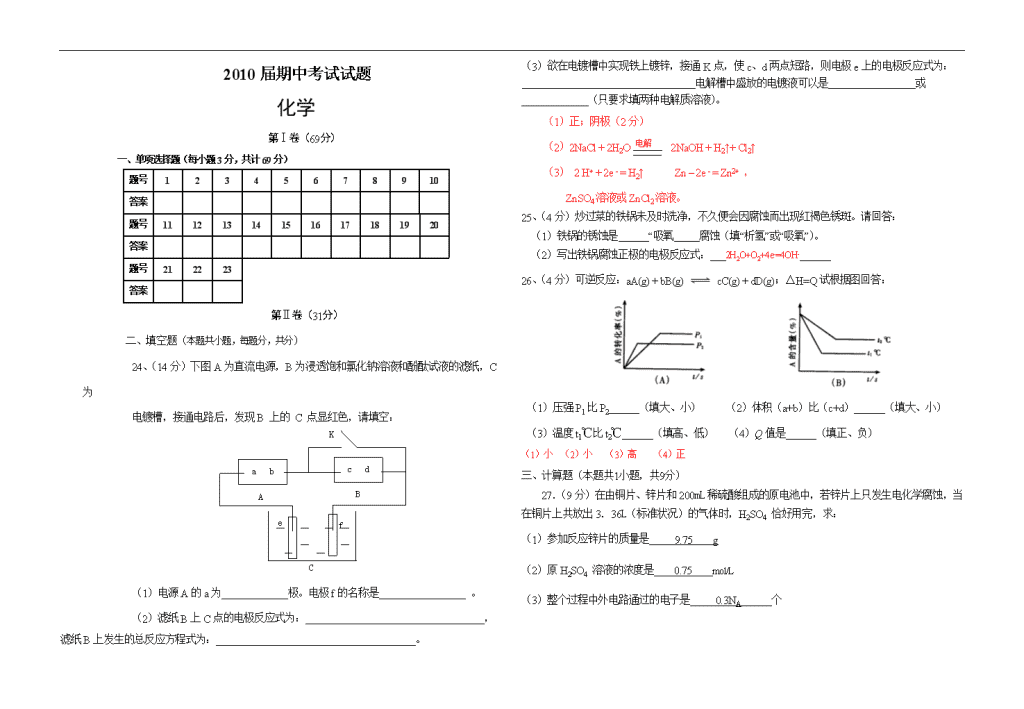
★启用前绝密★ 西航一中2008~2009学年第二学期 2010届模块考试试题 化学 命题人:高二化学备课组 校对人:高二化学备课组 2009年5月 注意事项: 1.答卷前,考生务必将本人的班级、姓名、学号、填在答题纸的指定位置。 2.将第Ⅰ卷上每小题所选答案填写在答题纸首端相应的位置上。在第Ⅰ卷上答题无效。 3.全卷100分,考试时间100分钟。 4.考试结束,请将答题纸交给监考老师。 可能用到的原子量:H-1, C-12, N-14, P-31, O-16, S-32, Mg-24, Al-27, K-39, Fe-56, Cu-64, Zn-65, 第Ⅰ卷(69分) 一、选择题(本题包括23小题,每小题3分,共69分,每小题只有一个正确答案) 1、在一个容积为2L的密闭容器中,发生如下反应:3A+B=2C (A、B、C均为气体)。若最初加入的A、B都是4mol,A的平均反应速率为0.12mol/L·s,则10s后容器中B的物质的量是: A.3.6mol B.3.2mol C.2.8mol D.1.6mol 2、一定条件下反应A2(g)+B2(g)2AB(g)达到平衡状态的标志是: A.υ(正、A2)= υ(逆、AB) B.容器内的总压强不随时间而变化 C.单位时间内生成2n mol AB的同时,生成n mol的B2 D.A2、B2、AB的反应速率比为2:2:1的状态 3、已知25℃时,下列酸的电离常数: 醋酸:1.75×10-5 氢氰酸:4.93×10-10 氢氟酸:7.2×10-4 甲酸:1.77×10-4 则物质的量浓度均为0.1mol·L-1的上述溶液酸性最强的是: A. 醋酸 B.氢氰酸 C.氢氟酸 D.甲酸 4、钢铁发生吸氧腐蚀时,正极上发生的电极反应是: A.2H+ +2e- = H2↑ B.Fe2+ + 2e- = Fe C.2H2O + O2 + 4e- = 4OH- D.Fe3+ + e- = Fe2+ 5、下列各变化中属于原电池反应的是: A.在空气中金属铝表面迅速氧化形成保护层 B.镀锌铁表面有划损时,也能阻止铁被氧化而生锈 C.红热的铁丝与冷水接触,表面形成蓝黑色保护层 D.浓硝酸比稀硝酸更能氧化金属铜 500℃ υ(正) υ υ(逆) 压强P ω(C) 100℃ 时间t 有催化剂 无催化剂 时间t c(C) A的转化率 100℃ 10℃ 压强P 6、对于可逆反应:2A(g)+B(g)2C(g) △H<0,下列各图正确的是: A. B. C. D. 7、A、B、C是三种金属,根据下列 ①、② 两个实验: ①将A与B浸在稀硫酸中用导线相连,A上有气泡逸出,B逐渐溶解;②电解物质的量浓度 相同的A、C混合盐溶液时,阴极上先析出C(使用惰性电极)。确定它们的还原性强弱顺序为: A.A>B>C B.B>C>A C.C>A>B D.B>A>C 8、不能用于判断HA是弱电解质(弱酸)的依据是: A.浓度相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多。 B.pH相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多。 C.浓度相等的HCl与HA两溶液,C(HCl中H+)约是C(HA中H+)的100倍。 D.pH相等的HCl与HA两溶液,C(HA)约是C(HCl)的100倍。 9、用石墨作电极电解CuCl2溶液,当通电一段时间后,阳极收集到2.24 L气体(标准状况)。下列有关说法正确的是: A.阴极生成的铜为5.6g B.上述电解过程中共转移0.2 mol电子 C.电解得到的Cu的物质的量为0.5mol D.电解后溶液呈碱性 10、物质的量浓度相同的下列溶液中,符合pH由小到大顺序排列的是: A.Na2CO3 NaHCO3 NaCl NH4Cl B.NaHCO3 Na2CO3 NH4Cl NaCl C.NH4Cl H2SO4 Na2S NaNO3 D.(NH4)2SO4 NH4Cl NaHCO3 Na2CO3 11、下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是: A.a电极是负极 B.b电极的电极反应为:O2+ 2H2O + 4 e-= 4OH- C.电池工作时,电子由正极通过外电路流向负极 D.氢氧燃料电池是一种具有应用前景的绿色电源 12、下列说法正确的是: A.物质的溶解性为难溶,则该物质不溶于水 B.不溶于水的物质溶解度为0 C.绝对不溶解的物质是不存在的 D.某离子被沉淀完全是指该离子在溶液中的浓度为0 13、对于任何一个平衡体系,采用以下措施一定会使平衡移动的是: A.加入一种反应物 B.升高温度 C.对平衡体系增加压强 D.使用催化剂 14、随着人们生活质量的不断提高,废电池必须集中处理的问题被提到议事日程,首要原因是: A.利用电池外壳的金属材料 B.回收其中石墨电极 C.不使电池中渗泄的电解液腐蚀其他物品 D.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 15、下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是: A.(1)(3)(2)(4) B.(4)(2)(1)(3) C.(3)(2)(1)(4) D.(4)(1)(2)(3) 16、已知:C(s)+CO2(g)2CO(g) DH>0,该反应达到平衡后,下列条件有利于反应向正方向 进行的是: A.升高温度和减小压强 B.降低温度和减小压强 C.降低温度和增大压强 D.升高温度和增大压强 17、下列物质中,属于强电解质的是: A.CO2 B.CH3COOH C.NH3·H2O D.NaOH 18、在医院中,为酸中毒病人输液不应采用: A.0.9%氯化铵溶液 B.0.9%氯化钠溶液 C.1.25%碳酸氢钠溶液 D.5%葡萄糖溶液 19、下列有关金属腐蚀的说法中正确的是: ①金属的腐蚀全部是氧化还原反应 ②金属的腐蚀可分为化学腐蚀和电化腐蚀,只有电化腐蚀才是氧化还原反应,③因为二氧化碳普遍存在,所以钢铁的电化腐蚀以析氢腐蚀为主。④无论是析氢腐蚀还是吸氧腐蚀,总是金属被氧化。 A.①③ B.②③ C.①④ D.①③④ 19、为了保护地下钢管不受腐蚀,可使它与: A.直流电源负极相连 B.铜板相连 C.锡板相连 D.直流电源正极相连 充电 放电 20、镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行: Cd (OH)2+2Ni (OH)2 Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是: A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH) 21、已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁 标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是: A.充电时作阳极,放电时作负极 B.充电时作阳极,放电时作正极 C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极 22、有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合 金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电 时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是: A.Y>Z>W>X B.Z>Y>W>X C.W>Z>Y>X D.X>Y>Z>W 23、下面有关电化学的图示,完全正确的是:D ★启用前绝密★ 西航一中2008~2009学年第二学期 2010届期中考试试题 化学 第Ⅰ卷(69分) 一、单项选择题(每小题3分,共计69分) 题号 1 2 3 4 5 6 7 8 9 10 答案 题号 11 12 13 14 15 16 17 18 19 20 答案 题号 21 22 23 答案 第Ⅱ卷(31分) 二、填空题(本题共小题,每题分,共分) 24、(14分)下图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为 C f K a b A c d B e 电镀槽,接通电路后,发现B 上的 C 点显红色,请填空: (1)电源A的a为 极。电极f的名称是 。 (2)滤纸B上C点的电极反应式为: , 滤纸B上发生的总反应方程式为: 。 (3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上的电极反应式为: 电解槽中盛放的电镀液可以是 或 (只要求填两种电解质溶液)。 (1)正;阴极(2分) 电解 (2)2NaCl + 2H2O 2NaOH + H2↑+ Cl2↑ (3) 2 H+ + 2e - = H2↑ Zn – 2e - = Zn2+ , ZnSO4溶液或ZnCl2溶液。 25、(4分)炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答: (1)铁锅的锈蚀是 “吸氧 腐蚀(填“析氢”或“吸氧”)。 (2)写出铁锅腐蚀正极的电极反应式: 2H2O+O2+4e-=4OH- 26、(4分)可逆反应:aA(g) + bB(g) cC(g) + dD(g);△H=Q试根据图回答: (1)压强P1比P2______(填大、小) (2)体积(a+b)比(c+d)______(填大、小) (3)温度t1℃比t2℃______(填高、低) (4)Q值是______(填正、负) (1)小 (2)小 (3)高 (4)正 三、计算题(本题共1小题,共9分) 27.(9分)在由铜片、锌片和200mL稀硫酸组成的原电池中,若锌片上只发生电化学腐蚀,当在铜片上共放出3.36L(标准状况)的气体时,H2SO4 恰好用完,求: (1)参加反应锌片的质量是 9.75 g (2)原H2SO4 溶液的浓度是 0.75 mol/L (3)整个过程中外电路通过的电子是 0.3NA 个查看更多