- 2021-08-06 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河南省信阳市第一高级中学2018-2019学年高二上学期10月月考化学试卷+Word版含答案
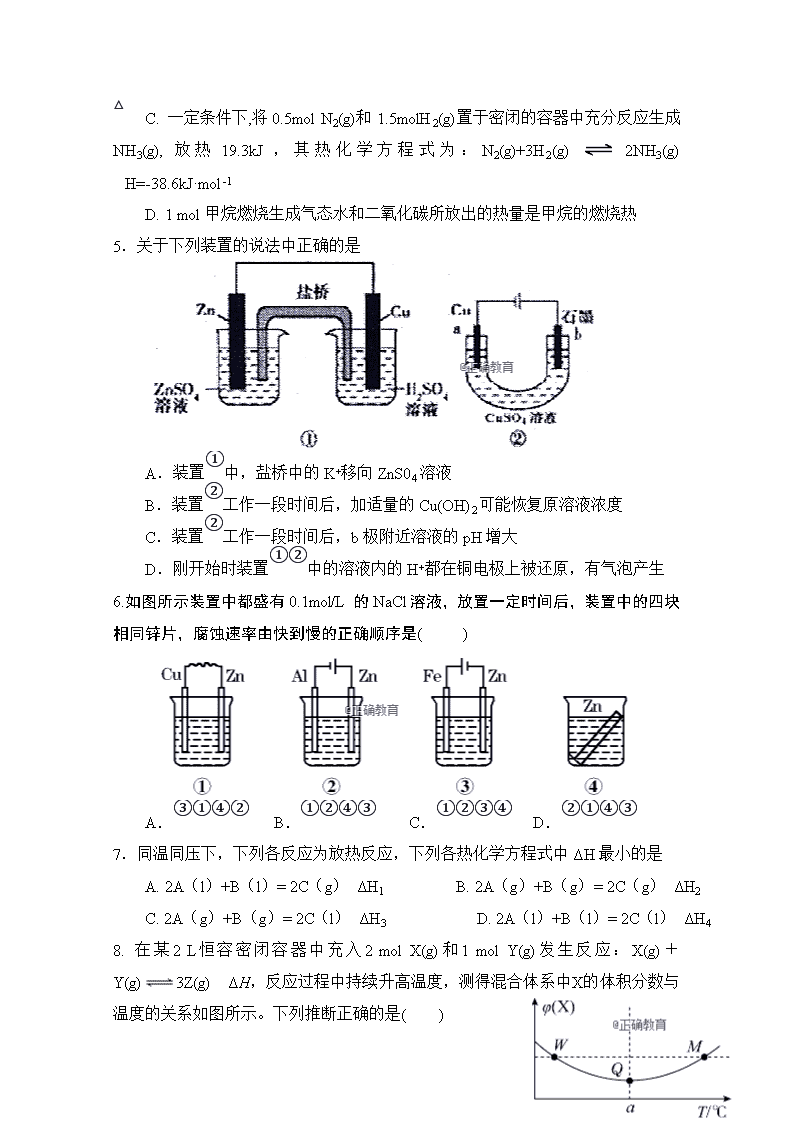
2018—2019学年上期第一次月考 高二化学试题 可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 S:32 Cl:35.5 K:39 Cu:64 一、 选择题(每题只有一个答案,每小题3分,共计48分): 1. 下列说法正确的是( ) A. 有气体参加的化学反应,若增大压强(缩小反应容器的容积),可增大活化分子的百分数,从而使反应速率增大。 B. 凡是焓变小于零的反应都能自发进行。 C. 对于常温下浓度相同的两种弱酸HA和HB,电离常数大的酸溶液的酸性强,电离常数小的酸溶液的酸性弱。 D. 强电解质溶液的导电能力一定比弱电解质溶液的强 2. 下列溶液一定呈中性的是( ) A. PH=7的溶液 B. 非电解质溶于水形成的溶液 C. C(H+)=C(OH-)=10-6 mol/L 的溶液 D. 酸和碱恰好完全反应生成的正盐溶液 3.下列不能用勒夏特列原理解释的事实是( ) A. 棕红色的NO2加压后颜色先变深后变浅(2NO2N2O4) B. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 C. 黄绿色的氯水光照后颜色变浅 D. 合成氨工业使用高压以提高氨的产量 4.下列关于热化学反应的描述中正确的是( ) A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的反应热为ΔH=2×(-57.3)kJ·mol-1 B. CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)2CO(g)+O2(g) ΔH=+566 kJ·mol-1 C. 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·mol-1 D. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 5.关于下列装置的说法中正确的是 A.装置①中,盐桥中的K+移向ZnS04溶液 B.装置②工作一段时间后,加适量的Cu(OH)2可能恢复原溶液浓度 C.装置②工作一段时间后,b极附近溶液的pH增大 D.刚开始时装置①②中的溶液内的H+都在铜电极上被还原,有气泡产生 6.如图所示装置中都盛有0.1mol/L的NaCl溶液,放置一定时间后,装置中的四块相同锌片,腐蚀速率由快到慢的正确顺序是( ) A.③①④② B.①②④③ C.①②③④ D.②①④③ 7.同温同压下,下列各反应为放热反应,下列各热化学方程式中ΔH最小的是 A. 2A(l)+B(l)= 2C(g) ΔH1 B. 2A(g)+B(g)= 2C(g) ΔH2 C. 2A(g)+B(g)= 2C(l) ΔH3 D. 2A(l)+B(l)= 2C(l) ΔH4 8. 在某2 L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:X(g)+Y(g)3Z(g) ΔH,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( ) A.M点时,Y的转化率最大 B.升高温度,平衡常数减小 C.平衡后充入Z达到新平衡时Z的体积分数增大 D.W、M 两点Y的正反应速率相等 9.用石墨作电极,电解下列溶液,阴、阳两极均产生气体,其体积比为2:1,且电解后溶液的pH减小的是( ) A.KCl B.NaOH C.Na2SO4 D.H2SO 10.常温下,向0.1 mol·L-1CH3COOH溶液中不断加水,过程中始终保持增大的是( ) A.c(H+) B.Ka(CH3COOH) C.c(H+) ·c(OH-) D.c(H+)/c(CH3COOH) 11.金属镍有广泛的用途。粗镍中含有少量的Fe、Zn、Cu、Pt等杂质,用电解法制备高纯度的镍,(已知:氧化性Fe2+<Ni2+<Cu2+)。下列叙述中正确的是( ) A.阳极发生还原反应,其电极反应式:Ni2++2e-===Ni B.电解过程中,阳极减少的质量与阴极增加的质量相等 C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ D.电解后,电解槽底部的阳极泥中只有Cu和Pt 12.某温度下,在2 L的密闭容器中,加入1 mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g) 3Z(g)平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( ) A.m=2 B.两次平衡的平衡常数相同 C.X与Y的平衡转化率之比为1∶1 D.第二次平衡时,Z的浓度为0.4 mol·L-1 13.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) COS(g)+H2(g) K=0.1反应前CO物质的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是 ( ) A.升高温度,H2S浓度增加,表明该反应是吸热反应 B.通入CO后,正反应速率逐渐增大 C.反应前H2S物质的量为7 mol D.CO的平衡转化率为80% 14. 对于可逆反应:2A(g)+B(g)2C(g) ΔH<0,下列各图正确的是( ) A. A B. B C. C D. D 15.现有pH=3的醋酸和pH=3的硫酸两种溶液,下列有关这两种溶液的叙述正确的是( ). A.两溶液中水电离出的c(H+)=1×10-11mol/L B.加水稀释100倍后两溶液pH仍相同 C.醋醋中c(CH3COO-)与硫酸中的c(SO₄²¯)相同 D.两溶液中分别加入足量锌片放出H2体积相同 16.在1100 ℃时,一定容积的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH=a kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( ) A.达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.026 3 mol/L B.若要提高CO的转化率,则可以加入过量FeO C.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 D.若生成56 g Fe,则吸收的热量小于a kJ 一、 非选择题(共52分): 17.(6分)T1℃时,向2.0L恒容密闭容器中充入1.0 mol PCl5,发生反应PCl5(g)PCl3(g)+Cl2(g),经一段时间后达到平衡状态。建立平衡过程中时间t与PCl3物质的量的关系如表所示。若升高温度至T2℃,混合气体黄绿色加深。 t/s 0 50 150 250 350 n(PCl3)/ mol 0 0.16 0.19 0.20 0.20 (1)该反应△H 0(填“>”、“<”或“=”),T1℃时反应在前50 s的平均速率 v(PCl3)= ,平衡常数K= (2)下列可用于判断反应达到平衡状态的依据是( ) A.容器中气体压强不再变化 B.容器中气体的密度不再变化 C.容器中气体平均摩尔质量不再变化 D.每生成3molP─Cl键同时生成1molCl─Cl键 (3)T1℃时反应达到平衡后,再向容器中充入0.9mol PCl5、0.1molPCl3和0.1molCl2,再次达到平衡前v(正) v(逆)(填“>”、“<”或“=”),平衡后PCl5体积分数 (填“增大”、“减小”或“不变”)。 18.(17分 ) I.(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式: . (2)2Zn(s)+O2(g)=2ZnO(s)△H1=﹣702kJ/mol 2Hg(l)+O2(g)=2HgO(s)△H2=﹣182kJ/mol 由此可知ZnO(s)+Hg(l)=Zn(s)+HgO(s)△H3= . (3)已知 2SO2(g)+O2(g)=2SO3(g)△H反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3放出99kJ的热量,请回答下列问题: ①图中A分别表示 (标识具体的物质及用量) ②E的大小对该反应的反应热 (填“有”或“无”)影响. 该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”“降低”) II.向体积为2 L的固定密闭容器中通入3 mol X气体,在一定温度下发生如下反应: 2X(g) Y(g)+3Z(g) (1)经5 min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y表示的速率为________ (2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为甲:v(X)=3.5 mol•L-1•min-1;乙:v(Y)=2 mol•L-1•min-1;丙:v(Z)=4.5 mol•L-1•min-1;丁:v(X)=0.075 mol•L-1•s-1。若其他条件相同,温度不同,则温度由高到低的顺序是(填序号)________。 (3)若向达到(1)的平衡体系中充入氦气,则平衡______(填“向左”、“向右”或“不”)移动;若从达到(1)的平衡体系中移走部分Y气体,则平衡________(填“向左”、“向右”或“不”)移动。 (4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5 mol X气体,则平衡后X的转化率与(1)的平衡中X的转化率相比较( ) A.无法确定 B.前者一定大于后者 C.前者一定等于后者 D.前者一定小于后者 (5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时仍与(1)的平衡等效,则:a、b、c应该满足的关系为____________________。 (6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为_______________。 III. 灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿,现把白锡制成的器皿放在0 ℃(273K)、100 kPa的室内存放,它 (填写“会”或“不会”)变成灰锡而不能再继续使用,试说明理由: (已知:在0 ℃、100 kPa条件下白锡转化为灰锡的反应焓变和熵变分别为ΔH=-2 180.9 J·mol-1,ΔS=-6.61 J·mol-1·K-1。) 19.(6分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示: t ℃ 700 800 830 1 000 1 200 K 0.6 0.9 1.0 1.7 2.6 回答下列问题: (1)该反应化学平衡常数表达式为K=_____________________________。 (2)该反应为________反应(填“吸热”或“放热”)。 (3)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______。 (4)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K______1.0(填“大于”“小于”或“等于”)。 (5)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____________移动(填“向正反应方向”“向逆反应方向”或“不”)。 (6)若1200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为__________(填“正反应方向”“逆反应方向”或“不移动”)。 20.(12分)铅酸蓄电池是常见的化学电源,其电极材料分别是Pb和PbO2,电解质溶液为一定浓度的硫酸。充放电的总反应是: Pb+PbO2+2H2SO42PbSO4+2H2O (1)该蓄电池放电工作时电解质溶液中SO42-移向 (填“正极”或“负极”,下同)充电时,该极接直流电源的 。 (2)Cu2O是一种半导体材料,可通过右图的电解装置 制取,电解总反应为:2Cu+H2O==== Cu2O+H2↑ 阴极的电极反应式是 ,阳极的电极反应式是 。 若用铅酸蓄电池作为电源进行电解,当蓄电池中有0.2mol H+被消耗时,Cu2O的理论产量为 g。 (3)为防止钢闸门在水中被腐蚀,可将其与铅酸蓄电池的 极相连(填Pb或PbO2)。 (4)用铅蓄电池电解500mL饱和食盐水(足量)。电解一段时间后,共收集到气体1120mL(已折算成标准状况下),则所得溶液的pH= (不考虑气体的溶解及电解前后溶液体积的变化) 21.(11分)下面a~e是中学化学实验中常见的几种定量仪器: (a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计 (1)无“0”刻度的是 (填编号)。 (2)下列操作合理的是 (填字母) A.用25mL碱式滴定管量取20.00mLNaHCO3 B.用托盘天平准确称量10.20克碳酸钠固体 C.用100mL量筒量取3.2mL浓硫酸 D.配制1 mol·L–1的氢氧化钠溶液475mL选用500mL容量瓶 (3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如上图所示:则所用盐酸溶液的体积为 mL。 (4)某同学根据三次实验分别记录有关数据如下表: 滴定次数 待测氢氧化钠溶液的体积/ml 0.1000mol/L盐酸的体积/ml 滴定前刻度 滴定后刻度 溶液体积 第一次 25.00 0.00 26.11 26.11 第二次 25.00 1.56 30.30 28.74 第三次 25.00 0.22 26.31 26.09 ①取25.00ml待测液.该项实验操作使用的主要仪器有(除锥形瓶外) ,用酚酞作指示剂时,滴定到溶液颜色由 色刚好变成 色为止, ②请根据上表列出数据,计算氢氧化钠溶液物质的量浓度c(NaOH) = ③由于错误操作,使得所测氢氧化钠溶液的浓度偏高的是 ( )(填写编号) A. 中和滴定达终点时俯视滴定管内液面度数 B.碱式滴定管用蒸馏水洗净后立即取用25ml待测碱溶液注入锥形瓶进行滴定 C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定 D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定 月考答案 1.【答案】C B. 反应方向的判断由焓变与熵变结合判断,焓变小于零的反应不一定都能自发进行,B错误; C. 对于常温下 浓度相同的两种弱酸HA和HB,c(H+)=cα,电离常数大的酸溶液的酸性强,电离常数小的酸溶液的酸性弱,C错误; D. 导电能力的大小与溶液中离子浓度、离子所带电荷成正比,与电解质的强弱没有必然联系,D错误。 2.【答案】C 【解析】溶液呈中性,即c(H+)=c(OH—),C正确; A. 在常温下,PH=7的溶液为中性,纯水升高温度pH小于7但仍然为中性,A错误; B. 非电解质溶于水形成的溶液不一定呈中性,如酸性氧化物、碱性氧化物溶于水后分别呈酸性、碱性,B错误; D. 酸和碱恰好完全反应生成正盐,要考虑盐类的水解,若该为强碱弱酸盐,溶液呈碱性;D错误。 3.答案:B 4.答案:B 5.答案:B 6.答案:D 7.答案:C 8.答案:B 9.答案:D 10.答案:D 11.答案:D 12.答案:D 13.答案:C 14.答案:A 15.答案:A 16.答案:A 17. (1) > 0.0016mol/(L·s) (单位1分) 0.025 (2)AC (3) < 增大 18. I (1)CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-880kJ/mol (2)+260 kJ/mol (3)①反应物总能量 ②无(1分) 降低(1分) II(1)0.03mol/(L.min) (2)丁>乙>甲>丙 (3)不(1分) 向右(1分) (4)D (5)c=3b,a≥0 (6)0.9<c≤4.5 III会(1分),ΔH-TΔS=-2 180.9 J·mol-1×10-3-273 K×(-6.61 J·mol-1·K-1)×10-3≈-0.38 kJ·mol-1<0,能自发进行。 19. (1) (2)吸热 (3)700 ℃ (4)等于 (5)不 (6)逆反应方向 20.(1)负极(1分) 负极(1分) (2)2H++2e-=H2↑ 略 7.2 (3) Pb (4) 13 21. (1) ab (2)A (3)26.10 (2) ① 碱式滴定管 红 无 ② 0.1044 mol/l ③CD 查看更多