2019-2020学年江苏省南京师大苏州实验学校高二9月月考化学试题 Word版
2019~2020学年度第一学期9月阶段测试
高二化学试卷
本试卷分试题卷和答题卡两部分。试题卷包括1至6页;答题卡1至2页。满分100分。考试时间90分钟。
第I卷(选择题,共45分)
一、单项选择题(本项共12题,每题2分,24分。每题只有1个选项正确)
1.下列关于溶液的酸碱性,说法正确的是( )
A.pH=7的溶液呈中性 B.中性溶液中一定有:c(H+)=1.0×10-7 mol·L-1
C.c(H+)=c(OH-)的溶液呈中性 D.在100°C时,纯水的pH<7,因此显酸性
2.已知常温下,0.01 mol/L CH3COOH溶液中c(H+)=4.32×10-4 mol/L,则该CH3COOH溶液中水的离子积常数为( )
A.<1×10-14 B.>1×10-14 C.=1×10-14 D.无法确定
3.已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01 mol·L-1的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性。下列对高碘酸和碘酸的酸性强弱判断正确的是( )
A.高碘酸和碘酸都是强酸 B.高碘酸和碘酸都是弱酸
C.高碘酸是弱酸,碘酸是强酸 D.高碘酸是强酸,碘酸是弱酸
4.95 ℃时,水中H+的物质的量浓度为1×10-6mol·L-1,若把0.01 mol的NaOH固体溶解于95 ℃水中配成1 L溶液,则溶液的pH为( )
A.4 B.10 C.2 D.12
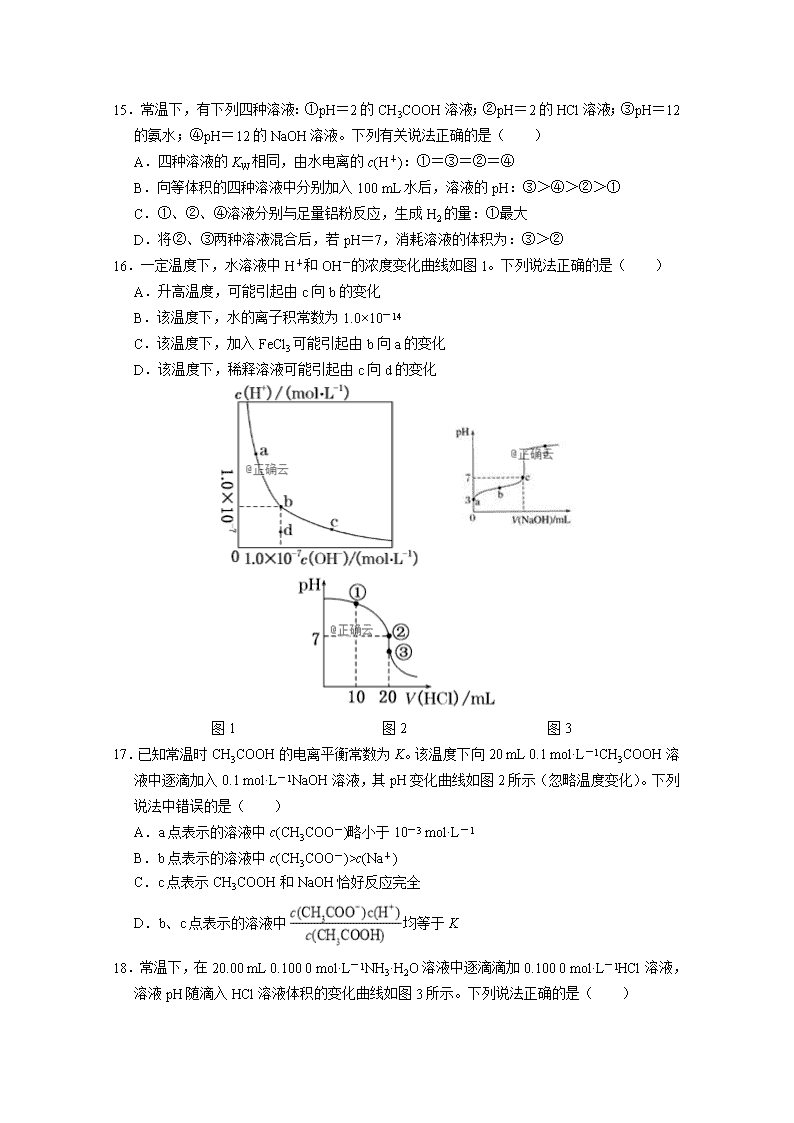
5.下列说法中正确的是( )
A.FeCl3溶于水使溶液呈酸性,从而抑制水的电离
B.(NH4)2SO4溶液中c(NH)∶c(SO)=2∶1
C.盐酸中滴加氨水至中性,溶液中溶质为氯化铵和氨水
D.将Al2(SO4)3溶液蒸干(不灼烧)得到Al(OH)3固体
6.取浓度相同的NaOH和HCl溶液,以3∶2的体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )
A.0.01 mol·L-1 B.0.017 mol·L-1 C.0.05 mol·L-1 D.0.50 mol·L-1
7.将浓度为0.1 mol·L-1 HF溶液加水不断稀释,下列各量始终保持增大的是( )
A.c(H+) B.Ka(HF) C.c(F-)/c(H+) D.c(H+)/c(HF)
8.对滴有酚酞试液的下列溶液,操作后颜色变深的是( )
A.明矾溶液加热 B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体 D.小苏打溶液中加入少量NaCl固体
9.25 ℃时,下列各组溶液等体积混合后,所得溶液的pH最大的是( )
A.pH=1的盐酸与pH=13的Ba(OH)2溶液
B.0.1 mol·L-1 H2SO4溶液与0.2 mol·L-1氨水
C.pH=1的CH3COOH溶液与pH=13的NaOH溶液
D.0.1 mol·L-1CH3COOH溶液与0.1 mol·L-1NaOH溶液
10.高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数如下表。则从表格中判断以下说明不正确的是( )
酸
HClO4
H2SO4
HCl
HNO3
Ka
1.6×10-5
6.3×10-9
1.6×10-9
4.2×10-10
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4===2H++SO
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱
11.相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则下列关于同温、同体积、同浓度的HCN和HClO的说法中正确的是( )
A.酸的强弱:HCN>HClO B.pH:HClO>HCN
C.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
D.酸根离子浓度:c(CN-)
c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、c点表示的溶液中均等于K
18.常温下,在20.00 mL 0.100 0 mol·L-1NH3·H2O溶液中逐滴滴加0.100 0 mol·L-1HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图3所示。下列说法正确的是( )
A.①溶液:c(Cl-)>c(NH)>c(OH-)>c(H+)
B.②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
C.①、②、③三点所示的溶液中水的电离程度②>③>①
D.滴定过程中不可能出现:c(NH3·H2O)>c(NH)>c(OH-)>c(Cl-)>c(H+)
19.已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1 的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.c(NH)/c(NH3·H2O)先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH)=c(CH3COO-)
第Ⅱ卷(非选择题,共55分)
三、非选择题(本题包括5小题,共55分)
20.(10分)常温下,a mL 0.1 mol/L的CH3COOH与b mL的0.1 mol/L NaOH混合,充分反应。
(1)写出反应的离子方程式______________________________________________。
(2)两溶液pH之和________14(填“<”、“=”或“>”)。
(3)若a=b,则反应后溶液中粒子(除水分子外)浓度从大到小的顺序是______________
________________________________________________________________。
(4)若混合后溶液呈中性,则a______b,反应后溶液中c(CH3COO-)________c(Na+)。(填“<”、“=”或“>”)
21.(10分)25 ℃时,0.1 mol·L-1的醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)上述两种解释中________(填“甲”或“乙”)正确。
(2)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。(已知25 ℃时,CH3COONH4溶液呈中性)
A.固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3
(3)若________(填“甲”或“乙”)的解释正确,溶液的pH应________(填“增大”、“减小”或“不变”)。
(4)常温下,将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液。判断:
①溶液中共有________种粒子。
②其中有两种粒子的物质的量之和一定等于0.010 mol,它们是___________和___________。
③溶液中n(CH3COO-)+n(OH-)-n(H+)=________mol。
22.(10分)25 ℃时,电离平衡常数:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
1.8×10-5
K1 4.3×10-7
K2 5.6×10-11
3.0×10-8
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是_____________;(填编号)
A.CO32- B.ClO- C.CH3COO- D.HCO3-
(2)下列反应不能发生的是 ;
A.CO32-+ CH3COOH=CH3COO-+CO2↑+H2O B.ClO-+ CH3COOH=CH3COO- +HClO
C.CO32-+ HClO=CO2↑+H2O+ClO- D.2ClO-+ CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是_________;
A.c(CH3COOH)/c(H+)
B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/KW
D.c(H+)/c(OH-)
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程pH变化如上图所示,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+)。(填“大于”、“等于”或“小于”)
23.(11分)某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00 mL于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2~3滴。
②取一只碱式滴定管依次用自来水、蒸馏水洗净,然后注入0.010 mol·L-1 Na2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3===2NaI+Na2S4O6。
试回答下列问题:
(1)步骤①加入的指示剂是________________。
(2)滴定时,眼睛应注视________________________,判断到达滴定终点的现象是________
________________________________________________________________,若耗去Na2S2O3溶液20.00 mL,则废水中Cl2的物质的量浓度为____________________________。
(3)实验中,Cl2的所测浓度比实际浓度偏大,造成误差的原因是_____________________
___________________________________________________。
(4)如图表示50.00 mL滴定管中液面的位置,若A与C刻度间相差1 mL,A处的刻度为25.00 mL,滴定管中液面读数应为________mL,设此时液体体积读数为a mL,滴定管中液体的体积V________(50-a) mL(填“<”、“=”或“>”)。
(5)滴定结束时俯视刻度线读取滴定终点时Na2S2O3溶液的体积,会导致测定结果________(填“偏大”、“偏小”或“不影响”)。
24.(14分)工业制备氯化铜时,将浓盐酸用蒸气加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤:
参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3。、
请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6,将Fe2+沉淀除去?________,理由是________________________________________________________________________。
(2)有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是________。(填序号)
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?_______,理由是___________________________。
③现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有________(多选)。
A.浓HNO3 B.KMnO4 C.Cl2 D.O2 E.H2O2
(3)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有________(多选)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3 E.CuO F.Cu(OH)2
2019~2020学年度第一学期9月阶段测试
高二化学答案
一、单项选择题(本项共12题,每题2分,24分。每题只有1个选项正确)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
C
C
C
B
C
C
D
B
D
C
D
D
二、不定项选择题(本项共7题,每题3分,21分。每题有1~2个选项正确)
题号
13
14
15
16
17
18
19
答案
D
C
AB
BC
C
B
D
三、非选择题(本题包括5小题,共55分)
20.(10分)(1)______CH3COOH+OH-===CH3COO-+H2O ②
(2)____>___(填“<”、“=”或“>”)。
(3)_____c(Na+)> c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+)_________。
(4)____>____,___=_____(填“<”、“=”或“>”)。
21.(10分)(1)_____乙________(填“甲”或“乙”)。
(2)_______B_________(填写编号)。
(3)____乙____(填“甲”或“乙”),___增大_____(填“增大”、“减小”或“不变”)。
(4)①_____7________。
②______ CH3COO-_________和______CH3COOH_________。
③____0.006____mol。
22.(10分)(1)______ABDC_______;(填编号)
(2)_______CD_______;
(3)______B________;
(4)__大于___(填“大于”、“等于”或“小于”),__大于_。(填“大于”、“等于”或“小于”)
23.(11分)(1)____淀粉溶液_____。
(2)__锥形瓶中溶液的颜色变化__,___锥形瓶中溶液的颜色由蓝色变浅红无色且保持30秒内不恢复____,___ 0.01 mol·L-1 ____。
(3)_因为步骤②滴定管用蒸馏水洗净后未用待测液润洗,故测出的c(Cl2)大于实际浓度_。
(4)_____24.40______mL,____>____(填“<”、“=”或“>”)。
(5)_____偏小_____(填“偏大”、“偏小”或“不影响”)。
24.(14分)(1)___不能_____,理由是_____因Fe2+沉淀的pH最大,Fe2+沉淀完全时,Cu2+、Fe3+也会沉淀完全_______。
(2)①______A_______。(填序号)
②____否___,理由是_________引入新杂质_________。
③__________CDE________(多选)。
(3)________CEF________(多选)。