2017-2018学年广西贵港市高二下学期期中教学质量监测试题化学试题 Word版
考生注意:
1.试卷分第Ⅰ卷(选择题) 和第Ⅱ卷(非选择题)两部分,共100 分,考试时间90 分钟
2.请将各题答案填在答题卡
3.本试卷主要考试内容: 人教版选修4
4.可能用到的相对原子质量: H-1 C-12 N-14 O-16 S-32 Cl-35.5
第Ⅰ卷(选择题共48分)
一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意)
1.下列措施不能达到节能减排目的的是
A.利用潮汐能发电 B.用节能灯代替白炽灯
C.火力发电解决电力紧张问题 D.利用太阳能制氢燃料
2.下列化合物中,属于弱电解质的是
A.HCl B.H2O C.Ba(OH)2 D.CH3COONa
3.下列变化过程是化学变化,且属于放热反应的是
①Ba(OH)2·8H2O ②酸碱中和 ③浓硫酸稀释 ④固体NaOH溶于水 ⑤硫在空气或氧气中燃烧
A.②③④⑤ B.②③④ C.②⑤ D.①③⑤
4.下列措施中,不能加快化学反应速率的是
A.将食物储存在冰箱里
B.往H2O2溶液中加入几滴FeCl3溶液
C.用粉末状碳酸钙代替块状碳酸钙与稀盐酸反应
D.用稀H2SO4与锌粒反应时加入几滴CuSO4溶液
5.原电池原理的发现和各式各样电池装置的发明是化学对人类的一项重大贡献,关于右图所示原电池的说法正确的是
A.将电能转化为化学能的装置
B.电子由铜片经导线流向锌片
C.锌片为负极,发生氧化反应
D.铜片上发生的反应为Cu2++2e-==Cu
6.在含有酚酞的0.1mol/L氨水中加入少量的NH4Cl晶体,则溶液颜色
A.变蓝色 B.变深 C.变浅 D.不变
7.某温度下,在容积固定不变的密闭容器中进行可逆反应X(g)+Y(g)Z(g)+W(s) ΔH>0,一段时间后,达到化学平衡状态。下列叙述正确的是
A.通入稀有气体,平衡向正反应方向移动
B.加入少量w,逆反应速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.降低温度,平衡向逆反应方向移动
8.体积相同、PH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时两者消耗NaOH的物质的量
A.相同 B.中和HCl的多 C.中和CH3COOH的多 D.无法比较
9.可以证明可逆反应N2+3H22NH3已达到平衡状态的是
①一个N≡N键断裂的同时,有3个N﹣H键断裂
②一个N≡N键断裂的同时,有6个N﹣H键断裂
③其他条件不变时,混合气体平均相对分子质量不再改变
④恒温恒容时,体系压强不再改变
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体密度保持不变
⑦v(H2)=0.6mol•L﹣1•min﹣1,v(NH3)=0.4mol•L﹣1•min﹣1
A.全部 B. ②③④⑤ C.②③④⑤⑦ D.③⑤⑥⑦
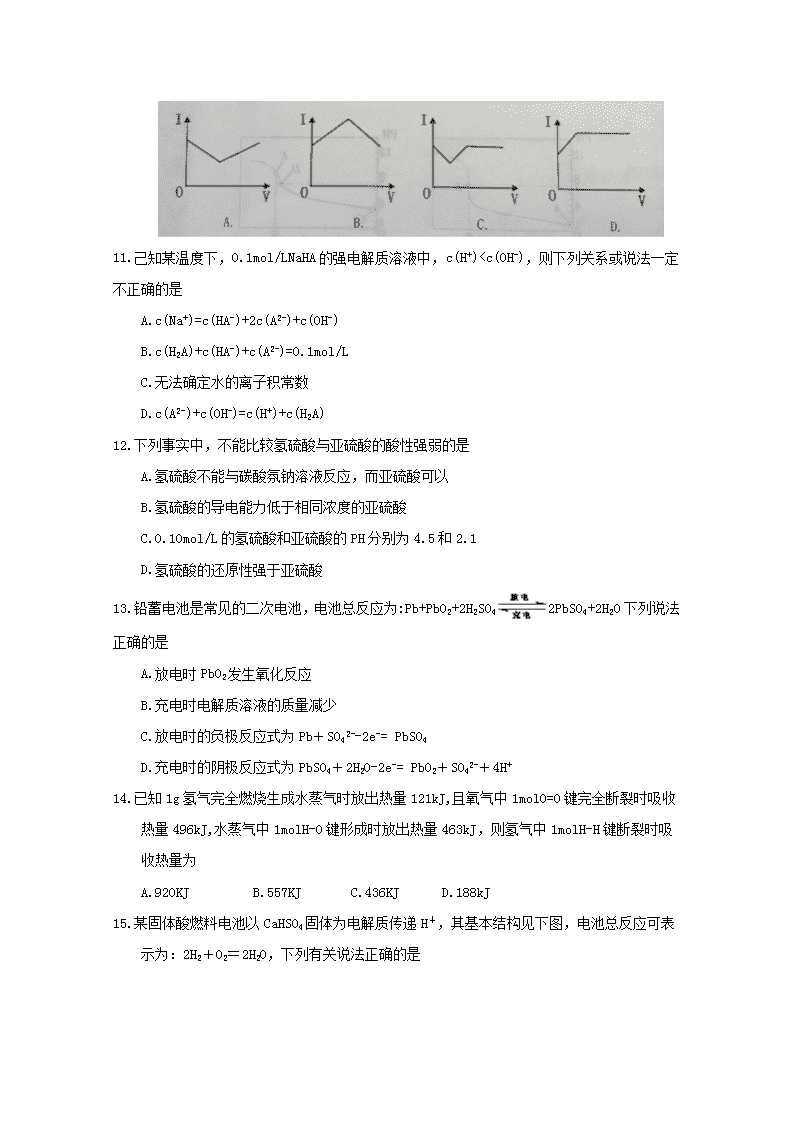
10.醋酸溶液中滴入稀氨水,溶液的导电能力(用电流I表示)发生变化,其电流I随加入稀氨水的体积V的变化曲线图是
11.己知某温度下,0.1mol/LNaHA的强电解质溶液中,c(H+)
c(A-),则2c(A-)>c(OH-)>c(H+)
第Ⅱ卷(非选择题共52分)
二、非选择题(本题包括6 小题,共52 分)
17.(6分)已知反应①Fe(s)+CO2(g)FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
温度/℃
500
700
900
K
1.00
1.47
2.40
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。
(2)上述反应中的a 0(填“大于”“小于”或“等于”)。
(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.通入CO2 C.温度升高到900 ℃ D.使用合适的催化剂
18.(10分)如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如右图所示,铁处于①②③三种不同的环境中
请回答:
(1)金属腐蚀主要分为______腐蚀和______腐蚀两种.
(2)铁被腐蚀的速率由快到慢的顺序是______(填序号).
(3)①中正极的电极反应式为
②中负极的电极反应式为
(4)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀可采取的措施有 (填序号)。
①健身器材刷油漆
②自行车钢圈镀铬
③将钢管用导线与铜条连接
④将钢管用导线与碳棒连接
19.(8分)在火箭推进器中装有强还原剂肼(N2H4) 和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol 液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256.64kJ 的热量。
(1)写出该反应的热化学方程式
(2)已知H2O(l)═H2O(g);△H=+44KJ/mol,则16g液态肼燃烧生成氮气和液态水时,放出的热量是______KJ.
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是
(4)已知N2(g)+2O2(g)═2NO2(g);△H=+68KJ/mol,N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=-534KJ/mol,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式
20.(10分)现有浓度均为0.1mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢銨、⑦氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是 (填序号)
(2)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是 (填序号)
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是 。
(4)已知t℃时,KW=1×10-13,则t℃(填“>”、“<”或“=”) 25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b= 。
21.(8分)常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL0.1000mol/LCH3COOH溶液,得到2条滴定曲线,如下图所示:
(1)由A、C点判断,滴定HCl溶液的曲线是 (填“图1”或“图2”)
(2)a= mL
(3)c(Na+)=c(CH3COO-)的点是 ;
(4)E点对应离子浓度由大到小的顺序为
22.(10分) 捕集、利用CO2是人类可持续发展的重要战略之一。
(1) 用太阳能工艺捕获CO2可得炭黑,其流程如图所示:
①捕获1mo1CO2转移电子的物质的量是
②过程2 反应的化学方程式是
(2)将CO2催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) C2H4(g)+4H2O(g),按投料比n(CO2):n(H2)=1:3将CO2与H2充入密闭容器,在0.1MPa时,测得平衡时四种气态物质,其温度(T)与物质的量(n)的关系如右图所示。
①正反应的焓变△H 0。
②提高CO2的转化率,可采用的方法是 。
a.增大n(CO2)与n(H2)的投料比
b.改变催化剂
C.缩小容器体积
③图中表示水的曲线是
(3)电解CO2可制得多种燃料: 下图是在酸性电解质溶液中,以惰性材料做电极将CO2转化为丙烯的原理模型。
①太阳能电池的正极是
②生成丙烯的电极反应式是
一、选择题(本题包括16小题,每小题3分,共48分)
题目
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答案
C
B
C
A
C
C
D
C
C
B
A
D
C
C
D
B
二、非选择题(本题包括6小题,共52分)
17.(共6分,每空2分)
(1)1 mol·L-1或1 kJ/mol (2)大于 (3)BC
18.(共10分,每空2分)
(1) 电化学 (2) ①③② (3) ①2H2O + O2 + 4e- = 4OH-
②Zn - 2e- = Zn2+ (4) ①②
19.(共8分,每空2分)
(1)N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=-641.6 kJ·mol-1
(2)408.8
(3)产物为氮气和水,无污染
(4)2N2H4(g)+2 NO2(g)═3N2(g)+4 H2O(g) △H=-1136kJ·mol-1
20.(共10分,每空2分)
(1)④②③①
(2)⑥④⑤⑦
(3)c(Cl-)>c(NH)>c(Na+)>c(OH-)>c(H+)
(4) > , 9 :2
21.(共8分,每空2分)
(1)图1
(2)20.00
(3)D
(4)c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
22.(10分,(1)②和(3)每空2分,其余每空1分)
(1) ① 4mol ② 6FeO + CO2 = 2Fe3O4 + C
(2) ①< ②c ③ b
(3) ① b ②3CO2 + 18H+ + 18e- = CH2=CH-CH3 + 6H2O