- 2021-08-06 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年广东省蕉岭县蕉岭中学高二下学期第二次质检化学试题 Word版
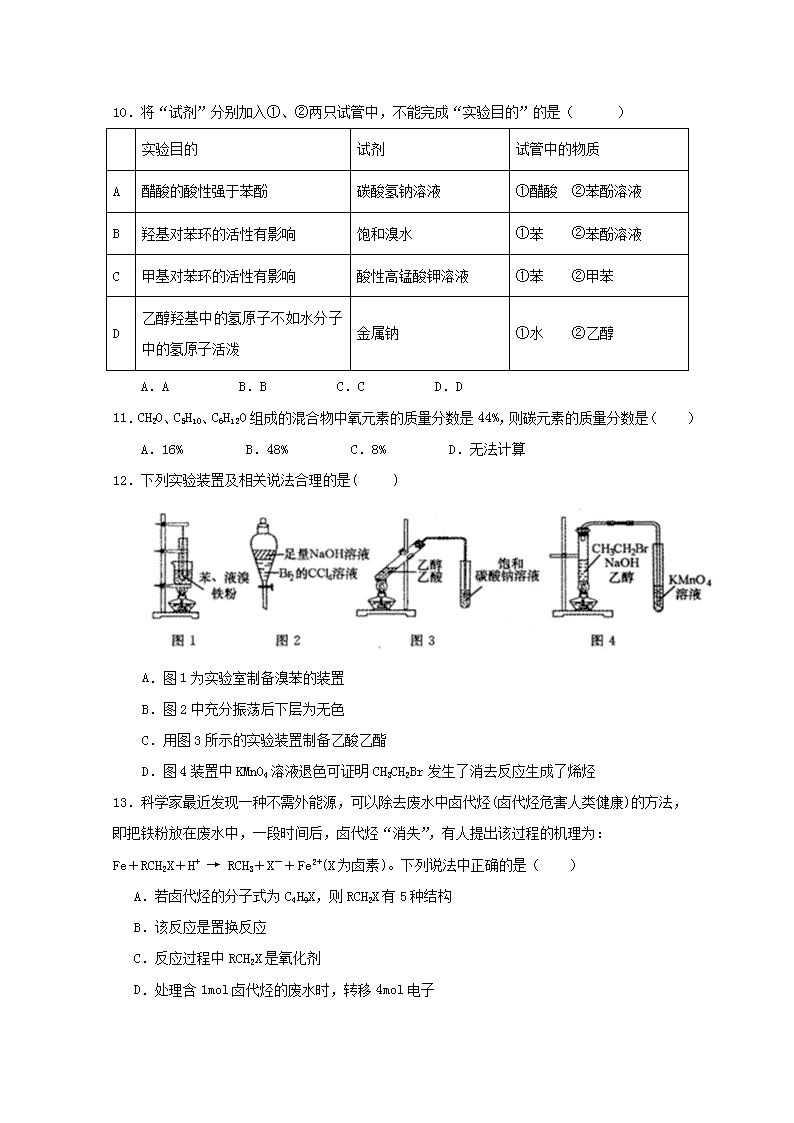
蕉岭中学2018~2019学年第二学期 高二化学第二次质检试卷 命题人:张丽娜 审题人:何子龙 说明:1、本试卷包括第Ⅰ卷和第Ⅱ卷两部分,满分100分,考试时间90分钟 2、可能用到的原子量: H 1 C 12 O 16 Br 80 第Ⅰ卷 (选择题 共48分) 一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意。) 1.下列有机物系统命名中,不正确的是( ) A.2,3-二甲基戊烷 B.2,2,3-三甲基丁烷 C.2,4-二甲基-2-戊烯 D.3-甲基-2-丁烯 2.某饱和一元醇C5H12O的同分异构体中,能催化氧化成醛的有( ) A.2种 B.3种 C.4种 D.5种 3.有机物X、Y、Z的结构简式分别为.下列分析正确的是( ) A.Y、Z互为同系物 B.Y中最多有4个C原子处于同一直线上 C.X、Z的二氯代物数目相同 D.可用酸性KMnO4溶液一次区分X、Y、Z三种物质 4.食品香精菠萝酯的生产路线(反应条件略去)如下:下列叙述错误的是( ) A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验 B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 C.苯氧乙酸和苯酚均可与NaOH溶液发生反应 D.步骤(2)产物中残留的烯丙醇可用溴水检验 5.设NA为阿伏加德罗常数的值,下列说法正确的是( ) A. 4.6g组成为C2H6O的有机物,所含的C—H键一定为0.6NA B. 28g乙烯所含共用电子对数目为4NA C. 标准状况下,11.2L二氯甲烷所含分子数为0.5NA D. 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA 6.1,3-丙二醇、乙醇、丙三醇分别和足量的钠反应生成等物质的量的氢气消耗三种醇的物质的量之比是( ) A.2:1:3 B.1:2:3 C.6:3:2 D.3:6:2 7.用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4 混合溶液。下列叙述错误的是 ( ) A. 待加工铝质工件为阳极 B. 可选用不锈钢网作为阴极 C. 阴极的电极反应式为A13++3e-=Al D. 硫酸根离子在电解过程中向阳极移动 8.茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。“茶倍健”牙膏中就添加有某种茶多酚——没食子儿茶素(EGC),其结构如右图所示。下列关于 O —OH OH OH OH 没食子儿茶素(EGC) 没食子儿茶素(EGC)的叙述中不正确的是( ) A.遇FeCl3溶液能发生显色反应 B.1molEGC与4molNaOH恰好完全反应 C.1molEGC与3molNa2CO3恰好完全反应 D.易发生氧化反应和取代反应,难发生加成反应 9.化合物丙可由如下反应得到: 丙的结构不可能是( ) A.CH3CBr2CH2CH3 B.(CH3)2CBrCH2Br C.C2H5CHBrCH2Br D.CH3(CHBr)2CH3 10.将“试剂”分别加入①、②两只试管中,不能完成“实验目的”的是( ) 实验目的 试剂 试管中的物质 A 醋酸的酸性强于苯酚 碳酸氢钠溶液 ①醋酸 ②苯酚溶液 B 羟基对苯环的活性有影响 饱和溴水 ①苯 ②苯酚溶液 C 甲基对苯环的活性有影响 酸性高锰酸钾溶液 ①苯 ②甲苯 D 乙醇羟基中的氢原子不如水分子中的氢原子活泼 金属钠 ①水 ②乙醇 A.A B.B C.C D.D 11.CH2O、C5H10、C6H12O组成的混合物中氧元素的质量分数是44%,则碳元素的质量分数是( ) A.16% B.48% C.8% D.无法计算 12.下列实验装置及相关说法合理的是( ) A.图1为实验室制备溴苯的装置 B.图2中充分振荡后下层为无色 C.用图3所示的实验装置制备乙酸乙酯 D.图4装置中KMnO4溶液退色可证明CH3CH2Br发生了消去反应生成了烯烃 13.科学家最近发现一种不需外能源,可以除去废水中卤代烃(卤代烃危害人类健康)的方法,即把铁粉放在废水中,一段时间后,卤代烃“消失”,有人提出该过程的机理为: Fe+RCH2X+H+ → RCH3+X-+Fe2+(X为卤素)。下列说法中正确的是( ) A.若卤代烃的分子式为C4H9X,则RCH2X有5种结构 B.该反应是置换反应 C.反应过程中RCH2X是氧化剂 D.处理含1mol卤代烃的废水时,转移4mol电子 14.卤代烃的取代反应,实质是带负电荷的原子团取代了卤代烃中的卤原子,例如: CH3Br+OH-(或NaOH)→CH3OH+Br-(或NaBr)。 下列反应的化学方程式中,不正确的是( ) A.CH3CH2Br+NaHS→CH3CH2HS+NaBr B.CH3I+CH3ONa→CH3O CH3+NaI C.CH3CH2Cl+CH3ONa→CH3Cl+CH3CH2ONa D.CH3CH2Cl+CH3CH2 ONa→(CH3CH2)2O+NaCl 15.常温下,下列有关稀溶液中离子浓度的说法正确的是( ) A.同浓度的四种溶液:①NH4Cl ②(NH4)2SO4 ③NH4HSO4 ④NH4Al(SO4)2 溶液,c(NH4+)浓度的大小关系:②>④>③>① B.一定浓度的NaHS溶液中:c(Na+)+c(OH﹣)=c(H+)+c(HS﹣)+2c(H2S) C.若0.1mol/LNH4Cl溶液pH=5,则其中离子浓度最大与最小的差值为(0.1﹣10﹣5)mol/L D.常温下,四种溶液:①pH=4的H2SO4溶液 ②pH=4的NH4Cl溶液 ③pH=10的氨水④pH=10的CH3COONa溶液,其中水的电离程度大小关系为:②=④>①>③ 16.25℃时,起始浓度为0.1mol.L-1的亚硫酸溶液中,H2SO3、HSO3-、SO32-三种微粒的物质的量分数(即微粒本身物质的量与三种粒子总物质的量之比)随pH变化的关系如图所示。下列说法不正确的是( ) A.读取图中数据计算可得到常温下亚硫酸溶液的Ka2≈10-7 B.向pH为7.0的溶液中滴入少量稀盐酸造成溶液pH变化小于向pH为4.0的溶液中滴入相同量稀盐酸造成溶液pH变化 C.在pH=3.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) D.在0.1mol.L-1的亚硫酸溶液中存在:c2(H+)=c(H+)·c(HSO3-)+2c (H+)∙c(SO32-)+Kw 第Ⅱ卷 (非选择题 共52分) 17.(11分)某实验小组用下列装置进行乙醇催化氧化的实验。 (1)实验过程中铜网出现红色和黑色交替的现象,请写出实验过程中总的化学方程式: __________________________________________;在不断鼓入空气的情况下,熄灭酒精灯,反 应仍能继续进行,说明该乙醇催化反应是____ _____反应。(填“吸热”或“放热”). (2)甲是热水浴,乙是冷水浴,但两个水浴作用不相同,①甲的作用是______ _ ____________ __;②乙的作用是____ ___ _______________。 (3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________________。 (4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还有_____ _____ 。要除去该物质,可先在混合液中加入__________(填写字母),然后再通过蒸馏即可除去。 A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳 18.(13分)含苯酚的工业废水的处理流程如图所示。 (1)①流程图设备Ⅰ中进行的是________操作(填写操作名称)。实验室里这一步操作可以用______(填仪器名称)进行。 ②由设备Ⅱ进入设备Ⅲ的物质A是_____(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是____。 ③在设备Ⅲ中发生反应的离子方程式为______________________ _______________。 ④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和________。通过________(填操作名称)操作,可以使产物相互分离。 ⑤图中,能循环使用的物质是________、________、C6H6和CaO。 (2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是__________________________________________。 (3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量 (mg·L-1)。 19.(13分)根据下面的反应路线及所给信息填空。 (1)A的名称___________,C的分子式 ,F的官能团名称 。 (2)上述反应中属于取代反应的是__________,属于加成反应的是__________,属于消去反应的是___________。(填序号) (3)写出反应①的化学反应方程式____ _______。 写出反应④的化学反应方程式_____ ______。 20.(6分)现将5.4g某烃的含氧衍生物A在足量氧气中完全燃烧,将产生的高温气体依次通过浓H2SO4和碱石灰,测得浓H2SO4增重3.6g,碱石灰增重15.4g。用质谱仪可测得A的相对分子量108,B为A的同分异构体:A能与浓氢溴酸反应而B不能;A不溶于NaOH,而B能溶于NaOH;B能使适量的浓溴水褪色并产生白色沉淀而A不能;B苯环上的一溴代物有两种结构。请据此回答问题: (1)A和B的分子式为: 。 (2)写出B的名称: 。 (3)写出能与FeCl3溶液发生显色反应的B的同分异构体结构简式(任写一种): 。 21.(9分)以甲烷为燃料的新型燃料电池,其成本大大低于以氢气为燃料的传统燃料电池,目前已得到了广泛的研究。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。 ①B极为电池________极,电极反应式为___ _____。 ②若用该燃料电池作电源,用石墨作电极电解100 mL 1mol/L的硫酸铜溶液,写出阳极的电极反应式:_____ __;标准状况下,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为_____ ___,实际上消耗的甲烷体积( 已折算成标准状况下)比理论上大,可能原因为_______ _______。 蕉岭中学2018~2019学年第二学期 高二化学第二次质检答案 1 2 3 4 5 6 7 8 D C C D D D C B 9 10 11 12 13 14 15 16 A C B B C C B C 17.(11分)(1) 2CH3CH2OH + O22CH3CHO + 2H2O (2分); 放热(1分) (2)提供乙醇蒸汽(2分) ; 冷却产生的乙醛等气体(2分) (3)乙醛、乙醇、水 (2分) (4)乙酸 (1分); C(1分) 18. (13分)除说明外每空2分 (1)①萃取、分液 分液漏斗 ②C6H5ONa NaHCO3 ③C6H5O-+CO2+H2O→C6H5OH+HCO3- (2分) ④CaCO3 过滤 ⑤NaOH CO2 (2)向污水中滴加FeCl3溶液,若溶液呈紫色,则表明污水中有苯酚 (3)940 mg·L-1(2分) 19.(13分)(1)环己烷 C6H10 溴原子、碳碳双键 (2)①⑥ ③⑤ ②④ (3) 20.(6分,每小题2分)(1)C7H8O (2)对甲基苯酚或4-甲基苯酚 (3) 21. (9分,除说明外其余各2分)(1). 负(1分) CH4-8e-+4O2-=CO2+2H2O (2). 2H2O-4e-=O2↑+4H+(或4OH——4e—=O2+2H2O) 1.12L 生成C(或生成CO或电池能量转化率达不到100%)查看更多