- 2021-08-06 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年湖北省当阳市第一高级中学高二上学期期中考试化学试题(Word版)
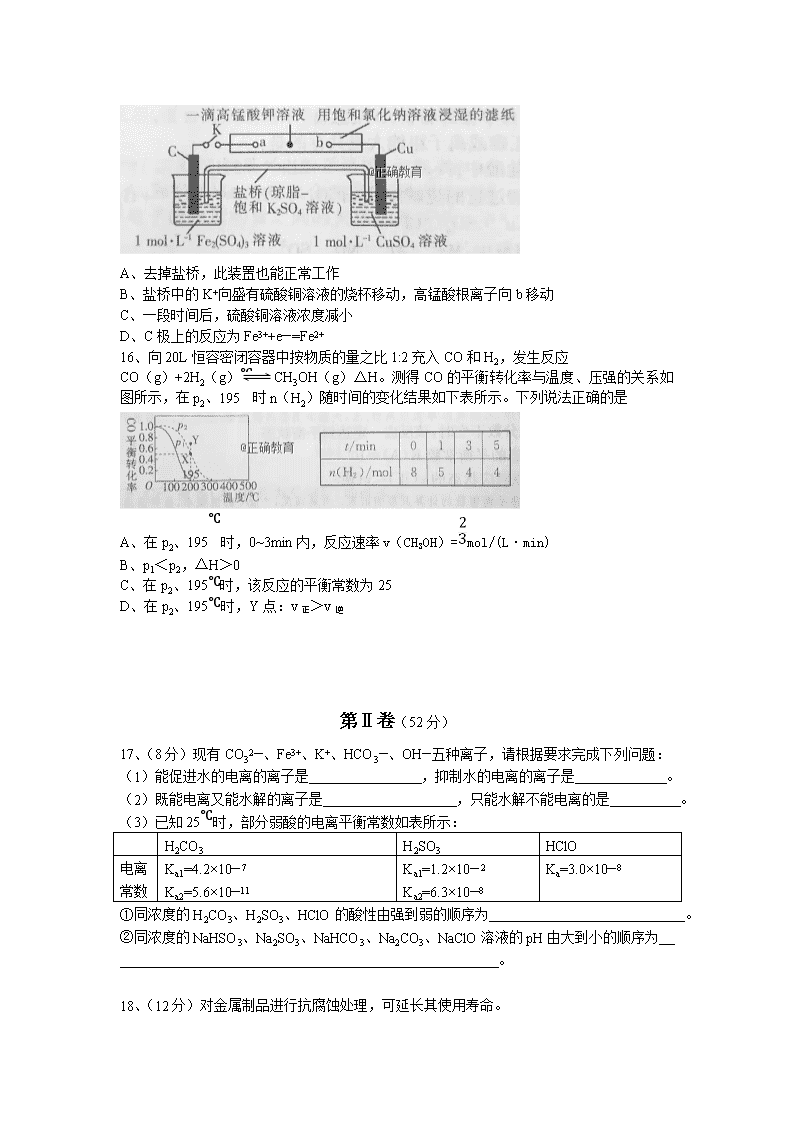
当阳一中2018—2019学年度上学期高二年级期中考试 化学试卷 命题人:黄春红 审题人:谭卫东 郑国武 考试时间:90分钟 满分:100分 可能用到的相对原子质量:H——1 C——12 N——14 O——16 Na——23 S——32 Fe——56 Cu——64 第Ⅰ卷(48分) 单项选择题(每小题有且只有一个选项符合题意,每小题3分,共48分) 1、下图变化为吸热反应的是 2、对于X(g)+2Y(g)nZ(g) △H<0,已达到平衡后,若下列物理量发生变化,则一定能表明平衡发生移动的是 A、反应体系的总压强 B、正、逆反应速率 C、反应混合物的密度 D、反应物的转化率 3、在体积和温度不变的密闭容器中充入2molA和足量B,发生反应 2A(g)+B(s)C(g)+D(g)△H<0,建立平衡后,若再加入2molA,下列判断不正确的是 A、平衡正向移动 B、A的转化率不变 C、B的消耗量增加 D、△H增大 4、NH4F(s)NH3(g)+HF(g) △H<0,下列有关判断正确的是 A、该反应的熵变小于0 B、仅在高温下能自发进行 C、在任何条件下能自发进行 D、有些熵变小于0的反应能自发进行,是因为该反应的△H>0 5、在NH4Cl溶液中存在平衡:NH4++H2ONH3·H2O+H+。下列措施能使溶液中 c(H+)/c(NH4+)减小的是 A、加入少量水 B、适当升高温度 C、加入固体NaOH D、通入少量HCl气体 6、下列属于盐类水解离子方程式且正确的是 A、HSO3—+H2OSO32—+H3O+ B、S2—+2H2OH2S+2OH— C、Al3++3H2OAl(OH)3+3H+ D、HCO3—+H3O+===CO2↑+2H2O 7、对于可逆反应2SO2(g)+O2(g)2SO3(g) △H<0,下列说法正确的是 A、增压、升温,反应速率都增大,反应物中活化分子百分数都增加 B、使用催化剂不改变该反应的逆反应速率 C、当v逆(SO3)=2v正(O2)时,反应达到最大限度 D、该反应是放热反应,降低温度将缩短反应达到平衡的时间 8、在一定温度下,可逆反应aX2(g)+bY2(g)cZ2(g)的平衡常数为K。下列有关K的说法正确的是 A、升高温度,K值一定减小 B、K值越大,表明反应物的转化率越大 C、平衡正向移动,K值一定增大 D、若a+b=c,则K=1 9、常温下,0.1mol/L氨水的pH=a,下列措施中可能使溶液的pH=a—1的是 A、将溶液稀释到原体积的10倍 B、加入NaCl溶液 C、加入等体积0.1mol/LNaOH溶液 D、升高溶液的温度(不考虑溶剂和溶质的挥发) 10、在25℃时,将浓度均为0.1mol/L的醋酸溶液和氨水等体积混合,得到pH=7的混合溶液。下列说法正确的是 A、混合溶液中水电离出的c(H+)=10— 7mol/L B、在相同温度下:Ka(CH3COOH)=Kb(NH3·H2O) C、混合溶液中c(NH4+)+c(NH3·H2O)=0.1mol/L D、混合溶液中c(CH3COO—)=c(NH4+)=c(H+)=c(OH—) 11、测得某电解质溶液的pH=a,向其中插入两根惰性电极,通电一段时间后测得溶液的pH=b,若b≤a,则该电解质不可能是 A、H2SO4 B、CuSO4 C、KOH D、Na2SO4 12、下列有关热化学方程式的书写正确的是 选项 已知条件 热化学方程式 A 中和热△H= —57.3kJ/mol H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) △H= —114.6kJ/mol B 合成氨反应中生成1molNH3时放出46kJ热量 N2(g)+3H2(g)2NH3(g)△H= —92kJ/mol C H2的燃烧热△H= —285.8kJ/mol H2(g)+O2(g)=H2O(g) △H= —285.8kJ/mol D 碳的燃烧热△H= —393.5kJ/mol 2C(s)+O2(g)=2CO(g) △H= —787kJ/mol 13、已知:pKa= —lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.2mol/LNaOH溶液滴定20mL0.1mol/LH2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法不正确的是 A、0.1mol/LH2SO3溶液的pH≈1.42 B、b点所得溶液中:c(H2SO3)+c(H+)=c(SO32—)+c(OH—) C、d点所得溶液中:c(Na+)>c(SO32—)>c(OH—)>c(HSO3—) D、溶液中水的电离程度:a>b>c>d 14、已知在20℃下,PbSO4、PbS和FeS的溶度积分别为1.8×10—8、3.4×10—28、6.3×10—18。下列说法中不正确的是 A、FeS的溶解度大于PbS的溶解度 Na2S B、取PbSO4悬浊液中的上层清液,滴入0.1mol/L的Na2S溶液,会看到有黑色沉淀出现 C、PbSO4 转化为PbS的平衡常数K=1.89×10—20 D、将FeS固体投入到含有Pb2+的废水中进行污水处理 15、将下图中的K闭合,下列判断正确的是 A、去掉盐桥,此装置也能正常工作 B、盐桥中的K+向盛有硫酸铜溶液的烧杯移动,高锰酸根离子向b移动 C、一段时间后,硫酸铜溶液浓度减小 D、C极上的反应为Fe3++e—=Fe2+ 16、向20L恒容密闭容器中按物质的量之比1:2充入CO和H2,发生反应 CO(g)+2H2(g)CH3OH(g)△H。测得CO的平衡转化率与温度、压强的关系如图所示,在p2、195℃时n(H2)随时间的变化结果如下表所示。下列说法正确的是 A、在p2、195℃时,0~3min内,反应速率v(CH3OH)=mol/(L·min) B、p1<p2,△H>0 C、在p2、195℃时,该反应的平衡常数为25 D、在p2、195℃时,Y点:v正>v逆 第Ⅱ卷(52分) 17、(8分)现有CO32—、Fe3+、K+、HCO3—、OH—五种离子,请根据要求完成下列问题: (1)能促进水的电离的离子是 ,抑制水的电离的离子是 。 (2)既能电离又能水解的离子是 ,只能水解不能电离的是 。 (3)已知25℃时,部分弱酸的电离平衡常数如表所示: H2CO3 H2SO3 HClO 电离 常数 Ka1=4.2×10— 7 Ka2=5.6×10—11 Ka1=1.2×10— 2 Ka2=6.3×10—8 Ka=3.0×10—8 ①同浓度的H2CO3、H2SO3、HClO的酸性由强到弱的顺序为 。 ②同浓度的NaHSO3、Na2SO3、NaHCO3、Na2CO3、NaClO溶液的pH由大到小的顺序为 。 18、(12分)对金属制品进行抗腐蚀处理,可延长其使用寿命。 (1) 以下为铝材表面处理的一种方法。 铝材 脱脂 碱洗 槽液 水洗 除灰 电解 稀硫酸 耐蚀铝材 废电解液 ①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是 (用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。 A、NH3 B、CO2 C、NaOH D、HNO3 ②以铝材为阳极,在稀硫酸中电解,铝材表面形成氧化膜,其阳极的电极反应式为 。 (2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是 。 (3)利用右图所示装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。若X为锌,开关K置于M处,则该电化学防护法称为 。 19、(10分)据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。 (1)甲烷重整是提高甲烷利用率的重要方式,有以下三种: 部分氧化:CH4(g)+O2(g)CO(g)+2H2(g) △H1= —35.9kJ/mol ① 水蒸气重整:CH4(g)+H2O(g)CO(g)+3H2(g) △H2=+205.9kJ/mol ② CO(g)+H2O(g)CO2(g)+H2(g) △H3= —41.2kJ/mol ③ 二氧化碳重整:CH4(g)+CO2(g)2CO(g)+2H2(g) △H4 ④ 反应④的△H4= kJ/mol。 (2)起始时向某恒容密闭容器中充入一定量的CH4(g)和O2(g),发生反应①。CH4(g)的平衡转化率与温度(T)和压强(p)的关系如图所示。 ①T1 (填“>”“<”或“=”,下同)T2。 ②N、P两点的平衡常数:K(N) K(P),理由是 。 (3)合成气CO和H2在一定条件下能发生如下反应:CO(g)+2H2(g)CH3OH(g)△H<0。在容积均为V L的甲、乙、丙三个恒容密闭容器中各充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行t min时CO的体积分数如图所示,T3温度下的化学平衡常数为 (用含a、V的代数式表示)。 20、(10分)实验室常利用甲醛(HCHO)法测定(NH4)2SO4样品中氮的质量分数,其反应原理为4NH4++6HCHO=3H++6H2O+[(CH2)6N4H]+{滴定时,1mol[(CH2)6N4H]+与1molH+相当},然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验: 步骤Ⅰ:称取样品1.500g; 步骤Ⅱ:溶解后转移至250mL容量瓶中,定容,摇匀; 步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按步骤Ⅲ操作方法再重复2~3次。 (1)步骤Ⅰ、Ⅱ中用到的主要仪器有天平、药匙、250mL容量瓶、量筒、烧杯、 。 (2)滴定时边滴边晃动锥形瓶,眼睛应观察 。 (3)滴定至终点时的现象为 。 (4)不正确的操作将导致误差。 ①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数将 (填“偏高”“偏低”或“无影响”,下同) ②读数时,滴定前平视,滴定后仰视,则测得样品中氮的质量分数将 。 (5)滴定结果如下表所示。 滴定次数 待测溶液的体积/mL 标准溶液的体积/mL 滴定前刻度 滴定后刻度 1 25.00 1.02 21.03 2 25.00 2.00 21.99 3 25.00 0.20 20.20 若NaOH标准溶液的浓度为0.1010mol/L,则该样品中氮的质量分数为 。(保留四位有效数字) 21、(12分)在水溶液中Cr2O72—(橙红色)与CrO42—(黄色)存在如下转化关系: Cr2O72—+H2O2CrO42—+2H+。 又知AgCl饱和溶液中存在如下平衡:AgCl(s)Ag+(aq)+Cl—(aq)。 (1)室温下,初始浓度为1.0mol/L的K2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示。 ①向该溶液中加入一定量NaOH固体后,溶液中c(Cr2O72—)/c(CrO42—)将 (填“增大”“减小”或“不变”)。 ②根据A点数据,计算出Cr2O72—+H2O2CrO42—+2H+的平衡常数为 。下列事实不能表明该转化达到平衡状态的是 。 A、溶液颜色保持不变 B、Cr2O72—的消耗速率与CrO42—的生成速率之比为1:2 C、溶液的pH保持不变 (2)向K2Cr2O7溶液中加入AgNO3溶液,发生离子互换反应,生成砖红色沉淀且溶液pH减小,则生成的砖红色沉淀的化学式为 。 (3)现将足量AgCl分别加入下列液体中:①100mL蒸馏水②100mL0.3mol/LAgNO3溶液③100mL0.1mol/LMgCl2溶液。充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为 (用序号表示),②中Cl—的物质的量浓度为 。(已知25℃时,AgCl的Ksp=1.8×10—10) 高二化学期中考试答案 ADDCC/CCBBB/CBDCD/C 17、答案:(1)CO32—、Fe3+、HCO3—(1分)OH—(1分)(2)HCO3—(1分)CO32—、Fe3+(1分)(3)①H2SO3>H2CO3>HClO(2分)②Na2CO3>NaClO>Na2SO3>NaHCO3>NaHSO3(2分) 18、答案:(1)①2Al+2OH—+2H2O=2AlO2—+3H2↑(2分)B(2分)②2Al—6e—+3H2O=Al2O3+6H+(2分) (2)保证电解液中铜离子浓度保持不变(2分) (3)N(2分)牺牲阳极的阴极保护法(2分) 19、答案:(1)+247.1(2分)(2)①<(2分)②>(2分);反应①为放热反应,温度升高,平衡逆向移动,故P点的平衡常数小于N点(2分)(3)9V2/2a2(2分) 20、答案:(1)玻璃棒、胶头滴管(2分)(2)锥形瓶内溶液颜色的变化(2分)(3)当滴入最后一滴标准液时,溶液由无色变为浅红色,且半分钟内溶液颜色不再褪去。(2分)(4)偏高(1分)偏高(1分)(5)18.85%(2分) 21、答案:(1)①减小(2分)②1.0×10—14(2分)B(2分)(2)Ag2CrO4(2分)(3)②>①>③(2分)6×10—10mol/L(2分)查看更多