- 2021-07-09 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年广西省贵港市覃塘高级中学高二9月月考化学试题 Word版
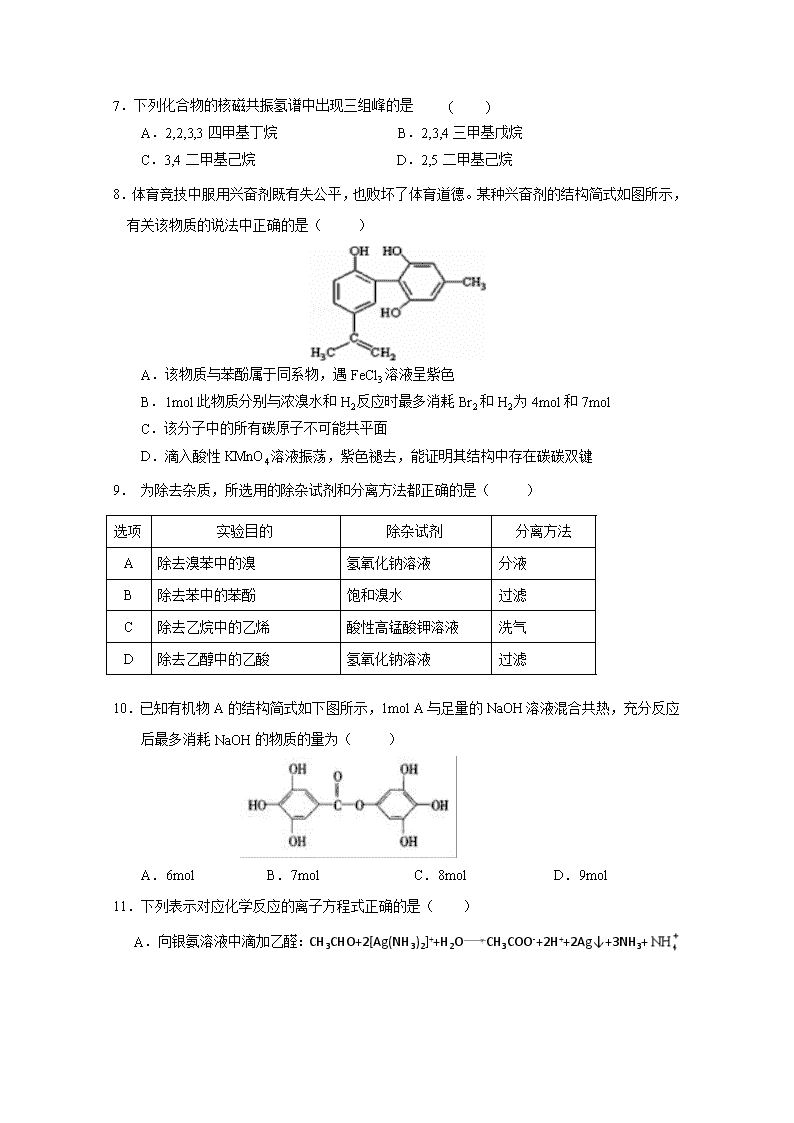
覃塘高中2018年秋季期9月月考试题 高二化学 可能用到的原子量:H 1 He 4 C 12 N 14 O 16 Ne 20 Na 23 Mg 24 A1 27 S 32 C1 35.5 K 39 Ca 40 Zn 65 Ba 137第Ⅰ卷(选择题48分) 一、选择题:每小题只有一个选项最符合题意(每小题3分,共48分) 1.下列化学用语表达不正确的是( ) ①丙烷的球棍模型 ②丙烯的结构简式为CH3CHCH2 ③某有机物的名称是2,3-二甲基戊烷 ④ 与C8H6互为同分异构体 A. ①② B.②③ C. ③④ D. ②④ 2.下列方法能用于鉴别二甲醚(CH3OCH3)和乙醇的是( ) A.李比希燃烧法 B.铜丝燃烧法 C.红外光谱法 D.元素分析仪 3.下列名称的有机物实际上不可能存在的是( ) A. 2,2二甲基丁烷 B. 2甲基4乙基1己烯 C. 3甲基2戊烯 D. 3,3二甲基2戊烯 4.NA为阿伏加德罗常数,下列说法正确的是( ) A. 28g乙烯所含共用电子对数目为6NA B. 标准状况下,11.2L的正戊烷所含的分子数为0. 5NA C.常温常压下,11.2 L一氯甲烷所含分子数为0.5 NA D. 14g乙烯、丙烯、丁烯的混合气体,其原子数为4NA 5.下列有机物中,可以形成顺反异构的是( ) A.2-甲基-2-丁烯 B.丙烯 C. 1-氯-1-丙烯 D.2,3-二甲基-2-丁烯 6.某烃结构式用键线表示为,该烃与Br2按物质的量之比为1∶1加成时,所得产物有( ) A.3种 B.6种 C.5种 D.4种 7.下列化合物的核磁共振氢谱中出现三组峰的是 ( ) A.2,2,3,3四甲基丁烷 B.2,3,4三甲基戊烷 C.3,4二甲基己烷 D.2,5二甲基己烷 8.体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示,有关该物质的说法中正确的是( ) A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 B.1mol此物质分别与浓溴水和H2反应时最多消耗Br2和H2为4mol和7mol C.该分子中的所有碳原子不可能共平面 D.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 9. 为除去杂质,所选用的除杂试剂和分离方法都正确的是( ) 选项 实验目的 除杂试剂 分离方法 A 除去溴苯中的溴 氢氧化钠溶液 分液 B 除去苯中的苯酚 饱和溴水 过滤 C 除去乙烷中的乙烯 酸性高锰酸钾溶液 洗气 D 除去乙醇中的乙酸 氢氧化钠溶液 过滤 10.已知有机物A的结构简式如下图所示,1mol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为( ) A.6mol B.7mol C.8mol D.9mol 11.下列表示对应化学反应的离子方程式正确的是( ) A.向银氨溶液中滴加乙醛:CH3CHO+2[Ag(NH3)2]++H2OCH3COO-+2H++2Ag↓+3NH3+ B.苯酚钠溶液中通入少量CO2:+H2O+CO2+ C.硫酸氢铵溶液中滴加少量NaOH溶液:H+++2OH−NH3·H2O+H2O D.氯乙酸与足量的氢氧化钠溶液共热:CH2ClCOOH+OH-CH2ClCOO-+H2O 12.向2.9 g某饱和一元醛中加入足量银氨溶液,在一定条件下充分反应后析出10.8 g银,该醛是( ) A. HCHO B. CH3CHO C. CH3CH2CHO D. CH3CH(CH3)CHO 13.一氧化碳、烯烃和氢气在催化剂作用下发生烯烃的醛化反应,又称羰基的合成,如由乙烯可制丙醛:CH2=CH2+CO+H2CH3CH2CHO。由丁烯进行醛化反应也可得到醛,得到的醛的种类为( ) A.2种 B.3种 C.4种 D.5种 14.某烃的结构简式如图所示,若分子中共线碳原子数为a,可能共面的碳原子最多为b,含四面体结构 碳原子数为c,则a、b、c分别是( ) A. 3,4,5 B. 3、14,4 C. 3,l0,4 D. 4,l0,4 15.下列物质经催化加氢后,不能得到2-甲基丁烷的是( ) A.2-甲基-1-丁烯 B.2-甲基-2-丁烯 C.3-甲基-1-丁炔 D.3,3-二甲基-1-丁炔 16.芳香化合物A的分子式为C7H6O2,将它与NaHCO3溶液混合加热,有酸性气体产生。那么包括A在内,属于芳香化合物的同分异构体的数目是 ( ) A.5种 B.4种 C.3种 D.2种 二、非选择题(52分) 17. (16分,每空2分) I.现有下列十组物质: ①O2和O3 ②126C 和146C ③4039K和4020Ca ④甲烷和丙烷 ⑤甲醇和乙二醇 ⑥和 ⑦和 ⑧葡萄糖和果糖 ⑨蔗糖和麦芽糖 ⑩淀粉和纤维素 (1) 互为同分异构体的是_______________;(填序号) (2) 互为同系物的是_______________;(填序号) (3) ⑦中有机物按系统命名法命名为______________。 Ⅱ.写出下列化合物的名称或结构简式: ① 有机物的系统名称是________________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是________________。 ② _________________________, ③ CH2===CHCOOH_____________________________, ④ 2,5 -二甲基-2,4 -己二烯的结构简式:__________________________________。 18.(10分,每空1分)现有四种有机物:①乙烯 ② 2-丙醇 ③ 甲苯 ④ 乙炔,其中: (1)能发生消去反应的是 (填序号,下同),其化学方程式是 。 (2)能衡量一个国家的石油化工生产水平的是 ,该物质可用于一种常用塑料,其反应的化学方程式是 。 (3)能用来制取梯恩梯(TNT)的是 ,其发生反应的化学方程式是 。 (4)碳元素的质量百分含量最高的是 ,实验室制取该物质的反应装置如下: 甲中反应的化学方程式是 ,滴加饱和食盐水而不直接滴加水的原因是 , 乙中硫酸铜溶液的作用是 。 19.(14分,除标明外,每空2分) 甲苯()是一种重要的化工原料,能用于生产苯甲醛()、苯甲酸()等产品。下表列出了有关物质的部分物理性质,请回答: 注:甲苯、苯甲醛、苯甲酸三者互溶。 实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。 (1)装置a的名称是__________________,主要作用是____________________。 (2)三颈瓶中发生反应的化学方程式为_______________________________________,此反应的原子利用率理论上可达___________。【原子利用率=(期望产物的总质量/全部反应物的总质量)×100%】 (3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是________________________________________________。 (4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过 ________、________(填操作名称)等操作,才能得到苯甲醛粗产品。 (5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。 若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_______(按步骤顺序填字母)。 a.对混合液进行分液 b.过滤、洗涤、干燥 c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合震荡 20.(12分,除标明外,每空2分)有机物G()是一种重要的有机高分子材料,实验室由有机物A制备G的一种合成路线如下: 回答下列问题: (1)D的名称是 B分子中含有的官能团的名称是 。 (2)A→B、B→C的反应类型分别为 、 。 (3)下列说法正确的是 (填字母编号)。 a.A分子存在顺反异构 b.可以用NaHCO3鉴别D和F c.E分子中最多有14个原子位于同一平面上 (4)写出D+F→G的化学方程式 。 (5)H是F的同系物,其相对分子质量比F多28,H的核磁共振氢谱有三组峰,峰面积比为3︰1︰1,则符合该条件的G的同分异构体共有 种,写出其中H的一种结构简式 。 高二化学答案 题号 1 2 3 4 5 6 7 8 答案 D C D A C C D B 题号 9 10 11 12 13 14 15 16 答案 A C B C C B D A 17. (16分,每空2分) I. (1)⑦⑧⑨ (2)④ (3) 2,2-二甲基丙烷 Ⅱ. ① 3,5,6- 三甲基- 1-庚炔 2,3,5- 三甲基庚烷 ② 2- 甲基- 1,3- 丁二烯 ③丙烯酸 浓H2SO4 18.(10 分,每空1分)(1)② CH3CHOHCH3 浓H2SO4 浓H2SO4 CH2=CHCH3↑+H2O 一定条件 (2)① nCH2=CH2 (3)③ (4) ⑤ CaC2 +2H2O Ca(OH)2 + ↑ 减缓反应速率 除去乙炔中的硫化氢等杂质气体 19.(14分,除标明外,每空2分) (1)球形冷凝管 冷凝回流,防止甲苯的挥发而降低产品产率(2) 66.25% (3)H2O2在较高温度时分解速度加快,使实际参加反应的H2O2减少,影响产量 (4)过滤 (1分) 蒸馏(1分) (5)dacb 20. (12分)(1)丙三醇(1分) 碳碳双键和溴原子(2分) (2)取代反应、加成反应(2分) (3)bc(2分) (4)(2分)查看更多