2018-2019学年内蒙古杭锦后旗奋斗中学高二下学期期中考试化学试题(Word版)
奋斗中学2018—2019年第二学期期中考试题
高二化学
可能用到的相对原子量 H :1 C:12 O:16 S:32
一、选择题(每题2分,共50分)
1.判断强弱电解质的标准是( )
A.导电能力 B.相对分子质量 C.电离程度 D.溶解度
2.北魏贾思勰《齐民要术·作酢法》这样描述苦酒:“乌梅苦酒法:乌梅去核,一升许肉,以五升苦酒渍数日,曝干,捣作屑。欲食,辄投水中,即成醋尔。”下列有关苦酒主要成分的说法正确的是( )
A.苦酒的主要溶质是非电解质 B.苦酒的主要溶质是强电解质
C.苦酒的主要溶质是弱电解质 D.苦酒的溶液中只存在分子,不存在离子
3.氢氰酸(HCN)的下列性质中,不能说明它是弱电解质的是( )
A.1 mol·L-1氢氰酸溶液的pH约为3
B.同浓度的盐酸比HCN溶液导电性强
C.同浓度同体积的HCN溶液和NaOH溶液混合,溶液呈碱性
D.10 mL 1 mol·L-1HCN恰好与10 mL 1 mol·L-1 NaOH溶液完全反应
4.下列四种溶液中,水的电离程度最大的是( )
A.pH=5的NH4Cl溶液 B.pH=5的NaHSO4溶液
C.pH=8的CH3COONa溶液 D.pH=8的NaOH溶液
5.已知25 ℃下,醋酸溶液中存在下述关系:K==1.75×10-5,其中K的数值是该温度下醋酸的电离平衡常数。有关K的下列说法正确的是( )
A.当向该溶液中加入一定量的硫酸时,K值增大
B.升高温度,K值增大
C.向醋酸溶液中加水,K值增大
D.向醋酸溶液中加醋酸钠,K值减小
6.下列有关盐类水解的叙述中正确的是( )
A.溶液呈中性的盐一定是强酸、强碱生成的盐
B.含有弱酸根盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱
D.强酸强碱盐的水溶液一定呈中性
7.稀氨水中存在着下列平衡:NH3·H2ONH+OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥少量MgSO4固体
A.①②③⑤ B.③ C.③④⑥ D.③⑤
8.室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中离子的数目减小
B.再加入CH3COONa固体能促进醋酸的电离
C.醋酸的电离程度增大,c(H+)亦增大
D.溶液中不变
9.已知在100 ℃时水的离子积Kw=1×10-12,下列溶液的温度均为100 ℃。其中说法正确的是( )
A.0.005 mol·L-1的H2SO4溶液,pH=2
B.0.001 mol·L-1的NaOH溶液,pH=11
C.0.005 mol·L-1的H2SO4溶液与0.01 mol·L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性
D.pH=3的H2SO4溶液与pH=9的NaOH溶液完全中和需要NaOH溶液的体积是硫酸溶液的2倍
10.用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中,会引起实验误差的是( )
A.取干燥洁净的酸式滴定管立即装入标准盐酸
B.用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定
C.往盛有20.00 mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定
D.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液
11.下列说法中错误的是( )
A.0.1 mol/L的HCl与0.1 mol/L的NH3·H2O等体积混合,溶液中的c(NH)>c(Cl-)
B.常温下pH=3的HCl与pH=11的氨水等体积混合,溶液中的c(OH-)>c(H+)
C.pH=11的NaCN溶液中,由水电离出来的c(OH-)=c(H+)
D.CO2、SO2的水溶液能导电,但它们是非电解质
12.下列各组数据中,前者一定比后者大的是( )
A.相同温度下,pH=10的KOH溶液和pH=10的K2CO3溶液由水电离出的OH-浓度
B.0.1 mol·L-1(NH4)2SO4溶液与0.1 mol·L-1(NH4)2CO3溶液中NH浓度
C.Na2CO3溶液中HCO和OH-的浓度
D.纯水在80℃和在常温下的pH
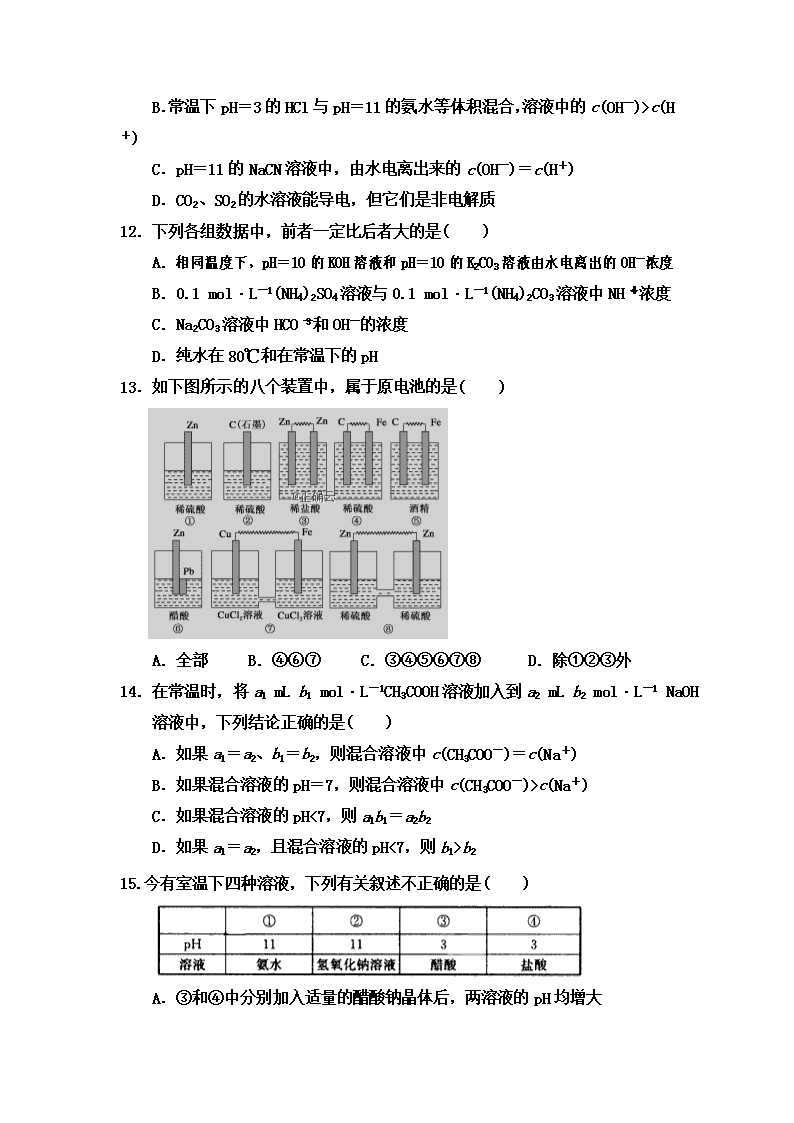
13.如下图所示的八个装置中,属于原电池的是( )
A.全部 B.④⑥⑦ C.③④⑤⑥⑦⑧ D.除①②③外
14.在常温时,将a1 mL b1 mol·L-1CH3COOH溶液加入到a2 mL b2 mol·L-1 NaOH溶液中,下列结论正确的是( )
A.如果a1=a2、b1=b2,则混合溶液中c(CH3COO-)=c(Na+)
B.如果混合溶液的pH=7,则混合溶液中c(CH3COO-)>c(Na+)
C.如果混合溶液的pH<7,则a1b1=a2b2
D.如果a1=a2,且混合溶液的pH<7,则b1>b2
15.今有室温下四种溶液,下列有关叙述不正确的是( )
A.③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C.分别加水稀释10倍,四种溶液的pH:①>②>④>③
D.V1 L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1
>>
B.Na2C2O4溶液:
C.Na2CO3溶液:
D.CH3COONa和CaCl2混合溶液:
17.同物质的量浓度、同体积的HCl和醋酸溶液,分别与过量相同情况的Na2CO3固体反应时,下列叙述正确的是( )
A.反应速率HCl>CH3COOH
B.气泡逸出速率CH3COOH>HCl
C.在相同条件下两酸产生的CO2的体积不相同
D.如果两酸的c(H+)相同时,两酸的物质的量浓度HCl>CH3COOH
18.下列混合溶液中,各离子浓度的大小顺序正确的是( )
A.10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl-)>c(NH)>c(OH-)>c(H+)
B.10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=
c(Cl-)>c(OH-)>c(H+)
C.10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:
c(Cl-)>c(Na+)>c(OH-)>c(H+)
19.已知:某温度下,Ksp[Ca(OH)2]=5.5×10-6、Ksp[Mg(OH)2]=1.8×10-11、Ksp(AgCl)=1.8×10-10。相同条件下,在这三种物质的饱和溶液中,有关金属离子浓度的说法正确的是( )
A.Mg2+的浓度最小 B.Ca2+的浓度最小
C.Ag+的浓度最小
D.同一温度下,难溶电解质的Ksp越大,溶液中的金属离子的浓度也越大
20.25 ℃时,浓度均为0.1 mol/L的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是( )
A.BOH溶于水,其电离方程式是BOH===B++OH-
B.若一定量的上述两溶液混合后pH=7,则c(A-)=c(B+)
C.在0.1 mol/L BA溶液中,c(B+)>c(A-)>c(OH-)>c(H+)
D.若将0.1 mol/L BOH溶液稀释至0.001 mol/L,则溶液的pH=9
21. 常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
A. HA为强酸
B. 该混合液pH=7
C. 该混合溶液中:c(A-)+c(Y)=c(Na+)
D. 图中X表示HA,Y表示OH-,Z表示H+
22.下表是几种弱酸常温下的电离平衡常数:
CH3COOH
H2CO3
H2S
H3PO4
1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
K1=9.1×10-8
K2=1.1×10-12
K1=7.5×10-3
K2=6.2×10-8
K3=2.2×10-13
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释醋酸,增大
D.向弱酸溶液中加少量NaOH溶液,电离常数不变
23.pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH
溶液(c=0.1 mol·L-1)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则( )
A.x为弱酸,VxVy
C.y为弱酸,VxVy
24.298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·
L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是( )
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
25.常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与lg 的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,
c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
二、填空题(每空2分,共50分)
26.(10分)依据氧化还原反应:2Ag+(aq) + Cu(s)Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:
(1)电极X的材料是____________________;
电解质溶液Y是____________;
(2)银电极为电池的___________极,发生的电极反应为_____________________;X电极上发生的电极反应为_____________________。
27.(10分)已知,产物分子比原化合物分子多一个碳原子,增长了碳链。
分析如图变化,并回答有关问题:
(1)写出有关物质的结构简式:A:____________;C:________________。
(2)指出反应类型:C→D:___________;F→G:________________。
(3)写出下列反应的化学方程式:D+E→F:_________________;
28. 在一固定体积的密闭容器中,充入2 mol CO2和1 mol H2发生如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
T/℃
700
800
830
1 000
1 200
K
0.6
0.9
1.0
1.7
2.6
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_______________________。
(2)若反应在830 ℃下达到平衡,则CO2气体的转化率为________。
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度________(填“升高”、“降低”或“不能确定”)。
(4)能判断该反应是否达到化学平衡状态的依据是___________________。
A.容器内压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
E.c(CO2 )·c(H2)=c(CO)·c(H2O)
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2= 。
29.(10分)磷酸 (H3PO4)在溶液中能够以H3PO4、H2PO、HPO、和PO四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化。下图是H3PO4
溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
(1)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为________________________。当pH=7时,溶液中主要存在的阴离子(OH-离子除外)是_______________________________。
(2)从图中推断NaH2PO4溶液呈______性(填“酸”“碱”或“中”),其原因是___________。
(3)在Na3PO4溶液中,>3(填“>”“=”或“<”);向该溶液中滴入几滴浓KOH溶液后,的值减小,原因是_________________________。
30.(10分)实验测定H2C2O4·xH2O 中 x值: 已知:M(H2C2O4)=90 g·mol-1
① �称取 1.260 g H2C2O4·xH2O晶体,将其配成100.00 mL 水溶液为待测液;
②量取 25.00mL 待测液放入锥形瓶中,再加入适量的稀H2SO4;
③用20.00ml浓度为 0.05000 mol·L-1 的 KMnO4标准溶液进行滴定。
(提示:H2C2O4被氧化为CO2 , KMnO4被还原为MnSO4)
(1)请写出与滴定有关反应的化学方程式 。
(2)某学生的滴定方式(夹持部分略去)如下,最合理的是 (选填 a、b)。
(3)滴定过程中眼睛应注视______________________。
(4)通过上述数据,求得x= 。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,引起实验结果 (偏大、偏小或没有影响)。
奋斗中学2018—2019年第二学期期中考试题
高二化学答案
一、 选择题(每题2分,共50分)
1
2
3
4
5
6
7
8
9
10
11
12
13
C
C
D
A
B
C
B
D
A
D
A
B
B
14
15
16
17
18
19
20
21
22
23
24
25
D
D
B
A
B
C
B
C
C
C
D
D
二、填空题(每空2分,共50分)
26.(1)Cu AgNO3溶液 (2)正 Ag++e−Ag Cu−2e−Cu2+
27.
28.(1) (2)33.3% (3)降低 (4)BC (5)-1160 kJ·mol-1
29.(1)HPO+H+===H2PO H2PO和HPO (2)酸 H2PO在溶液中的电离程度大于水解程度 (3) KOH抑制了PO的水解
30.(1)5H2C2O4+2KMnO4+3H2SO4===10CO2↑+2MnSO4+8H2O+K2SO4
(2)b (3)锥形瓶中颜色变化 (4)2 偏小