- 2021-07-09 发布 |
- 37.5 KB |
- 21页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年辽宁省六校协作体高二下学期期中考试化学试题 解析版
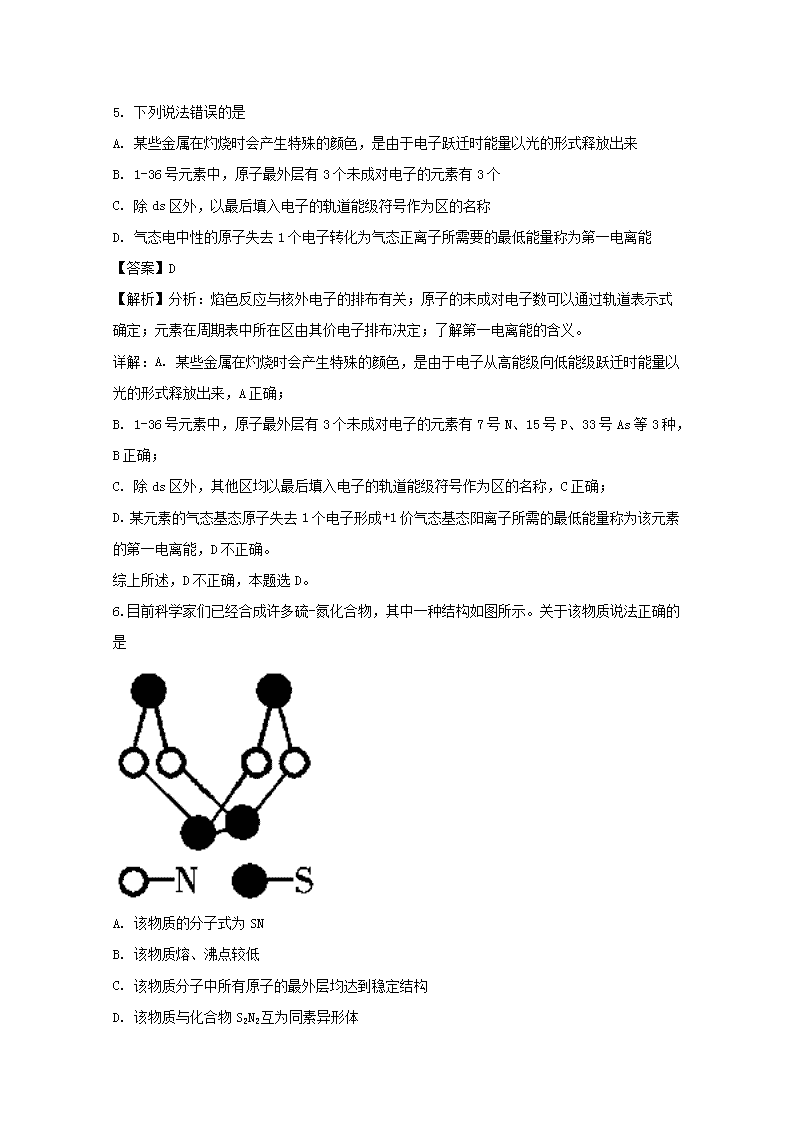
辽宁省六校协作体2017-2018学年高二下学期期中考试 化学试题 1. 闪烁着银白色光泽的金属钛(22Ti)因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域,号称“崛起的第三金属”。已知钛有48Ti、49Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是 A. 上述钛原子中,中子数不可能为22 B. 钛元素在周期表中处于第四周期 C. 钛的不同同位素在周期表中处于不同的位置 D. 钛元素是d区的过渡元素 【答案】C 【解析】分析:根据原子的质量数和质子数可以求出其中子数,根据其核外电子的排布可以确定其在元素周期表中的位置。 详解:A. 上述钛原子中,48Ti、49Ti、50Ti的中子数分别为26、27、28,故其中子数不可能为22,A正确; B. 钛原子的价电子排布式为3d24s2,故其在周期表中处于第四周期,B正确; C.钛的不同同位素的质子数和核外电子排布相同,故在元素周期表中处于相同的位置,C不正确; D. 钛元素的原子核外价电子排布式为3d24s2,故钛是d区的过渡元素。 综上所述,关于金属钛的叙述中不正确的是C,本题选C。 点睛:原子的质量数等于其质子数与中子数的和。根据价电子排布式可以确定元素在元素周期表中的位置及所属的区,如根据钛原子价电子排布式3d24s2,可以确定其位于第4周期第IVB族、d区。过渡元素指的是7个副族和第VIII族的所有元素,全部是金属。 2. 化学与生活密切相关。下列说法正确的是 A. 碘是人体必需微量元素,所以要多吃富含碘的食物 B. 为使水果尽快成熟,需要用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯 C. 液态植物油中有碳碳双键,与氢气加成后可以形成人造脂肪,摄入过多对人体无害 D. 加热能杀死流感病毒是因为蛋白质受热变性 【答案】D 【解析】分析:了解人体的重要微量元素;乙烯可以被酸性高锰酸钾溶液氧化;过量食用油脂易导致肥胖;杀菌消毒的原理是通过物理或化学方法使蛋白质变性。 详解:A. 碘是人体必需微量元素,要适量食用富含碘的食物,过量摄入碘元素对人体也是不利的,A不正确; B. 为使水果尽快成熟,可以使用一些能释放出乙烯的物质对水果催熟,若用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯,则可对水果保鲜、防止水果熟得过快而腐烂,B不正确; C. 液态植物油中有碳碳双键,与氢气加成后可以形成人造脂肪,摄入过多对人体有害,如导致肥胖等等,C不正确; D. 加热能杀死流感病毒是因为蛋白质受热变性,变性后的蛋白质失去生理活性,故病毒不再有害,D正确。 综上所述,本题选D。 3. 下列各组中的物质均能发生加成反应的是 A. 乙烯和乙醇 B. 苯和聚乙炔 C. 乙酸和溴乙烷 D. 丙炔和聚氯乙烯 【答案】B 【解析】分析:含有碳碳双键、碳碳叁键、苯环、醛基等官能团的有机物可以发生加成反应,但是饱和一元羧酸、饱和一元酯不能发生加成反应。 详解:A.乙醇分子中全部是单键,故不能发生加成反应; B. 苯分子中有苯环,聚乙炔分子中有碳碳双键,故其均可发生加成反应; C. 乙酸是饱和一元羧酸,溴乙烷分子中只有单键,故两者均不能发生加成反应; D. 丙炔分子中有碳碳叁键,聚氯乙烯分子中只有单键,故聚氯乙烯不能发生加成反应。 综上所述,各组中的物质均能发生加成反应的是B,本题选B。 4. 下列各组中的反应,属于同一反应类型的是 A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 C. 由氯代环己烷消去制环己烯;由丙烯加溴制1,2-二溴丙烷 D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 【答案】D 【解析】A、卤代烃的水解属于取代反应,丙烯与水发生加成反应,故A错误;B、甲苯的硝化属于取代反应 ,甲苯氧化成苯甲酸属于氧化反应,故B错误;C、氯代环己烷生成环己烯,属于消去反应,丙烯生成1,2-二溴丙烷,属于加成反应,故C错误;D、乙酸与乙醇发生酯化反应(或取代反应)生成乙酸乙酯,苯甲酸乙酯的水解属于取代反应,故D正确。 5. 下列说法错误的是 A. 某些金属在灼烧时会产生特殊的颜色,是由于电子跃迁时能量以光的形式释放出来 B. 1-36号元素中,原子最外层有3个未成对电子的元素有3个 C. 除ds区外,以最后填入电子的轨道能级符号作为区的名称 D. 气态电中性的原子失去1个电子转化为气态正离子所需要的最低能量称为第一电离能 【答案】D 【解析】分析:焰色反应与核外电子的排布有关;原子的未成对电子数可以通过轨道表示式确定;元素在周期表中所在区由其价电子排布决定;了解第一电离能的含义。 详解:A. 某些金属在灼烧时会产生特殊的颜色,是由于电子从高能级向低能级跃迁时能量以光的形式释放出来,A正确; B. 1-36号元素中,原子最外层有3个未成对电子的元素有7号N、15号P、33号As等3种,B正确; C. 除ds区外,其他区均以最后填入电子的轨道能级符号作为区的名称,C正确; D. 某元素的气态基态原子失去1个电子形成+1价气态基态阳离子所需的最低能量称为该元素的第一电离能,D不正确。 综上所述,D不正确,本题选D。 6. 目前科学家们已经合成许多硫-氮化合物,其中一种结构如图所示。关于该物质说法正确的是 A. 该物质的分子式为SN B. 该物质熔、沸点较低 C. 该物质分子中所有原子的最外层均达到稳定结构 D. 该物质与化合物S2N2互为同素异形体 【答案】B ........................ 7. 有四组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如下表所示: 第一组 A -268.8 B -249.5 C -185.8 D -151.7 第二组 F2 -187.0 Cl2 -33.6 Br2 58.7 I2 184.0 第三组 HF 19.4 HCl -84.0 HBr -67.0 HI -35.3 第四组 H2O 100.0 H2S -60.2 H2Se -42.0 H2Te -1.8 下列各项判断正确的是 A. 第四组物质中H2O的沸点最高,是因为H2O分子中化学键键能最强 B. 第三组与第四组相比较,化合物的稳定性顺序为:HBr>H2Se C. 第三组物质溶于水后,溶液的酸性:HF>HCl>HBr>HI D. 第一组物质是分子晶体,一定含有共价键 【答案】B 【解析】分析:根据物质的沸点高低可以判断其晶体类型。由表中数据可知,,表中所有物质沸点较低,故其均可形成分子晶体。根据元素的非金属性强弱可以判断其气态氢化物的稳定性。对于分子组成相似的物质,若分子间能形成氢键,则其沸点要高于不能形成分子间氢键的。 详解:A. 第四组物质中H2O的沸点最高,是因为H2O分子之间可以形成氢键,A不正确; B. Se和Br同为第4周期元素,Br的非金属性较强,故化合物的稳定性顺序为HBr>H2Se,B正确; C. 第三组物质溶于水后,HF溶液的酸性最弱,因为氢氟酸是弱酸、其他均为强酸,C不正确; D. 第一组物质是分子晶体,其结构粒子为分子,但是,分子中不一定含有共价键,如稀有气体分子中无共价键,D不正确。 综上所述,各项判断正确的是B,本题选B。 8. 关于化合物,下列叙述正确的是( ) A. 分子间可形成氢键 B. 分子中既有极性键又有非极性键 C. 分子中有7个σ键和1个π键 D. 该分子在水中的溶解度小于2丁烯 【答案】B 【解析】分析:由的分子结构可知,该有机物分子中有1个碳碳双键、2个醛基,醛基中有碳氧双键,双键由1个个σ键和1个π键构成,碳碳键为非极性键,其他键为极性键。组成元素只有C、H、O等 3种,因为分子中无羟基,故不能形成氢键,但可以与水分子间形成氢键。 详解:A. 分子间不能形成氢键,A不正确; B. 分子中碳碳键为非极性键,其他键为极性键,故该分子既有极性键又有非极性键,B正确; C. 分子中有9个σ键和3个π键,C不正确; D. 该分子可以与水分子间形成氢键,而2丁烯不能,故其在水中的溶解度大于2丁烯,D不正确。 综上所述,叙述正确的是B,本题选B。 9. 设阿伏加德罗常数的值为NA,下列结论错误的是 A. 完全电解2 mol H2O断裂的σ键键数为4NA B. 标准状况下,11.2 L CO2中含有的π键键数为2NA C. 60 g SiO2晶体中含有的Si—O键键数为4NA D. 128 g金属铜中含有如图所示的晶胞数为0.5NA 【答案】B 【解析】A、水的结构式为H-O-H,因此完全电解2 mol H2O断裂的σ键键数为4NA,A正确;B、一个CO2中含有2个碳氧双键,每个碳氧双键中含一个π键,故11.2 L CO2中含有的π键键数为NA,B错误;C、二氧化硅晶体中一个硅原子形成4个Si-O键,60 g SiO2晶体的物质的量是1mol,其中含有的Si-O键键数为4NA,C正确;D、晶胞中含有8×1/8+6×1/2=4个铜原子,128 g金属铜的物质的量是2mol,其中含有如图所示的晶胞数为0.5NA,D正确,答案选B。 10. 下列化合物中含有2个手性碳原子的是 A. B. C. D. 【答案】B 考点:考查手性碳原子的定义及判断的知识。 11. 化合物中,稀土元素最常见的化合价是+3 ,但也有少数的稀土元素可以显示+4价,观察下面四种稀土元素的电离能数据,判断最有可能显示+4价的稀土元素是 (几种稀土元素的电离能(单位:KJ/mol)) 元素 I1 I2 I3 I4 A.Se(钪) 633 1235 2389 7019 B.Y(铱) 616 1181 1980 5963 C.La(镧) 538 1067 1850 4819 D.Ce(铈) 527 1047 1949 3547 A. A B. B C. C D. D 【答案】D 【解析】分析:某元素的气态原子失去1个电子形成+1价气态阳离子所需的最低能量称为该元素的第一电离能,再失去第2个电子形成+2价气态阳离子所需要的最低能量为第二电离能,依此类推,第三电离能、第四电离能、第n电离能。N值越大,其对应的电离能数值越大,但是相邻的两级电离能之间的差值是不同的,通常失去同一能级的电子所需的能量相差不大,失去不同能级的电子所需的能量相差较大,据此可以判断元素可能表现的化合价。 详解:根据表中数据可知,Se、Y、La等3种元素的第三电离能与第四电离能的差值较大,故其可以显示+3价,Ce元素的第三电离能与第四电离能差距最小,所以Ce元素最可能有+4价。D符合题意,本题选D。 点睛:相邻两级电离能差值较小的,说明对应的电子在同一能级中,相差较大的在不同能级,科学家通过研究电离能的数据把核外电子分成不同的电子层和不同的能级,确定原子的价电子数及元素的主要化合价。 12. 下列有关离子晶体的数据大小比较不正确的是 A. 熔点:NaF>MgF2>AlF3 B. 晶格能:NaF>NaCl>NaBr C. 阴离子的配位数:CsCl>NaCl>CaF2 D. 硬度:MgO>CaO>BaO 【答案】A 【解析】A. 离子半径越小,离子所带电荷越多,离子晶体熔点越高,所以熔点:NaF查看更多