备战2021 高考化学 考点40 化学平衡常数及转化率(原卷版)
考点 40 化学平衡常数及转化率
1.化学平衡常数
(1)定义
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个
常数,这个常数就是该反应的化学平衡常数(简称平衡常数),用 K 表示。
(2)表达式
对于一般的可逆反应:mA(g)+nB(g) pC(g)+qD(g),K= (C) (D)
(A) (B)
p q
m n
c c
c c
。
(3)应用
①判断反应进行的限度
K 值大,说明反应进行的程度大,反应物的转化率高。K 值小,说明反应进行的程度小,反应物的转化
率低。
K <10−5 10−5~105 >105
反应程度 很难进行 反应可逆 反应可接近完全
②判断反应是否达到平衡状态
化学反应 aA(g)+bB(g) cC(g)+dD(g)在任意状态时,浓度商均为 Qc= (C) (D)
(A) (B)
c d
a b
c c
c c
。
Qc>K 时,反应向逆反应方向进行;
Qc=K 时,反应处于平衡状态;
Qc
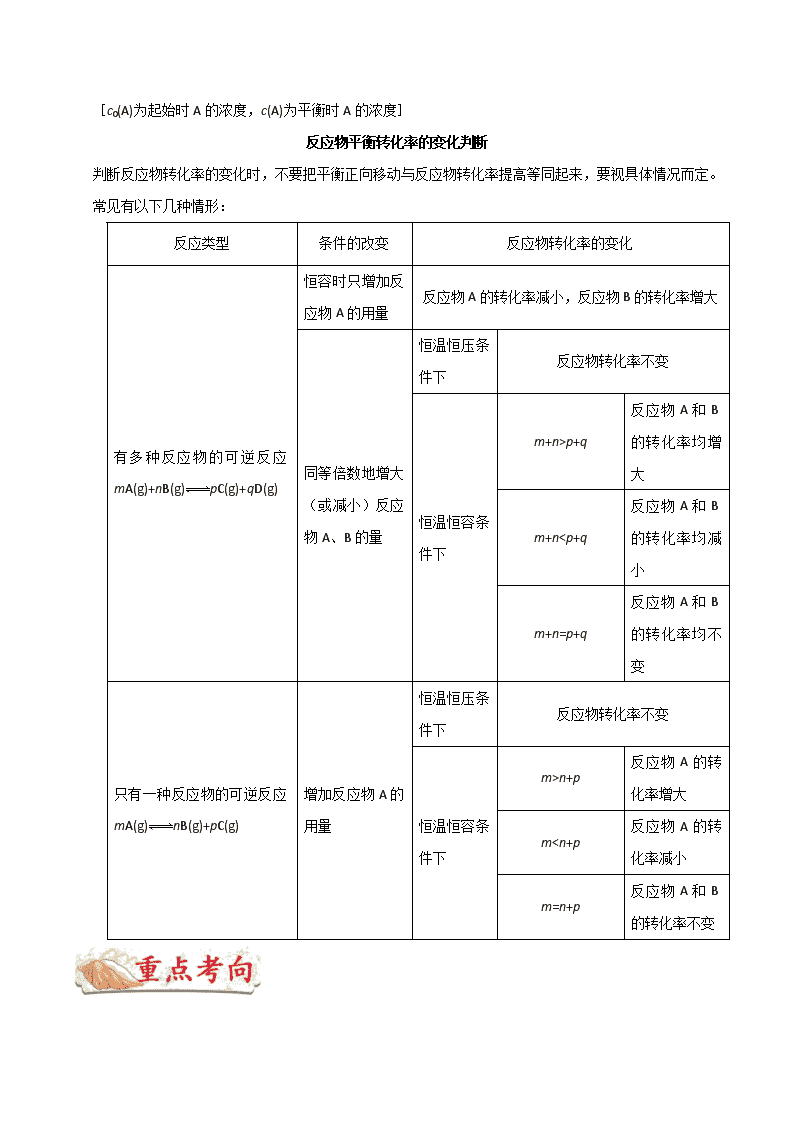
p+q
反应物 A 和 B
的转化率均增
大
m+nn+p
反应物 A 的转
化率增大
m0H
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述体系中加入苯,平衡不移动
D.25℃时,向溶液中加入少量 KI 固体,平衡常数 K 小于 680
平衡常数的几个易错点
(1)正、逆反应的平衡常数互为倒数;若方程式中各物质的化学计量数等倍扩大或缩小,尽管是同一
反应,平衡常数也会改变。
(2)能代入平衡常数表达式的为气体、非水溶液中的 H2O、溶液中的溶质,固体与纯液体以及溶液中
H2O 的浓度可看为常数,不能代入。
考向二 化学平衡常数的计算与应用
典例 2 在一定体积的密闭容器中,进行化学反应 CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数 K 和
温度 T 的关系如表:
T/℃ 700 800 830 1 000 1 200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
(1)该反应的化学平衡常数表达式 K= 。
(2)该反应为 (填“吸热”或“放热”)反应。
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度
为 。
(4)若 830 ℃时,向容器中充入 1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数 K (填
“大于”“小于”或“等于”)1.0。
(5)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积,平衡 (填
“向正反应方向”“向逆反应方向”或“不”)移动。
(6)若 1 200 ℃时,在某时刻平衡体系中 CO2、H2、CO、H2O 的浓度分别为 2 mol·L−1、2 mol·L−1、4 mol·L−1、
4 mol·L−1,则此时上述反应的平衡移动方向为 (填“正反应方向”“逆反应方向”或“不移动”)。
2.(1)在一定条件下 CO(g)+H2O(g) CO2(g)+H2(g),当 CO 与 H2O(g)的起始
物质的量之比为 1∶5,达平衡时,CO 转化了5
6
。若 a kg 含 Ca5(PO4)3F(相对分子质量为 504)的质量分数
为 10%的磷尾矿,在上述过程中有 b%的 Ca5(PO4)3F 转化为 P4,将产生的 CO 与 H2O(g)按起始物质的
量之比 1∶3 混合,则在相同条件下达平衡时能产生 H2________kg。[已知:4Ca5(PO4)3F+18SiO2+
30C 2CaF2+30CO+18CaSiO3+3P4]
(2)乙苯催化脱氢制苯乙烯反应:
CH2CH3(g) CH=CH2(g)+H2(g)
维持体系总压 p 恒定,在温度 T 时,物质的量为 n、体积为 V 的乙苯蒸气发生催化脱氢反应。已知乙苯
的平衡转化率为α,则在该温度下反应的平衡常数 K=________(用α等符号表示)。
考向三 转化率的计算与比较
典例 3 已知可逆反应:M(g)+N(g) P(g)+Q(g) ΔH>0,请回答下列问题。
(1)某温度下,反应物的起始浓度分别为 c(M)=1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M 的转
化率为 60%,此时 N 的转化率为________。
(2)若反应温度不变,反应物的起始浓度分别为 c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)
=2 mol·L-1,a=________。
(3)若反应温度不变,反应物的起始浓度为 c(M)=c(N)=b mol·L-1,达到平衡后,M 的转化率为_____。
3.甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由 CH3NH2、PbI2 及 HI 为原料合
成,回答下列问题:
(1)上述反应中所需的甲醇工业上利用水煤气合成 CO(g)+2H2(g) CH3OH(g) ΔH<0。在一定条件下,将 1
mol CO 和 2 mol H2 通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH 的平衡体积分
数φ(CH3OH)变化趋势如图所示:
①平衡时,M 点 CH3OH 的体积分数为 10%,则 CO 的转化率为_________。
②X 轴上 a 点的数值比 b 点_________(填“大”或“小”)。某同学认为上图中 Y 轴表示温度,你认为他判断的
理由是_________。
1.O3 是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3 可溶于水,在水中易分解,产生的[O]
为游离氧原子,有很强的杀菌消毒能力。常温常压下发生的反应如下:
反应① O3 O2+[O] ΔH>0 平衡常数为 K1;
反应② [O]+O3 2O2 ΔH<0 平衡常数为 K2;
总反应:2O3 3O2 ΔH<0 平衡常数为 K。
下列叙述正确的是
A.降低温度,总反应 K 减小
B.K=K1+K2
C.适当升温,可提高消毒效率
D.压强增大,K2 减小
2.只改变一个影响化学平衡的因素,平衡常数 K 与化学平衡移动的关系叙述不正确的是
A.K 值不变,平衡可能移动
B.平衡向右移动时,K 值不一定变化
C.K 值有变化,平衡一定移动
D.相同条件下,同一个反应的方程式的化学计量数增大 2 倍,K 值也增大两倍
3.在一密闭容器,aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,
B 的浓度是原来的 60%,则
A.平衡向逆反应方向移动了
B.物质 A 的转化率减少了
C.物质 B 的质量分数增加了
D.a>b
4.将 1 mol N2O5 置于 2 L 密闭容器中,在一定温度下发生下列反应:①2N2O5(g) 2N2O4(g)+O2(g);②
N2O4(g) 2NO2(g)。达到平衡时,c(O2)=0.2 mol·L-1,c(NO2)=0.6 mol·L-1,则此温度下反应①的平
衡常数为
A.3.2 B.0.2
C. 1
180 D. 4
45
5.已知反应 X(g)+Y(g) R(g)+Q(g)的平衡常数与温度的关系如表所示。830℃时,向一个 2 L 的密闭
容器中充入 0.2 mol X 和 0.8 mol Y,反应初始 4 s 内 v(X)=0.005 mol/(L·s)。下列说法正确的是
温度/℃ 700 800 830 1 000 1 200
平衡常数 1.7 1.1 1.0 0.6 0.4
A.4 s 时容器内 c(Y)=0.76 mol/L
B.830℃达平衡时,X 的转化率为 80%
C.反应达平衡后,升高温度,平衡正向移动
D.1 200℃时反应 R(g)+Q(g) X(g)+Y(g)的平衡常数 K=0.4
6.一定条件下,反应 2NH3(g) N2(g)+3H2(g) ΔH>0 达到平衡时 N2 的体积分数与温度、压强的关系
如图所示。下列说法正确的是
A.压强:p1>p2
B.b、c 两点对应的平衡常数:Kc>K b
C.a 点:2v(NH3)正=3v(H2)逆
D.a 点:NH3 的转化率为 1/3
7.乙炔是一种重要的化工原料,最新研制出的由裂解气(H2、CH4、C2H4)与煤粉在催化剂条件下制乙炔,
该生产过程是目前清洁高效的煤化工过程。已知:发生的部分反应如下(在 25℃、 101 kPa 时),CH4、C2H4
在高温条件还会分解生成炭与氢气:
①C(s) +2H2(g) CH4(g) ΔH1=-74.85kJ•mol-1
②2CH4(g) C2H4(g) +2H2(g) ΔH2=+340.93kJ•mol-1
③C2H4(g) C2H2(g) +H2(g) ΔH3=+35.50kJ•mol-1
请回答:
(1)依据上述反应,请写出 C 与 H2 化合生成 C2H2 的热化学方程式_____。
(2)若以乙烯和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气
中含有乙烯、乙炔、氢气等。图 1 为乙炔产率与进料气中 n(氢气)/n(乙烯)的关系。图中曲线呈现先升高
后降低的变化趋势,其降低的原因是_____。
(3)图 2 为上述诸反应达到平衡时各气体体积分数和反应温度的关系曲线。
①乙炔体积分数在 1530℃之前随温度升高而增大的原因可能是_____;1530℃之后,乙炔体积分数增加不
明显的主要原因可能是_____。
②在体积为 1L 的密闭容器中反应,1530℃时测得气体的总物质的量为 1.000 mol,则反应
C2H4(g) C2H2(g) +H2(g) 的平衡常数 K=_____。
③请在图 3 中绘制乙烯的体积分数和反应温度的关系曲线______
8.催化还原 CO2 是解决温室效应及能源问题的重要手段之一。研究表明,在 Cu/ZnO 催化剂存在下,在 CO2
中通入 H2,二者可发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
反应Ⅱ CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
某实验室控制一定的 CO2 和 H2 初始投料比,在相同压强下,经过相同反应时间测得如下实验数据(其中“甲
醇选择性”是指转化的 CO2 中生成甲醇的百分比):
反应序号 T/K 催化剂 CO2 转化率/% 甲醇选择性/%
① 543 Cu/ZnO 纳米棒 12.3 42.3
② 543 Cu/ZnO 纳米片 10.9 72.7
③ 553 Cu/ZnO 纳米棒 15.3 39.1
④ 553 Cu/ZnO 纳米片 12.0 71.6
(1)CO2 的电子式是_____________。
(2)反应Ⅰ的平衡常数表达式是 K=_________________________。
(3)对比①和③可发现:同样催化剂条件下,温度升高,CO2 转化率升高, 而甲醇的选择性却降低,
请解释甲醇选择性降低的可能原因__________________________________;对比①、②可发现,在同样
温度下,采用 Cu/ZnO 纳米片使 CO2 转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的
可能原因_______________________________。
(4)有利于提高 CO2 转化为 CH3OH 平衡转化率的措施有________。
a.使用 Cu/ZnO 纳米棒做催化剂
b.使用 Cu/ZnO 纳米片做催化剂
c.降低反应温度
d.投料比不变,增加反应物的浓度
e.增大 CO2 和 H2 的初始投料比
9.CO2 和 CH4 是两种重要的温室气体,通过 CH4 和 CO2 反应制造具有更高价值的化学品是目前的研究方向。
(1)250 ℃时,以镍合金为催化剂,涉及此研究的某反应的平衡常数 K=
2 2
2
2 4
CO H
CO CH
c c
c c
,则此反应的
化学方程式为 ;又知此反应的逆反应为放热反应,则一定能使此反应的平
衡常数增大的措施是 (填选项字母);使该反应的平衡一定向正反应方向移动的措施有
(填选项字母)。
A.增大 CO2 的浓度 B.升高温度 C.降低温度
D.增大压强 E.减小压强
(2)用某种特殊催化剂,可以将 CO2 和 CH4 直接转化成乙酸,温度超过某个值时乙酸的生成速率却减
小了,原因是 。
(3)将 CO2 转化为甲醚的反应原理为 2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(l)。
①已知一定压强下,该反应在不同温度、不同投料比时,CO2 的转化率如表:
投料比[n(H2)/n(CO2)] 500 K 600 K 700 K
1.5 45% 33% 20%
x a b c
上述反应的焓变ΔH (填“>”、“<”或“=”,下同)0,ΔS 0,若 a>45%,则 x 1.5。
②在 80 ℃时,向体积为 0.5 L 的密闭容器中加入 2 mol CO2 和 6 mol H2,20 min 后反应达到平衡,此时
CH3OCH3 的物质的量为 0.5 mol,则该反应的平均反应速率 v(CO2)= mol·L-1·min-1,H2 的转化
率α(H2)= ,在 80 ℃时该反应的化学平衡常数为 (列出计算式即可)。
2.(2020·浙江高考真题)一定温度下,在 2 L 的恒容密闭容器中发生反应 A(g) 2B(g) 3C(g) 。反
应过程中的部分数据如下表所示:
n/mol
t/min
n(A) n(B) n(C)
0 2.0 2.4 0
5 0.9
10 1.6
15 1.6
下列说法正确的是( )
A.0~5 min 用 A 表示的平均反应速率为 1 10.09 mol L min
B.该反应在 10 min 后才达到平衡
C.平衡状态时, 1c(C) 0.6 mol L
D.物质 B 的平衡转化率为 20%
3.[2019江苏][双选]在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转
化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法
正确的是
A.反应2NO(g)+O2(g) 2NO2(g)的ΔH>0
B.图中X点所示条件下,延长反应时间能提高NO转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D.380℃下,c 起始(O2)=5.0×10−4 mol·L−1,NO 平衡转化率为 50%,则平衡常数 K>2000
4.[2018 江苏]一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应 2SO2(g)+
O2(g) 2SO3(g)(正反应放热),测得反应的相关数据如下:
下列说法正确的是
A.v1< v2,c2< 2c1 B.K1> K3,p2> 2p3
C.v1< v3,α1(SO2 ) >α3(SO2 ) D.c2> 2c3,α2(SO3 )+α3(SO2 )<1
5.[2017 天津]常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g) Ni(CO)4(g)。230℃时,该反应的平衡常
数 K=2×10−5。已知:Ni(CO)4 的沸点为 42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与 CO 反应转化成气态 Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至 230℃制得高纯镍。
下列判断正确的是
A.增加 c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在 30℃和 50℃两者之间选择反应温度,选 50℃
C.第二阶段,Ni(CO)4 分解率较低
D.该反应达到平衡时,v 生成[Ni(CO)4]=4v 生成(CO)
6.[2019 新课标Ⅲ节选]近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增
长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon 发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比
c(HCl) ∶c(O2)分别等于 1∶1、4∶1、7∶1 时 HCl 平衡转化率随温度变化的关系:
可知反应平衡常数 K(300℃)____________K(400℃)(填“大于”或“小于”)。设 HCl 初始浓度
为 c0,根据进料浓度比 c(HCl)∶c(O2)=1∶1 的数据计算 K(400℃)=____________(列出计算式)。
按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比 c(HCl)∶c(O2)
过低、过高的不利影响分别是____________。
(2)Deacon 直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+ 1
2 Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+ 1
2 O2(g)=CuO(s)+ 1
2 Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则 4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
(3)在一定温度的条件下,进一步提高 HCl 的转化率的方法是______________。(写出 2 种)
7.[2017 新课标Ⅰ节选]近期发现,H2S 是继 NO、CO 之后的第三个生命体系气体信号分子,它具有参与调
节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(3)H2S 与 CO2 在高温下发生反应:H2S(g)+CO2(g) COS(g) +H2O(g)。在 610 K 时,将 0.10 mol CO2
与 0.40 mol H2S 充入 2.5 L 的空钢瓶中,反应平衡后水的物质的量分数为 0.02。
①H2S 的平衡转化率 1 =_______%,反应平衡常数 K=________。
②在 620 K 重复试验,平衡后水的物质的量分数为 0.03,H2S 的转化率 2 _____ 1 ,该反应的 H_____0。
(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使 H2S 转化率增大的是________(填标号)
A.H2S B.CO2 C.COS D.N2
8.[2016 上海]随着科学技术的发展和环保要求的不断提高,CO2 的捕集利用技术成为研究的重点。
完成下列填空:
(1)目前国际空间站处理 CO2 的一个重要方法是将 CO2 还原,所涉及的反应方程式为:
CO2(g)+4H2(g) CH4(g)+2H2O(g)
已知 H2 的体积分数随温度升高而增加。
若温度从 300℃升至 400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”
或“不变”)
v 正 v 逆 平衡常数 K 转化率α
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L−1 [H2]/mol·L−1 [CH4]/mol·L−1 [H2O]/mol·L−1
平衡Ⅰ a b c d
平衡Ⅱ m n x y
a、b、c、d 与 m、n、x、y 之间的关系式为_________。
9.[2016 新课标全国Ⅲ节选]煤燃烧排放的烟气含有 SO2 和 NOx,形成酸雨、污染大气,采用 NaClO2 溶液
作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(2)在鼓泡反应器中通入含有 SO2 和 NO 的烟气,反应温度为 323 K,NaClO2 溶液浓度为 5×10−3 mol·L−1。
反应一段时间后溶液中离子浓度的分析结果如下表。
离子 2
4SO 2
3SO
3NO
2NO Cl−
c/(mol·L−1) 8.35×10−4 6.87×10−6 1.5×10−4 1.2×10−5 3.4×10−3
①写出 NaClO2 溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO 的转化率______(填
“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的 pH 逐渐______(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了 SO2 和 NO
在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2 溶液脱硫、脱硝的反应中,SO2 和 NO 的平衡分压 pe 如图所示。
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”
或“减小”)。
②反应 ClO2−+2 2
3SO 2 2
4SO +Cl−的平衡常数 K 表达式为___________。