- 2021-07-09 发布 |
- 37.5 KB |
- 25页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高三化学复习专题-有机实验+模拟测试题+水溶液中的离子平衡+常见气体习题有答案
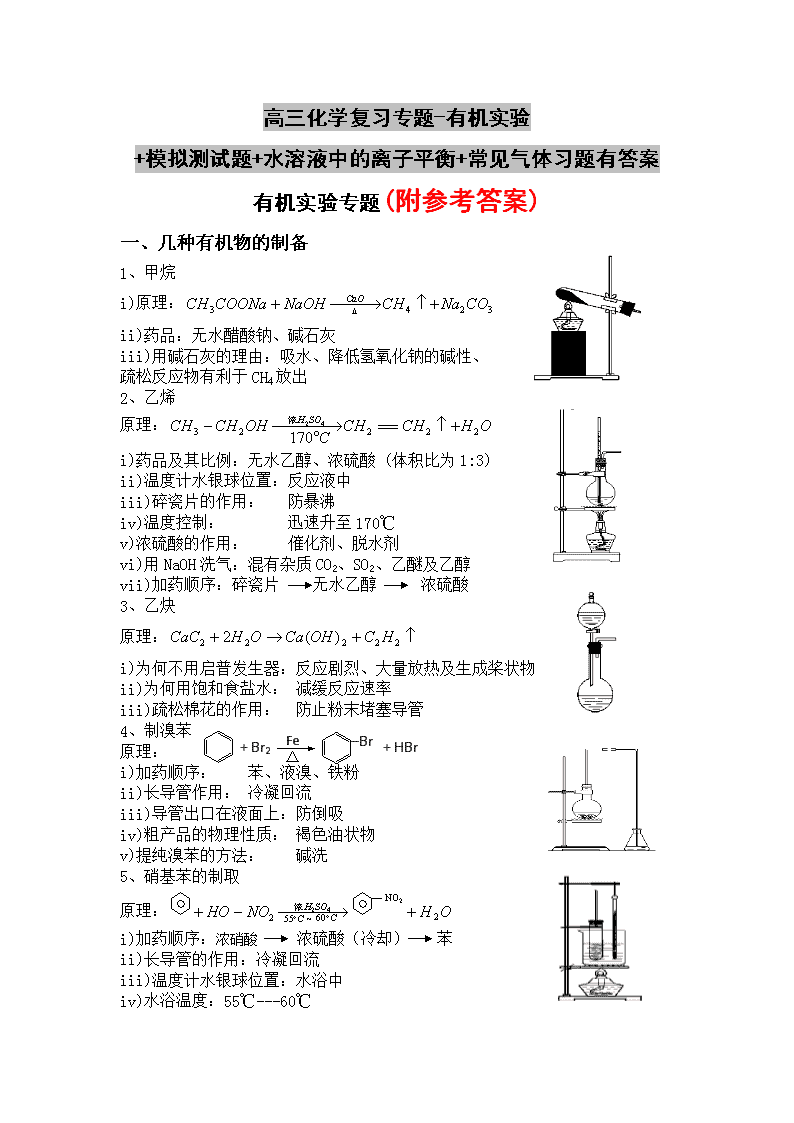
高三化学复习专题-有机实验 +模拟测试题+水溶液中的离子平衡+常见气体习题有答案 有机实验专题(附参考答案) 一、几种有机物的制备 1、甲烷 i)原理: 3243 CONaCHNaOHCOONaCH CaO ii)药品:无水醋酸钠、碱石灰 iii)用碱石灰的理由:吸水、降低氢氧化钠的碱性、 疏松反应物有利于 CH4 放出 2、乙烯 原理: C OHCHCHOHCHCH SOH 170 22223 42浓 i)药品及其比例:无水乙醇、浓硫酸 (体积比为 1:3) ii)温度计水银球位置:反应液中 iii)碎瓷片的作用: 防暴沸 iv)温度控制: 迅速升至 170℃ v)浓硫酸的作用: 催化剂、脱水剂 vi)用 NaOH 洗气:混有杂质 CO2、SO2、乙醚及乙醇 vii)加药顺序:碎瓷片 无水乙醇 浓硫酸 3、乙炔 原理: 22222 )(2 HCOHCaOHCaC i)为何不用启普发生器:反应剧烈、大量放热及生成桨状物 ii)为何用饱和食盐水: 减缓反应速率 iii)疏松棉花的作用: 防止粉末堵塞导管 4、制溴苯 原理: i)加药顺序: 苯、液溴、铁粉 ii)长导管作用: 冷凝回流 iii)导管出口在液面上:防倒吸 iv)粗产品的物理性质: 褐色油状物 v)提纯溴苯的方法: 碱洗 5、硝基苯的制取 原理: CC SOHNOHO 60~552 42浓 NO2 OH 2 i)加药顺序:浓硝酸 浓硫酸(冷却) 苯 ii)长导管的作用:冷凝回流 iii)温度计水银球位置:水浴中 iv)水浴温度:55℃---60℃ + Br2 + HBr─BrFe △ v)粗产品的性质:淡黄色油状,密度比水大比混合酸小 vi)如何提纯: 碱洗 6、酚醛树脂的制取 原理: n OH )( 2 HOnCH 催 OH CH2 n OnH 2 i)沸水浴 ii)长导管的作用:冷凝回流、导气 iii)催化剂: 浓盐酸(或浓氨水) iv)试管清洗: 酒精浸泡 7、酯化反应 原理: CH3 C OH O +H 18OC2H5 浓H2SO4 CH3 C O 18OC2H5 +H2O i)加药顺序:乙醇 浓硫酸 醋酸 ii)导管口在液面上:防倒吸 iii) 浓硫酸的作用:催化剂、脱水剂 iv)长导管作用:冷凝 v)饱和碳酸钠:吸收乙醇、乙酸,降低乙酸乙酯的溶解度 小结:相似实验的比较 ①水浴温度比较:制硝基苯、制苯磺酸、制酚醛树脂、乙酸乙酯水解 ②温度计水银球的位置的比较: 制乙烯、制硝基苯、石油蒸馏、溶解度测定 ③导管冷凝回流:制溴苯、制硝基苯、制酚醛树脂 只冷凝:制乙酸乙酯、 石油蒸馏(冷凝管) 二、有机物的性质实验 ㈠ 银镜反应 含有醛基的烃的衍生物: (1)醛类 (2)甲酸、甲酸盐、甲酸酯(3)醛糖(葡萄糖、麦芽糖) (4)不含醛基的果糖也可以发生银镜反应 实验要点 1、银氨溶液的制备: 稀 AgNO3 溶液中滴加稀氨水至沉淀恰好消失。 Ag++NH3·H2O = AgOH↓+NH4+ AgOH+2NH3·H2O = [Ag(NH3)2]++OH-+2H2O 2、反应原理: OHNHAgRCOONHOHNHAgRCHO 23423 32])([2 水溶 3、反应条件:水浴加热 4、反应现象:光亮的银镜 5、注意点:(1)试管内壁洁净,(2)碱性环境 高考理综化学模拟卷(附参考答案) 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 第Ⅰ卷(选择题,共 126 分) 一、选择题(本题共 13 小题,共计 78 分。在每小题给出的四个选项中,只有一个选项正 确.) 7.下列叙述正确的是( ) A.用核磁共振氢谱可以鉴别l一溴丙烷和2一溴丙烷 B.对于可逆反应N2(g)+3H2(g) 2NH3(g),增大氮气浓度可增加活化分子百分数,从 而使反应速率增大 C.将AlCl3溶液和NaAl02溶液分别蒸干后灼烧,所得固体产物均为Al2O3 D.BaS04在同物质的量浓度的硫酸钠和硫酸铝溶液中的溶解度相同 8.下列离子方程式书写正确的是( ) A.NaHSO4 溶液与 Ba(OH)2 溶液反应至中性:H++SO4 2-+Ba2++OH- = BaSO4↓+H2O B.NaClO 溶液与 FeCl2 溶液混合:Fe2+ + 2ClO- + 2H2O = Fe(OH)2↓ + 2HClO C.NH4HSO3 溶液与足量 NaOH 溶液反应:NH4 + + OH-= NH3↑ + H2O D.将 1mol/L NaAlO2 溶液和 1.5mol/L 的 HCl 溶液等体积均匀混合: 6AlO2 -+9H++3H2O=5Al(OH)3↓+Al3+ 9.下列实验操作正确且能达到预期目的的是( ) 实验目的 操 作 1 比较水和乙醇中羟基氢的活泼性强弱 用金属钠分别与水和乙醇反应 2 欲证明 CH2=CHCHO 中含有碳碳双键 滴入 KMnO4 酸性溶液,看紫红色是否褪去 3 欲除去苯中混有的苯酚 向混合液中加入浓溴水,充分反应后,过滤 4 证明 SO2 具有漂白性 将 SO2 通入酸性 KMnO4 溶液中 5 比较确定铜和镁的金属活动性强弱 用石墨作电极电解 Mg(NO3)2、Cu( NO3)2 的混合液 6 确定碳和硅两元素非金属性强弱 测同温同浓度 Na2CO3 和 Na2SiO3 水溶液的 PH A.①⑤⑥ B.①②⑥ C.①③④ D.②④⑥ 10.可逆反应 mA(s)+nB(g) pC(g)+qD(g)反应过程中,当其他条件不变时, C 的体积分数Φ(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。 下列叙述正确的是( ) A.达到平衡后,若使用催化剂,C 的体积分数将增大 B.当平衡后,若温度升高,化学平衡向逆反应方向移动 C.化学方程式中,n>p+q D.达到平衡后,增加 A 的质量有利于化学平衡向正反应方向移动 11.短周期元素 X、Y、Z 的原子序数依次递增,其原子的最外层电子数之和为 13。X 与 Y、 Z 位于相邻周期,Z 原子最外层电子数是 X 原子内层电子数的 3 倍或者是 Y 原子最外层电子 数的 3 倍。下列说法正确的是( ) A.X 的氢化物溶于水显酸性 B.X 与 Y 形成化合物的化学式为 X2Y2 C.Y 的氧化物是离子化合物 D.X 和 Z 的最高价氧化物对应水化物都是弱酸 12.下列各溶液中,有关成分的物质的量浓度关系正确的是 ( ) A.10mL 0.5mol/L CH3COONa 溶液与 6mL 1mol/L 盐酸混合: c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) B.0.1mol/L pH 为 4 的 NaHB 溶液中:c(HB-)>c(H2B)>c(B2-) C.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性: c(Na+)>c(SO4 2-)>c(NH4 +)>c(OH-)=c(H+) D.pH 相等的(NH4)2SO4 溶液,(NH4)2Fe (SO4)2 溶液和 NH4Cl 溶液: c[(NH4)2SO4]<c[(NH4)2Fe (SO4)2]<c(NH4Cl) 13.下列三种有机物是某些药物中的有效成分。 下列说法正确的是( ) A.三种有机物都能发生水解反应 B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有 2 种 C.将等物质的量的三种物质加入氢氧化钠溶液中,对羟基桂皮酸消耗氢氧化钠最多 D.使用FeCl3溶液和稀硫酸可以鉴别这三种有机物 第Ⅱ卷(非选择题,共 174 分) 三、非选择题:包括必考题和选考题两部分.第 22 题∽第 32 题为必考题,每个小题考生 都必须作答.第 33 题∽第 40 题为选考题,考生根据要求作答 (一)必考题 26.(14 分)已知 A 为一无机盐,C、D、F、N、O 为无色气体,E 常温常压下为无色无味的 液体,N、H、L 为高中常见的单质,I 为常见无氧强酸,M 的焰色反应为紫色,反应①常用 于气体 F 的检验。 (1)写出 G 的电子式_______________,M 的化学式_____________; (2)写出反应②的离子反应方程式______________________________; (3)写出反应③的化学反应方程式_____________;反应○1 -○4 中属于非氧化还原反应的 是 ; (4)用石墨电极电解溶液 K 时,电解初始阶段电极反应方程式为: 阴极___________________ 阳极___________________ (5)已知 A 在隔绝空气条件下分解产生的各产物的物质的量之比为 B:C:D:E:F=1:2: 2:2:2,写出 A 分解的反应方程式__________________________ 27.( 15 分)某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入 浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡。触 摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性。若用同样的铝片投入同浓度的 硫酸铜溶液中,在短时间内铝片无明显变化。 ⑴铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能 是 。 A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强 B.硫酸铜水解生成硫酸使铝钝化 C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能 D.生成氯化铝溶于水,而生成硫酸铝不溶于水 请设计一个简单实验验证你的选择: 。 ⑵铝片表面出现的暗红色物质的过程中发生的离子反应方程式是 。 用离子方程 式解释产生气泡的原因: 。 ⑶放出的气体是 ,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶 段产生气体的速率不断加快的原因是 。(写出 一点即可) ⑷某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能 是 。 A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中 B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中 C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片 D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中 ⑸除去氧化铝的铝片与铜片为电极,在 X 电解质溶液中构成原电池,列表如下: 选项 铝电极 电解质 负极反应 正极反应 A 正极 NaOH Al-3e-=Al3+ 2H2O+2e-=2OH-+H2↑ B 负极 稀盐酸 2Al-6e-=2Al3+ 6H++6e-=3H2↑ C 正极 浓硝酸 Cu-2e--=Cu2+ 2NO3 -+4H+-4e-=2NO2↑+2H2O D 负极 稀硝酸 Cu-2e-=Cu2+ 2NO3 -+8H+=2NO↑+4H2O+6e- 其中正确的是 ,由此推知,金属作电极不仅与本身性质相关,而且与 __________ 有关。 28.( 14 分)在 T℃条件下,向 1L 固定体积的密闭容器 M 中加入 2 mol X 和 1 mol Y, 发生如下反应: 2X(g) + Y(g) a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0) 当反应达到平衡后,反应放出的热量为 Q1 kJ,物质 X 的转化率为α;若平衡后再升高 温度,混合气体的平均相对分子质量减小,则: (1)化学计量数 a 的值为 。 (2)写出该反应平衡常数 K 的表达式 (a 必须用具体的值表示)。 (3)下列说法中能说明该反应达到了化学平衡状态的是 。 A.容器内压强一定 B.容器内气体的密度一定 C.容器内 Z 分子数一定 D.容器内气体的质量一定 (4)X 的转化率α= ,Y 的平衡浓度为 。(均用含 Q、 Q1 的代数式表示) (5)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后 放出的热量仍为 Q1 kJ 的是 (稀有气体不参与反应)。 A.2 molX、1mol Y、1molAr B.a molZ、1mol W C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W D.2 molX、1mol Y、1molZ (二)选考题:共 45 分。请考生从给出的 3 道物理题、3 道化学题、2 道生物题中每科任选 一题做答,并用 2B 铅笔在答题卡上把所选题目的题号涂黑。注意所做题目的题号必须与所 涂题目的题号一致,在答题卡选答区域指定位置答题。如果多做,则每学科按所做的第一 题计分。 36、选修《化学与技术》 (15 分)南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化 验,结果显示水的硬度为 28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。 请思考下列问题: ⑴该泉水属于 硬水(填写“暂时”或“永久”)。 ⑵若要除去 Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂填加时先加 后加 ,原 因是 。 ⑶目前常用阳离子交换树脂如 NaR、HR 来进行水的软化,若使用 HR 作为阳离子交换树脂则 水中的 Ca2+、Mg2+与交换树脂的 起离子交换作用。若使用 NaR 作为阳离子交换树脂失效后 可放入 5%-8% 溶液中再生。 ⑷岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海 水中含 Na+、Cl-、Ca2+、Mg2+、SO4 2-等离子,电极为惰性电极。请分析下列问题: 通电后 ①阳离子交换膜是指 (填 A 或 B)。 ②写出通电后阳极区的电极反应式: ; 阴极区的现象是: 。 37、选修《物质结构》 三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和 液晶显示器制造中得到广泛应用。NF3 是一种三角锥型分子,键角 102 °,沸点-129 ℃; 可在铜的催化作用下由 F2 和过量 NH3 反应得到。 (1)写出制备 NF3 的化学反应方程式: 。 (2)NF3 的沸点比 NH3 的沸点(-33 ℃)低得多的主要原因是 。 (3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式 为 。 (4)理论上 HF、NaAlO2 和 NaCl 按 6∶1∶2 的物质的量之比恰好反应生成 HCl、H2O 和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为____其中心离子 是 ,配位数为 。 (5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1 ),回答下面各题: 元素代号 I1 I2 I3 I4 Q 2080 4000 6100 9400 R 500 4600 6900 9500 S 740 1500 7700 10500 T 580 1800 2700 11600 U 420 3100 4400 5900 ①在周期表中,最可能处于同一族的是 和 。 ②T 元素最可能是 区元素。若 T 为第二周期元素,E 是第三周期元素中原 子半径最小的元素,则 T、E 形成化合物的空间构型为 ,其中心原子的 杂化方式为 。 38、选修《有机化学基础》 已知:两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应: CH3CH(OH) 2→CH3CHO +H2O 现有分子式为 C9H8O2Br2 的物质 M,已知有机物 C 的相对分子质量为 60,E 的化学式为 C7H5O2Na 在一定条件下可发生下述一系列反应: 请回答下列问题: (1)B 中官能名称是 ,A 的核磁共振氢谱图有 个吸收峰。 (2)M 的结构简式为 _________ ;C 的结构简式为 __________ 。 (3)G→H 的反应类型是 ______ ;H→I 的反应类型是 ______ ; (4)写出下列反应的化学方程式: ①E→ F 的化学方程式: _______ ; ②H→I 的化学方程式: ___ 。 (5)请写出同时符合下列条件的G的同分异构体的结构简式 。(任写一种) a.分子中含有苯环 b.能发生水解反应 c.能发生银镜反应 d.与 FeCl3 溶液反应显紫色 一 . 选 择题答案 7 A 8 9 10 11 12 13 F 稀 NaOH △ HI M 新制 Cu(OH)2 △ 浓 H2SO4 △ C 稀 H2SO4 △ G(遇 FeCl3 溶液显紫色) 红色沉淀 H2 (足量) 催化剂△ (H 转化为 I 时,产物只有一种结 构且 I 能使溴的 CCl4 溶液褪色) B O2 A D E O2 26.(14 分) (1) (2 分) KSCN (1 分) (2)3Fe2++NO3 -+4H+= 3Fe3++NO↑+2H2O (2 分) (3)4NH3+3O2=2N2+6H2O (2 分) ○1 ○4 (2 分) (4)阴极:Fe3++e= Fe2+ (1 分) 阳极:2Cl- - 2e= Cl2 ↑ (1 分) (5)(NH4) 2Fe(C2O4)2=FeO+2CO↑+2CO2↑+2H2O+2NH3 ↑ (3 分) 27.(15 分)⑴C (1 分)在硫酸铜溶液中加入铝片,无明显现象,再加入氯化钠(注意: 不能加入盐酸),若反应明显加快了,说明上述推断正确。(2 分) ⑵2Al+3Cu2+=3Cu+2Al3+;(2 分)Al3++3H2O Al(OH)3+3H+, Cu2++2H2O Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑ (2 分) (3)氢气(1 分) ①随着反应进行生成铝离子浓度增大,水解程度增大,产生大量 H+ ② 该反应放热,升高温度反应加快 ③铜与铝构成原电池,加快铝失电子 (3 分) ⑷AB (2 分) ⑸B(2 分) 电解质的性质(1 分) 28.(14 分) (1)1 (2 分) (2)K=c(z).c(w)/ c2(x).c(y)(3 分) (3)AC. (2 分) (4) 1 0 0 Q= 100Q (3 分) Lmol1 1 Q Q (2 分)(5)A. (2 分) 36.(15 分)⑴永久(1 分) ⑵石灰(2 分)纯碱(2 分)过量的钙离子可通过纯碱使之沉淀下来(2 分) D A B C C D ⑶H+ (1 分)NaCl(1 分) ⑷ ① B (2 分) ② 2Cl-+2e- = Cl2↑(2 分) 电极上产生无色气体,溶液中出现少量 白色沉淀。(2 分) 37. (15 分) (1)4NH3+3F2=NF3+3NH4F(2 分) (2)NH3 能形成氢键,NF3 只有范德华力(2 分) (3)1s22s22p63s23p63d54s1(或[Ar] 3d54s1)(2 分) (4)Na3AlF6 (2 分) Al(1 分) 6(1 分) (5)① R (1 分) U (1 分) ② P (1 分) 平面正三角形(1 分) sp2 (1 分) 38.(15 分) (1)醛基(1 分) 3(1 分) (2)Br2CH— —OOCCH3 (2 分); CH3COOH (2 分); (3)加成反应 (还原反应)(1 分),消去反应(1 分); (4)① ② (2 分) (5) (其它符合题意的答案也同样给分)(2 分) 高三化学高考复习《水溶液中的离子平衡》 (附参考答案)第 I 卷 选择题 一、选择题 1.下列说法不正确的是 A.因为 Na2S 水解,所以浓硫化钠溶液有臭味 B.pH=5 的 CH3COOH 溶液和 pH=5 的 NH4Cl 溶液中,c(H+)不相等 C.Fe3++3H2O Fe(OH)3+3H+,FeCl3 可以净水 D.CO32-+H2O HCO3-+OH-热的纯碱溶液去油污 OH + H2O 浓 H2SO4 △ COOH COOH △NaO — —CHO +2Cu(OH)2 HO— —COONa +Cu2O↓+2H2O(3 分) HCOO— —OH 2.室温时,将浓度和体积分别为 c1、v1 的 NaOH 溶液和 c2、v2 的 CH3COOH 溶液相混合,下 列关于该混合溶液的叙述正确的是 A.若 pH>7 时,则一定是 c1v1=c2v2 B.在任何情况下都是 c(Na+)+c(H+)=c(CH3COO-)+c(OH-) C.当 pH=7 时,可能有 c1/c2 > v2/v1 D.若 V1=V2,c1=c2,则 c(CH3COO-)+C(CH3COOH)=C(Na+) 3.如图,abcd 分别代表酸碱溶液加水稀释后 pH 与加水的体积的关系。下列判断正确的是 ( ) A.a 和 b 为强电解质 B.等体积的 c 和 d 分别与足量的镁粉反应,放出 H2 一样多 C.c 和 d 的物质的量浓度相同 D.pH 相等的 a 和 b 分别加水稀释 m 和 n 倍后 pH 仍相等,则 m < n 4.室温下,往 0.001mol·L-1 的氨水中滴入几滴酚酞试液时,溶液呈现粉红色。现采取下列 措施,其中能使滴有酚酞的氨水溶液颜色变浅的是 A.往溶液中滴入 0.2mol·L-1 的氨水 B.往溶液中加入 NH4Cl 晶体 C.往溶液中加入 CH3COONa 固体 D.往溶液中加入 NaOH 固体 5.下列有关电解质溶液的说法正确的是 A.在蒸馏水中滴加浓 H2S04,Kw 不变 B.CaC03 不易溶于稀硫酸,也不易溶于醋酸 C.NaCI 溶液和 CH3 COONH4 溶液均显中性,两溶液中水的电离程度相同 D.在 Na2S 稀溶液中,c(H+) =c( OH-)-2c(H2S) -c(HS-) 6.下列表述或判断正确的是( ) A.25℃时,pH=10 的 NaOH 溶液与 pH =10 的氨水中:c(Na+)=c(NH4 +); B.相同条件下等物质的量浓度的①NaCl 溶液;②NaOH 溶液;③HCl 溶液中由水电离出的 c(H+) :③>①>② C.在 Na2CO3、NaHC03 两种溶液中,离子种类不相同 D.25 ℃时,浓度为 0.2mol/L 的 Na2CO3 溶液中只存在水解平衡,不存在电离平衡 7. 0.1mol/LNaHCO3 的溶液的 pH 最接近于( ) A.5.6 B.7.0 C.8.4 D.13.0 8.下列关于强、弱电解质的叙述,正确的是 A.强电解质全部是离子化合物 B.强电解质在水中的溶解度一定大于弱电解质 C.强电解质在水溶液中完全电离 D.强电解质溶液的导电能力一定强于弱电解质 9.下列说法正确的是: A.相同温度时,1mol/L 氨水与 0.5mol/L 氨水中,C(OH-)之比是 2∶1 B.1mol/L NH4Cl 溶液中 C(NH4 +) = C(Cl-) C.0.1mol/LCH3COONa 溶液中加少量 CH3COOH 溶液,使溶液呈中性,此时混合液中 C (Na+) = C (CH3COO-) D.硫化钠溶液中,C (Na+) = 2 C (S2-) 10.取 20.00 mL 0.50 mol·L-1 NaOH 溶液,恰好将未知浓度的 H2SO4 溶液 20.00 mL 滴定至 终点,下列说法正确的是( ) A.该实验不需要指示剂 B.用量筒量取上述硫酸的体积 C.H2SO4 的浓度为 1.00 mol·L-1 D.参加反应的 H+和 OH-的物质的量相等 11.下列浓度关系正确的是 A.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-) B.Na2CO3 溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO- 3 )>c(H+) C.pH=2 的 HA 溶液与 pH=12 的 MOH 溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) D.pH 相等的 CH3COONa、NaOH 和 Na2CO3 三种溶液:c(NaOH)查看更多