- 2021-07-09 发布 |
- 37.5 KB |
- 85页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学二轮复习精品课件 专题2 化学常用计量
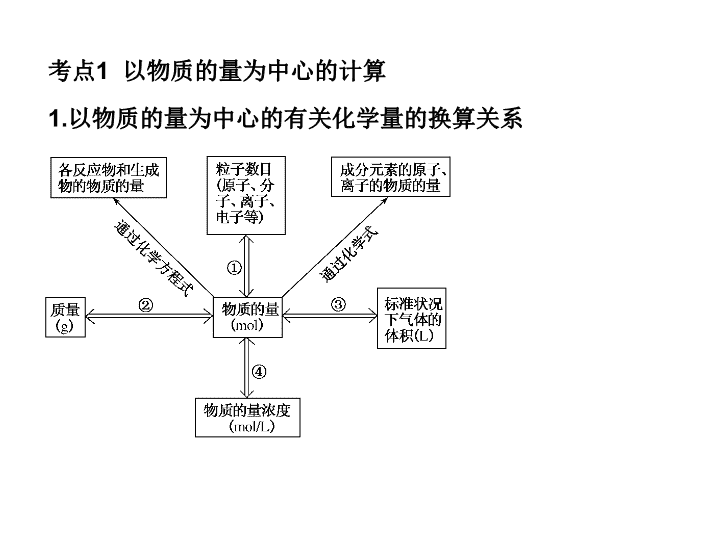
专题二 化学常用计量 考点1 以物质的量为中心的计算 1.以物质的量为中心的有关化学量的换算关系 2.化学量之间换算时要注意的问题 (1)“一个中心”:以物质的量为中心。 (2)“两个前提”:在应用Vm=22.4 L/mol时,一定要符合 “标准状况”和“气态”这两个前提条件(混合气体 也适用)。 (3)“三个关系”:①直接构成物质的粒子与间接构成物质的粒子(原子、 电子等) 数目间的关系(如CH4气体中的分子数与C、 H原子数,质子、 中子、 电子数、 共价键数等);②摩尔质量与相对分子质量间的关系(前者符号为M,单位是 g/mol,后者符号为Mr,单位是1,二者在数值上相等);③强电解质、 弱电解质、 非电解质与溶质粒子(分子或离子)数之间的关系。 (4)“四个无关”:物质的量、 质量、 粒子数的多少均与温度、 压强的高低无关; 物质的量浓度的大小与所取该溶液的体积多少无关(但溶质粒子数的多少与 溶液体积有关)。 考点2 阿伏加德罗定律及推论 1.阿伏加德罗定律及推论 (1)阿伏加德罗定律 在相同温度和压强下,相同体积的任何气体含有相同 数目的分子。 (2)阿伏加德罗定律的推论 相同条件 结论 公式 语言叙述 T、 p相同 同温、 同压下,气体的体积 与物质的量成正比 T、 V相同 温度、 体积相同的气体,压 强与物质的量成正比 n、 p相同 物质的量相等、 压强相同的 气体,其体积与温度成正比 1 1 2 2 n V n V 1 1 2 2 p n p n 1 1 2 2 V T V T n、 T相同 物质的量相等、 温度相同的气体,其压强与 体积成反比 T、 p相同 同温、 同压下,气体的密度与其相对分子质 量(或是摩尔质量,下同)成正比 T、 p、 V相同 同温、 同压下,体积相同的气体,其相对分子 质量与其质量成正比 T、 p、 m相同 同温、 同压下,等质量的气体,其相对分子质 量与其体积成反比 T、 V、 m相同 同温、 同体积下,等质量的气体,其相对分子 质量与其压强成反比 1 2 2 1 p V p V 1 1 2 2 M M 1 1 2 2 M m M m 1 2 2 1 M V M V 1 2 2 1 M p M p 2.注意的问题 考查阿伏加德罗定律时除从正面考查外,还常设置干扰选项,增加试题的难度, 考查思维的严密性。 解题时应注意以下三个方面的问题。 (1)1 mol任何粒子的数目为阿伏加德罗常数,其不因温度、 压强等条件的改 变而改变。 (2)应用阿伏加德罗定律及其推论时,首先要判断物质在所给温度和压强下是 否为气体,若物质为非气态则不能应用阿伏加德罗定律。 (3)阿伏加德罗定律既适用于气体纯净物,也适用于混 合气体。 若为混合气体,则组成成分间不能发生反应, 如2NO+O2=2NO2不适用;也不能存在化学平衡,如 2NO2=N2O4不适用。 考点3 物质的量浓度的计算与换算 / ( ) 1000 , 1000 1 / 1000 ,100 (100 ) 1000 100 ? 1000 . 2. S B B n m M m aq w wc V V MV M c Mw n S M Sc SV M S cMS cM 物质的量浓度与溶质质量分数之间的换算 物质的量浓度与溶解度 的换算 100 / 22.4 1000 ,1 3. : w 100% 4. , ,1 L V L, , : 1 000 1 / 22.4 22400 1000 ( ) / 22.4 ( ) 1000 1 / 22.4 224 00% 100% 100 00 S S n V Vc V MV MV m V Mw m V M MV MV 质量分数与溶解度之间的换算饱和溶液中 。 气体溶质溶于水中制得溶液 其物质的量浓度的计算 在标准状况下 水中溶解某气体 所得溶液密度为 则 溶质 溶液 %。 5.稀释定律 (1)如用V1、 V2、 c1、 c2分别表示稀释前后溶液的体积 和物质的量浓度,有:c1V1=c2V2。 (2)如用m1、 m2、 w1、 w2分别表示稀释前后溶液的 质量和质量分数,有:m1w1=m2w2。 考情分析:1.化学常用计量是化学计算的基础。 贯穿于高中化学始终,是每年高考的必考内容, 通常以选择题、 填空题和计算题的形式出现,高考主要考查对相对原子质量、 相对分子质量 、 物质的量、 气体摩尔体积、 阿伏加德罗常数等基本概念的理解,相互关系及计算应用。 2.溶液是高考的热点内容,物质的量浓度的计算常渗透到其他类型的计算中,并根据电解质溶液 中的电荷守恒解决题目中的实际问题,题型以选择题和填空题为主。 题型一 阿伏加德罗常数的判断 【例1】 设nA代表阿伏加德罗常数(NA)的数值,下列说法正确 的是( ) A.1 mol硫酸钾中阴离子所带电荷数为nA B.乙烯和环丙烷(C3H6)组成的28 g混合气体中含有3 nA个氢原子 C.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为nA D.将0.1 mol氯化铁溶于1 L水中,所得溶液含有0.1 nA个Fe3+ [解析] 本题以氧化还原、 盐类水解和元素质量分数的计算为命题载体考查 阿伏加德罗常数的应用。 选项A,所带的电荷数为2nA,A错。 选项B解题的突 破口是乙烯和环丙烷的最简式相同,均为“CH2”,因此两种气体不管以何种 比例混合,碳、 氢的质量分数都为定值,因此可求得m(H)=28 g× 4g,所以混合气体中应含有4 nA个氢原子,B错。 2 14 选项C求解的关键是正确书写氧化还原反应方程式,该反应的化学方程式为 Cl2+2NaOH=NaCl+NaClO+H2O,在标准状况下当有1 mol Cl2参与反应时,转 移的电子总数为nA,C正确。 选项D中应注意到Fe3+是弱碱阳离子,在水中易 水解,因此在溶液里含有Fe3+的数目小于0.1 nA,D错。 [答案] C [点拨] 解答阿伏加德罗常数试题应注意的问题: (1)状态问题:如水在标准状况下为液态或固态;SO3在标准状况下为固体,常 温常压下为液体;HF在标准状况下呈液态;在标准状况下,碳原子数大于4而 小于16的烃为液体,不小于16的烃为固体,烃的含氧衍生物中只有甲醛是气 体。 (2)状况条件:考查气体时经常给出非标准状况,如常温常压下,1.01×105Pa、 25℃时等。 要用到22.4 L·mol-1时,必须注意气体是否处于标准状况下。 (3)物质结构和晶体结构:考查一定物质的量的物质中含有多少微粒(分子、 原子、 电子、 质子 、 中子等)时常涉及稀有气体为单原子分子,Cl2、 N2、 O2、 H2为双原子分子等。 晶体结构中 常考的有P4、 金刚石、 石墨、 二氧化硅等。 (4)氧化还原反应:考查指定物质参加氧化还原反应时,常设置氧化还原反应中氧化剂、 还原剂 、 氧化产物、 还原产物、 被氧化、 被还原、 电子转移(得失)数目方面的陷阱。 要关注Na2O2 和H2O、 CO2等反应中电子转移数目的判断。 (5)电离、 水解:考查电解质溶液中微粒数目或浓度时 常设置弱电解质的电离、 盐类水解等方面的陷阱。 如某些离子或原子团在水溶液中能发生水解反应,则 微粒数目会发生改变。 【变式训练1】 用NA表示阿伏加德罗常数的值。 下列叙述正确的是( ) A.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2 NA B.标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2 NA C.室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5 NA D.标准状况下,22.4 L甲醇中含有的氧原子数目为1.0 NA [解析] 本题中涉及的知识点有两个,即氧化还原反应中电子转移数目的确定 和元素质量分数的计算,可见这两个知识点在高考复习中要引起格外的重 视。 考后分析,很多考生中了命题陷阱误选A,其原因是未理解pH的定义,溶 液的pH是指溶液中总的c(H+)或总的c(OH-),与溶质的化学式无关,所以OH-的 数目不应为0.2 NA。 选项B中转移的电子数为0.1 NA,B错。 选项D中涉及的 物质的状态也是高考中常考的知识点,同学们有必要对一些重要化合物在 标准状况下的状态烂熟于心,本题中甲醇在标准状况下是液体,D错。 [答案] C 题型二 以物质的量为中心的计算 【例2】 臭氧层是地球生命的保护神,臭氧比氧气具有更 强的氧化性。 实验室可将氧气通过高压放电管来制取臭氧: 。 (1)若在上述反应中有30%的氧气转化为臭氧,所得混合气 体的平均摩尔质量为________g/mol(保留一位小数)。 (2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L, 其中臭氧为________L。 (3)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入 盛有20.0 g铜粉的反应器中,充分加热后,粉末的质量变为 21.6 g。 则原混合气体中臭氧的体积分数为________。 3 23 2O O放电 35.6 3 50% 2 3 [ ] 1 M( ) 2 , ( ) 3 O u , ) O ( C m n 分析 根据 混气 计算。 利用化学方程式 采用差量法 混 计算。 、 均与 粉反应 根据题意列方 气 混气 程组求解。 2 2 3 [ ] 1 1 mol O n 3 mol 2 mol 1 mol 0.3 mol 0.1 mol : M 35.6 g / mol 3 2 32 0.9 O O m g n mol 放电 总 总 解答 设有 根据 。 2 32 3O 2O V 3 2 1 V L 8 6.5 1.5 L : V 3 L 放电 体积 体积 体积 所以 。 3 2 2 3 2 3 0.896 0.04 22.4 / 3 ,O O O O x m 1.62 3 0.1 16 ol O , y mol O , x 0.02 mol y 0.02 m l 50 / o % Lx y mol L mol gx y mol g mol 加热条件下 、 都能和铜粉反应故粉末 增加的质量即为 和 的总质量 设混合气体中含有 含有 则有 解得 所以混合气体中臭氧体积分数为 。 【变式训练2】 在a L Al2(SO4)3和(NH4)2SO4的混合溶 液中加入b mol BaCl2,恰好使溶液中的离子完全沉淀; 如加入足量强碱并加热可得到c mol NH3,则原溶液中 的Al3+离子浓度(mol/L)为( ) 2 2 2 2. . . . 2 3 6 b c b c b c b cA B C D a a a a [答案] C 2 4 2 4 2 4 3 4 2 3 3 4 3 [ ] c mol NH , NH cmol, SO Ba b mol, SO b mol : 2c(SO NH 3c Al , 3c Al (2 mol / L, c A ) 3 l ) 2 / b cc a a b c mol L a 解析由于产生 则必定有 使 完全沉淀需 因此 有 。根据电荷守恒 则 即 题型三 阿伏加德罗定律及推论 【例3】 将22.4 L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体 积变为11.2 L(体积均在相同条件下测定),则该氮氧化合物的化学式为( ) A.NO2 B.N2O3 C.N2O D.N2O4 [答案] A [解析] 根据阿伏加德罗定律及题意可推知气态氮氧化合物与生成N2的物质 的量之比;根据N2的组成及n(氮氧化合物):n(N2)=2:1可推知氮氧化合物分子 中氮原子个数,再通过设氮氧化合物化学式,写出化学方程式,便可确定氮氧 化合物的化学式。 相同条件下,气体的体积之比等于物质的量之比,n(氮氧化合物):n(N2)=22.4 L:11.2 L=2:1,再根据氮原子守恒知1分子氮氧化合物中只含有1个氮原子,可 得答案A。 【变式训练3】 在两个密闭容器中,分别充有质量相同的甲、 乙两种气体,若两 容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( ) A.甲的分子数比乙的分子数多 B.甲的物质的量比乙的物质的量少 C.甲的摩尔体积比乙的摩尔体积小 D.甲的相对分子质量比乙的相对分子质量小 [答案] B , [ ] m V , V V , , V V , , n n M M M M , B V V m m n n 乙 乙甲 甲 甲 已 乙甲 甲 甲 乙 乙甲 甲 乙 乙甲 甲 乙甲 解析由公式 得出 因为 则 同温同压条件下 。 由 得 因此 正确。 主干知识整合 以物质的量为中心的各个物理量的关系: 要点热点探究 ► 探究点一 阿伏加德罗常数的应用 有关阿伏加德罗常数的应用问题,需要特别注意的有: 1.条件:考查气体时经常给定非标准状况,如常温常压下 (1.0×105Pa、25 ℃时)等。 2.物质状态:考查气体摩尔体积时,常用在标准状况下非气 态的物质来迷惑考生,如H2O、SO3、己烷、CHCl3等。 3.物质结构:考查一定物质的量的物质中含有多少微粒(分子、 原子、电子、质子、中子等)时常涉及稀有气体He、Ne等单原 子分子,Cl2、N2、O2等双原子分子,以及O3、P4等。 4.氧化还原反应:考查指定物质参加氧化还原反应时,常 设置氧化还原反应中氧化剂、还原剂、氧化产物、还原产 物、电子转移(得失)数目方面的陷阱。如:Na2O2+H2O、 Cl2+NaOH、电解AgNO3溶液、Cu与S反应等。 5.电离、水解:考查电解质溶液中粒子数目或浓度时常设 置弱电解质的电离、盐类水解方面的陷阱。 6.一些物质中的化学键数目:如SiO2、Si、CH4、P4、S8、 烃(如烷烃中单键数)等。 7.常见的可逆反应:如2NO2 N2O4,弱电解质的电 离平衡等。 8.摩尔质量:特殊物质如D2O、18O2等。 例1 [2011·江苏化学卷] 设NA为阿伏加德罗常数的 值。下列叙述正确的是( ) A.1 mol甲醇中含有C-H键的数目为4NA B.25 ℃,pH=13的NaOH溶液中含有OH-的数 目为0.1NA C.标准状况下,2.24 L己烷含有分子的数目为 0.1NA D.常温常压下,Na2O2与足量H2O反应,共生成 0.2 mol O2,转移电子的数目为0.4NA D 【解析】 1 mol 甲醇中含有3 mol C-H键,A 错;pH=13的NaOH溶液c(OH-)=0.1 mol/L,由于 没有提供溶液体积,OH-的数目无法确定,B错;己 烷在标准状况下为液体,不适用气体摩尔体积,C错; 2Na2O2+2H2O==4NaOH+O2↑中,生成0.2 mol O2, 转移0.4 mol e-,D对。 【点评】 本题为阿伏加德罗常数应用的常见题型, 这类试题的知识覆盖面和综合性较强,但难度往往 不大。解决该类试题的要点就是“细心、防陷阱”, 注意一些平时易忽视的知识点。 [2011·海南化学卷] 设NA是阿伏加德罗常数的数值, 下列说法正确的是( ) A.1 mol Al3+离子含有的核外电子数为3NA B.1 mol Cl2与足量的铁反应,转移的电子数为3NA C.10 L pH=1的硫酸溶液中含有的H+离子数为2NA D.10 L pH=13的NaOH溶液中含有的OH-离子数为 NA D 【解析】 Al3+离子核外电子数为10个,1 mol Al3+离子含有的核外电子数应为10 NA,故A错; 2Fe+3Cl2===2FeCl3,反应中转移6个电子,1 mol Cl2反应转移的电子数应为2NA,故B错;pH=1时 c(H+)=0.1 mol·L-1,n(H+)=1 mol,故C错; pH=13时c(OH-)=0.1 mol·L-1,n(OH-)=1 mol, 故D对。 例2 用NA表示阿伏加德罗常数的值。下列说法正 确的是( ) A.1.8 g重水(D2O)中含有的质子数为NA B.500 ℃、30 MPa下:N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1,将1.5NA个H2和过量N2在 此条件下充分反应,放出热量为19.3 kJ C.标准状况下,11.2 L Cl2通入足量的石灰乳中制 备漂白粉,转移的电子数为0.5NA D.0.1 mol·L-1氯化铝溶液中含有Al3+数为0.1NA C 【解析】 重水的摩尔质量为20 g·mol-1,一个 重水分子中含有10个质子,故1.8 g重水中含有的质 子数为0.9NA,A项错误;1.5 mol H2在合成氨反应 中不可能完全转化,放出的热量小于19.3 kJ,B项错 误;制取漂白粉的反应中,氯气既是氧化剂又是还 原剂,1 mol Cl2参加反应转移电子1 mol,C项正确; 氯化铝溶液中Al3+能发生水解且题中未告知溶液的 体积,故无法求算Al3+的数目,D项错误。 ► 探究点二 以物质的量为核心的有关计算 1.一定物质的量的物质溶于水求算溶质的物质的量浓度时要 注意以下两点: (1)溶液的体积不能用溶剂水的体积和溶质的体积之和来代替, 应该用溶液的质量除以溶液的密度; (2)物质溶于水后注意看溶质是否发生了变化。如Na、Na2O2、 NO2、SO3等溶于水,由于它们与水反应,所以溶质发生了变 化。 2.用气体摩尔体积22.4 L·mol-1进行气体的物质的量与体积 的换算时,要注意气体所处的状态是否是在标准状况下。 3.相同溶质的溶液混合时,有以下两种情况: (1)溶质相同的两溶液等质量混合时,混合溶液的溶质的质量 分数为两溶液溶质质量分数之和的一半。 (2)溶质相同的两溶液等体积混合时: ①对于密度小于1 g·cm-3的溶液,如氨水、乙醇的水溶液, 等体积混合时溶质的质量分数小于两溶液溶质质量分数之和的 一半; ②对于密度大于1 g·cm-3的溶液,如硫酸溶液、盐酸,等体 积混合时溶质的质量分数大于两溶液溶质质量分数之和的一半。 例3、图2-1是某学校实验室从化学试剂商店买回来的硫酸试 剂标签上的部分内容。据此下列说法正确的是( ) A.该硫酸的物质的量浓度为9.2 mol·L-1 B.该硫酸50 mL与足量的铜反应可得到 标准状况下SO2 0.46 mol C.要配制250 mL 4.6 mol·L-1的稀硫 酸需取该硫酸62.5 mL D.等质量的水与该硫酸混合所得溶液 的物质的量浓度大于9.2 mol·L-1 【解析】 由c= 可算出该硫酸的物质的量 浓度为18.4 mol·L-1,A项不正确。随着反应进行, 硫酸逐渐变稀而导致反应终止,所以产生SO2小于 0.46 mol,B项错误;由稀释定律,可得出所用硫酸 体积为62.5 mL,C项正确;等质量的硫酸和水,硫 酸的密度大,硫酸的体积远小于水,二者等质量混 合后,硫酸的浓度小于原浓度的一半,D项错误。 【点评】 以物质的量为中心的计算需注意的问题: 1.“一个中心”:必须以物质的量为中心。 2.“两个前提”:在应用Vm=22.4 L·mol-1时, 一定要有“标准状况”和“气体状态”两个前提 (混合气体也适用)。 3.“三个关系”:①直接构成物质的粒子与间接 构成物质的粒子(原子、电子等)间的关系;②摩尔 质量与相对分子质量间的关系;③“强、弱、非” 电解质与溶质粒子(分子或离子)数之间的关系。 4.“七个无关”:物质的量、质量、粒子数的多 少均与温度、压强的高低无关;物质的量浓度的大 小与所取该溶液的体积多少无关(但溶质粒子数的 多少与溶液体积有关)。 [2011·课标全国卷] 下列叙述正确的是( ) A.1.00 mol NaCl中含有6.02×1023个NaCl分子 B.1.00 mol NaCl中,所有Na+的最外层电子总数 为8×6.02×1023 C.欲配制1.00 L ,1.00 mol·L-1的NaCl溶液,可 将58.5 g NaCl溶于1.00 L水中 D.电解58.5 g 熔融的NaCl,能产生22.4 L氯气(标 准状况)、23.0 g金属钠 B 【解析】 NaCl为离子晶体,是由Na+和Cl-直 接构成的,不存在分子,A项错误;Na+最外层电 子数为8,因此,1.00 mol Na+最外层电子数为 8×6.02×1023,B项正确;溶液的体积不是1.00 L, C项错误;D项产生氯气的体积应为11.2 L(标准状况)。 标准状况下V L氨气溶解在1 L水中(水的密度近似为 1 g·mL-1,所得溶液的密度为ρ g·mL-1,质量分数为w, 物质的量浓度为c mol·L-1,则下列关系中不正确的是( ) A 【解析】 例4 [2011·福建卷] Ⅰ.磷、硫元素的单质和化合物 应用广泛。 (1)磷元素的原子结构示意图是____________。 (2)磷酸钙与焦炭、石英砂混合,在电炉中加热到 1500 ℃生成白磷,反应为: 2Ca3(PO4)2+6SiO2==6CaSiO3+P4O10 10C+P4O10===P4+10CO 每生成1 mol P4时,就有________mol电子发生转移。 (3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式 C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩 余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发 生的反应为: 在一定体积的某维生素C溶液中加入a mol·L-1I2溶液V1 mL, 充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L- 1Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是 ________mol。 (4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应: 生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的 时间来衡量该反应的速率。某同学设计实验如下表所示: 0.01 mol·L-1KIO3酸性溶 液(含淀粉)的体积/mL 0.01 mol· L-1Na2SO3溶液的体 积/mL H2O的 体积 /mL 实验 温度 /℃ 溶液出现 蓝色时所 需时间/s 实验1 5 V1 35 25 实验2 5 5 40 25 实验3 5 5 V2 0 该实验的目的是__________________;表中V2=________mL。 Ⅱ.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。 (5)铈(Ce)是地壳中含量最高的稀土元素,在加热条件下CeCl3 易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合 物的方法来制备。其中,NH4Cl的作用是________。 (6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3。Ce3+通 过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式: 【答案】(1) (2)20 (3) (其他合理答案也可) (4)探究该反应的速率与温度、亚硫酸钠溶液浓度的关系(其他 合理答案也可) 40 (5)分解出HCl气体,抑制CeCl3水解(或其他合理答案) (6)2 1 6 2 6H+ 【解析】 (1)P元素为15号元素,根据核外电子排布规律其原子 结构示意图为 。 (2)在P4O10中P的化合价为+5价,当生成1 mol P4转移电子数为 20 mol。 (3)第二个反应消耗Na2S2O3的物质的量为:b mol·L-1×V2 10 -3L=V2b10-3mol,则第一个反应剩余的I2的物质的量为 0.5V2b10-3mol,该过程加入I2总的物质的量为a mol·L- 1×V1 10-3L=V1 a 10-3mol,则参加第一个反应的I2的物质 的量为V1a 10-3mol-0.5 V2b 10-3mol,则该溶液中维生素C 的物质的量为V1a 10-3mol-0.5 V2b 10-3mol=(V1a-0.5 V2b)10-3mol。 (4)实验1和实验2温度相同但加水体积不同,而实验2和实验3温度不同则加 水体积应该相同,故V2=40,有3个实验所给出的不同对比数据可得出该实 验目的为:探究该反应的速率与温度、亚硫酸钠浓度的关系。 (5)CeCl3发生水解的方程式为:CeCl3+3H2O Ce(OH)3+3HCl, NH4Cl固体加热可分解生成HCl,起到抑制CeCl3水解的作用。 (6)根据电荷守恒:反应物中有阳离子,则生成物中必然要有阳离子,由题 意知溶液pH=3,故最后一个空应为H+;根据氧化还原反应方程式的配平 原则,分析反应中的化合价变化,H2O2中两个O的化合价从-1→-2,得 到2个电子,Ce元素的化合价从+3→+4,应该失去两个电子,综合得失电 子守恒和质量守恒,可配平出2Ce3++H2O2+6H2O===2Ce(OH)4+6H+。 1.把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份 加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取 一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。 则该混合溶液中钾离子浓度为( ) A.0.1(b-2a)mol·L-1 B.10(2a-b)mol·L-1 C.10(b-a)mol·L-1 D.10(b-2a)mol·L-1 1.只给出下列甲和乙中对应的量,不能求出物质的量 的是 ( ) A B C D 甲 物质的粒子数 标准状况 下的气体 摩尔体积 固体的体 积 溶液中溶 质的物质 的量浓度 乙 阿伏加德罗常 数 标准状况 时的气体 体积 固体的密 度 溶液的体 积 C 2.设NA代表阿伏加德罗常数的值,下列说法正确的 是 ( ) A.将2 mol NO和1 mol O2混合后,体系中的原子 总数为6NA B.0.01 mol Mg在CO2中完全燃烧,转移电子数为 0.01NA C.标准状况下,3.2 g Cu与足量的浓硝酸反应生成 气体的分子数为0.2NA D.7.8 g Na2O2含有的阴离子数为0.2NA 解析 Mg与CO2的反应为2Mg+CO2 2MgO+C,故 转移电子数为0.02NA,B项错误;Cu与浓硝酸的反 应为Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O,3.2 g Cu反应时生成气体的分子数为 ×2×NA=0.1NA,C项错误;Na2O2中的阴离子为O , 故7.8 gNa2O2中阴离子数为0.1NA,D项错误。 点燃 g/mol64 g2.3 答案 A 2- 2 3.下图是某学校实验室从化学试剂商店买回的硫酸试 剂标签上的部分内容。据此下列说法正确的是( ) 硫酸 化学纯(CP)(500 mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84 g/cm3 质量分数:98% A.该硫酸的物质的量浓度为9.2 mol/L B.1 mol Zn与足量的该硫酸反应产生2 g氢气 C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL D.等质量的水与该硫酸混合所得溶液的物质的量浓 度大于9.2 mol/L 解析 本题考查有关溶液浓度的知识。由c= 可 算出该硫酸的物质的量浓度为18.4 mol/L;该硫酸 是浓硫酸不和Zn反应生成H2;由稀释定律,可得 出所用硫酸体积为50 mL;等质量的硫酸和水, 硫酸的密度大,硫酸的体积远小于水,两者等质 量混合,硫酸的浓度小于一半,D不正确。 M w0001 答案 C 4.实验室里需用480 mL 0.1 mol/L的硫酸铜溶液, 现选取500 mL容量瓶进行配制,以下操作正确 的是 ( ) A.称取7.68 g硫酸铜,加入500 mL水 B.称取12.0 g胆矾配成500 mL溶液 C.称取8.0 g硫酸铜,加入500 mL水 D.称取12.5 g胆矾配成500 mL溶液 解析 首先应以500 mL来计算胆矾或硫酸铜的质量, 计算得出应用12.5 g胆矾或8.0 g硫酸铜,因 此A、B项错误;由于配制500 mL溶液,故C加水 500 mL应是错误的,而应加水稀释至500 mL。 D 5.已知某饱和溶液的①体积,②密度,③溶质和溶剂 的质量比,④溶质的摩尔质量,要根据溶质的溶解 度计算该溶液的物质的量浓度,上述条件中必不可 少的是 ( ) A.②④ B.①④ C.①②③ D.①②③④ 解析 给出溶质的溶解度,既可知100 g H2O中溶解 溶质的质量,也可知溶液的质量为(100+S)g,由 cB= 知,只要知道溶液的密度②和溶质的摩尔质 量④,即可计算该溶液的物质的量浓度,故选择A。 V nB A 6.在1 L K2SO4、CuSO4的混合溶液中,c(SO )= 2mol/L,用石墨作电极电解此溶液,当通电一段 时间后,两极均收集到22.4 L气体(标准状况), 原溶液中c(K+)为 ( ) A.0.5 mol/L B.1 mol/L C.1.5 mol/L D.2 mol/L 解析 电解K2SO4和CuSO4的混合溶液,根据离 子的放电顺序,在阳极上发生反应: 4OH--4e- 2H2O+O2↑ 当阳极上收集到1 molO2时,转移的电子的物质的 量为4 mol。 2- 4 在阴极上先发生反应:Cu2++2e- Cu 再发生反应:2H++2e- H2↑ 当阴极上收集到1 mol H2时,转移电子的物质的量 为2 mol,则另2 mol的电子是由溶液中的Cu2+获得, 即CuSO4为1 mol。因c(SO )=2 mol/L,故K2SO4亦为 1 mol,c(K+)= 。 2- 4 mol/L2 L1 mol21 答案 D 7.下列叙述正确的是 ( ) A.同温同压下,相同体积的物质,它们的物 质的量必相等 B.任何条件下,等物质的量的乙烯和一氧化碳 所含的分子数必相等 C.1 L一氧化碳气体一定比1 L氧气的质量小 D.等体积、等物质的量浓度的强酸中所含的H+数一 定相等 解析 A项未指明物质的存在状态,即固态、液态还 是气态,所以A无法确定物质的量是否相等,故A错 误;B项中物质的量相等的乙烯和一氧化碳,不论 条件如何,其所含的分子数总是相等的,故B正确; C项未指明温度和压强,无法确定其质量大小,所 以C错误;D项中强酸未指明是几元强酸,无法确定 H+数目的多少,所以D项错误。 答案 B 8.已知质量分数为25%的氨水的密度为0.91 g/cm3, 质量分数为5%的氨水的密度为0.98 g/cm3,若将 上述两溶液等体积混合,所得氨水溶液的质量分数 是 ( ) A.等于15% B.大于15% C.小于15% D.无法估算 解析 由于氨水是浓度越大密度反而越小的溶液, 故等体积混合的w<= =15%。2 21 ww c 9.下列叙述中正确的是 ( ) ①在标准状况下,0.2 mol任何物质的体积均为 4.48 L ②当1 mol气体的体积为22.4 L时,它一定处于标 准状况下 ③标准状况下,1 L HCl和1 L H2O的物质的量 相同 ④标准状况下,1 g H2和14 g N2的体积相同 ⑤28 g CO的体积为22.4 L ⑥两种物质的物质的量相同,则它们在标准状况 下的体积也相同 ⑦在同温同体积时,气体物质的物质的量越大,则 压强越大 ⑧同温同压下,气体的密度与气体的相对分子质量 成正比 A.①②③④ B.②③⑥⑦⑧ C.⑤⑥⑦⑧ D.④⑦⑧ 解析 ①错在不是任何物质,只能是气体。②结论 太片面,1 mol气体在温度和压强符合一定关系时, 也能使体积占有22.4 L。③错在标准状况下水不是 气体。⑤错在没有标明标准状况。⑥错在没有说明 物质是否为气态。 答案 D 10.下列说法正确的是 ( ) A.同温同压下,相同数目的分子必占有相同的体 积 B.质量相等、密度不等的N2和C2H4所含有的分 子 数一定相等 C.不同的气体,若体积不等,则它们所含的分子 数一定不等 D.一定温度、压强下,气体体积由其分子的大小 决定解析 本题主要考查阿伏加德罗定律及其推论。 A中的“分子”不一定是气体,故A错;B中因 为 M(N2)=M(C2H4)=28 g/mol, 所以同质量的N2、C2H4所含的分子数一定相等, 故B对,“不同密度”为干扰项,要注意抓住本 质,排除干扰;只有在同温同压下,不同的气 体,若体积不等,则它们所含的分子数才一定不 等,故C错;D中温度、压强一定,则气体分子间 的平均距离一定,则气体体积由其物质的量的多 少决定,而不是由其分子的大小决定,故D错。 答案 B 11.设NA表示阿伏加德罗常数的值,下列有关NA 的叙述中正确的有 ( ) ①0.25 mol Na2O2中含有的阴离子数为 0.5NA ②7.5 g SiO2晶体中含有的硅氧键数为0.5NA ③1 mol 氨基乙酸(甘氨酸)分子中存在10NA对 共用电子 ④250 mL 2 mol/L的氨水中含有NH3·H2O的分子数 为0.5NA ⑤3.0 g淀粉和葡萄糖混合物中共含碳原子数为 0.1NA ⑥18 g D2O(重水)完全电解,转移NA个电子 ⑦标准状况下,2.24 L CHCl3含有的分子数为0.1NA ⑧电解精炼铜时,当阳极溶解32 g铜时,转移的电 子数为NA个 A.2个 B.3个 C.4个 D.5个 α 解析 ①中含O 0.25NA;④中NH3·H2O要发生 电离 和分解;⑤中淀粉中的葡萄糖单元的组成为 C6H10O5,与葡萄糖分子组成不同;⑦中标准状况 下 CHCl3为液体;⑧粗铜中有比铜更易失电子的金属 杂质;故只有②③两项正确。 2- 2 答案 A 12.某化工厂生产的氨水的物质的量浓度为20 mol/L, 实验室若需用80 mL浓度为5 mol/L的氨水时, 需量取20 mol/L的氨水 mL;配制该溶液 时,除用到100 mL容量瓶外,还需要的玻璃仪 器有 。 25.0 玻璃棒、胶头滴管、烧杯、量筒 13.实验室要配制250 mL 0.8 mol/L的NaOH溶液。 (1)需称取NaOH固体 g。 (2)某同学用托盘天平称量一个烧杯的质量,用 “↓”表示在天平托盘上放上砝码,用“↑”表示 从托盘上取下砝码,称量过程如下: 砝码质量/g 50 20 20 10 5 取用砝码情况 ↓↑ ↓ ↓↑ ↓ ↓↑ 此时天平平衡,则烧杯的质量为 g,右盘再 放 g砝码,将游码移至 g位置,继续称 量NaOH质量。 (3)配制方法:设计五步操作 ①向盛有NaOH固体的烧杯中加入30 mL蒸馏水使其 溶解,冷却至室温;②继续向容量瓶中加水至液面 离刻度1~2 cm;③将NaOH溶液沿玻璃棒注入250 mL容量瓶中;④在烧杯中加入少量蒸馏水,小心洗 涤2~3次,并将洗涤液一并注入容量瓶中;⑤改用胶 头滴管加水至刻度线,加盖摇匀。 以上操作正确的顺序是 (填序号,下同)。 (4)以下操作,会使实验结果偏高的是 。 ①定容时俯视刻度线;②定容时仰视刻度线; ③所用容量瓶事先用NaOH溶液润洗;④称量 NaOH时,称量时间太长;⑤摇匀后,将所配溶 液装入用蒸馏水洗净的试剂瓶中。 答案 (1)8.0 (2)31.2 5 4.2 (3)①③④②⑤ (4)①③ 14.三农问题是政府和社会关注的问题,化肥是土地 的营养品。某农资商店出售一种化肥,其有效成 分为氯化铵,现欲测定该种化肥中氮元素的质量 分数,设计实验步骤如下(杂质中不含氮元素, 且杂质均不与盐酸或氢氧化钠溶液反应): ①配制1.00 mol/L的HCl溶液和1.00 mol/L的NaOH溶液; ②每次取1.00 g此化肥样品,溶于20 mL蒸馏水中 ③加入30.00 mL 1.00 mol/L的NaOH溶液,将反应后的溶液加 热煮沸约1分钟,冷却至常温; ④…… ⑤重复②③④步操作1~2次; ⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数。 请回答下列问题: (1)写出步骤④中的实验内容 , 写出实验步骤④中的离子方程式: 。 (2)下列仪器中,配制盐酸和氢氧化钠溶液都能用 到的是 (填字母选项)。 A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗 (3)步骤⑤的实验目的是 。 (4)配制本实验所需的1.00 mol/L的盐酸和 1.00 mol/L的 NaOH溶液从节约化学药品的角度出发,最好应选用的容量 瓶规格分别为 (填字 母选项)。 A.50 mL,50 mL B.150 mL,100 mL C.100 mL,150 mL D.250 mL,500 mL (5)若以Vx(mL)表示实验所测定消耗盐酸数据 的平均值,该化肥样品中氮元素的质量分数计算表 达式为 。(不需要化简) 答案 (1)以酚酞为指示剂,用1.00 mol/L的 HCl溶液滴定,达到滴定终点用去V(mL) OH-+H+ H2O (2)AC (3)减小误差,提高实验结果的准确度。 (4)C (5)(0.03×1-Vx×1×10-3)×14×100% 15.向100 mL某二价金属M的氢氧化物澄清溶液中加入过量的 NaHCO3溶液生成了MCO3沉淀。过滤,将沉淀置于足量的盐 酸中,在标准状况下收集到4.48 L气体;将滤液加水稀释到 250 mL,取出25 mL恰好与20 mL盐酸完全反应,标准状况下 收集到1.12 L气体。 (1)M的氢氧化物与NaHCO3反应的化学方程式 为: 。 (2)要计算M的相对原子质量,你认为还必须提 供下列哪项数据 (选填字母序号)。 A.M的氢氧化物溶液的物质的量浓度(设为2 mol/L) B.M的碳酸盐的质量(设为39.4 g) C.与M的碳酸盐反应的盐酸的物质的量浓度(可设为 0.1 mol/L) D.题设数据充足,不需要补充数据根据你的选择, 试列式计算金属M的相对原子质量。 (3)求与滤液反应的盐酸的物质的量浓度。 答案 (1)M(OH)2+2NaHCO3 MCO3↓+ Na2CO3+2H2O (2)B 由C守恒可知:n(MCO3)=n(CO2) =4.48 L÷22.4 L/mol=0.2 mol M(MCO3)=39.4 g÷0.2 mol=197 g/mol M的相 对原子质量为:197-60=137 (3)5.0 mol/L查看更多