- 2021-07-09 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学 讲课曹春青周期律
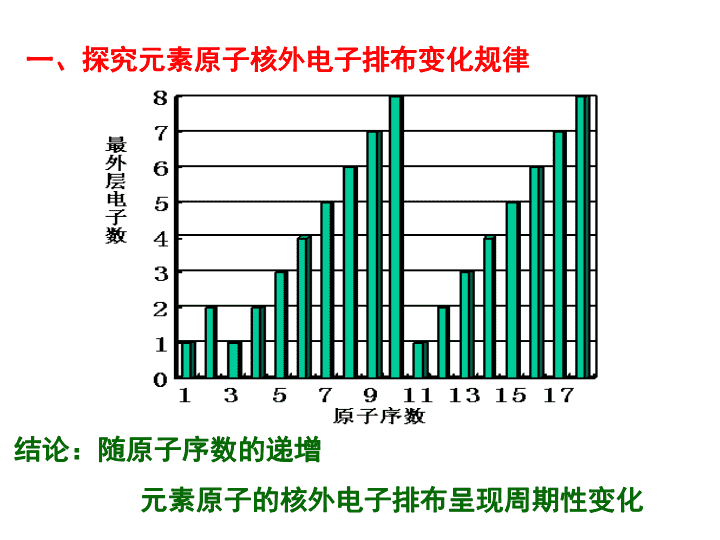
元素周期律 结论:随原子序数的递增 元素原子的核外电子排布呈现周期性变化 一、探究元素原子核外电子排布变化规律 二、探究元素原子半径的变化规律 结论: 随原子序数的递增元素原子半径呈现周期性变化 三、探究元素化合价的变化规律 结论:随原子序数的递增元素化合价呈现周期性变化 四、探究元素金属性、非金属性的变化规律 比较元素金属性强弱的实验方案 Ø单质跟水(或酸)反应置换出氢气的难易 Ø最高价氧化物的水化物—氢氧化物的碱性强弱 Ø金属性强的单质可以置换金属性弱的单质 比较元素非金属性强弱的实验方案 Ø单质与氢气生成气态氢化物的难易程度 Ø最高价氧化物水化物---最高价含氧酸的酸性强 弱 Ø非金属性强的单质可以置换非金属性弱的单质 Ø对应氢化物的稳定性 四、探究元素金属性、非金属性的变化规律 结论: 随原子序数的递增元素的金属性、非金属性呈现 周期性变化 随原子序数递增 核外电子排布 原子半径 元素主要化合价 周期性变化 元素金属性 非金属性 元素周期律 1、下列排列顺序正确的是( ) ①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O ③酸性:H3PO4>H2SO4>HClO4 ④与同浓度盐酸反应剧烈程度:Na > Mg > Al A.①③ B.②④ C.①④ D.②③ 课堂反馈 2、下列有关原子结构和元素周期律的表述正确的是( ) A.原子序数为15的元素的最高化合价为+3 B.ⅦA族元素是同周期中非金属性最强的元素 C.除零族元素外,短周期元素的最高化合价在数值上都 等于该元素所属的族序数 D.难得电子的元素一定易失电子。 B B 3、表中数据是部分短周期元素的原子半径及主要化 合价,据此判断以下叙述正确的是( ) 元素代号 L M Q R T 原子半径 /nm 0.160 0.143 0.112 0.104 0.066 主要化合 价 +2 +3 +2 +6、 -2 -2 A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等 C 4、在一定条件下 RO3n- + 6I-+ 6H+ = R-+3I2+3H2O 则RO3n-中R元素的化合价为___ R原子最外层电子数为______ +5 7 追求是一个永恒的“元素周期律”, 到了终点,又是一个的新起点!查看更多