- 2021-07-09 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
备战2021年高考化学模拟专练卷02(学生版)
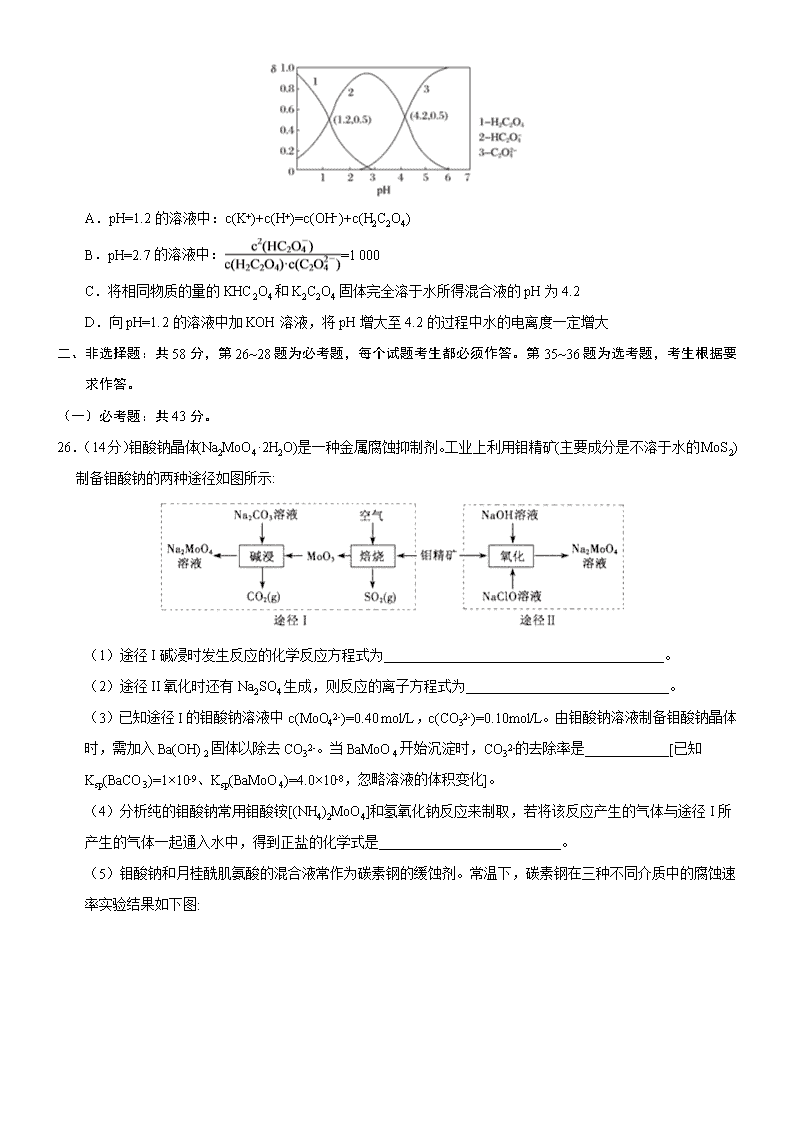
模拟专练卷 02 化 学 可能用到的相对原子质量:H-1 O-16 S-32 Cu-64 Ba-137 一、选择题:本题共 7 个小题,每小题 6 分。共 42 分,在每小题给出的四个选项中,只有一项是符合题目要求 的。 7.一场突如其来的“新冠疫情”让我们暂时不能正常开下列说法中正确的是 A.垃圾分类清运是防止二次污染的重要一环,废弃口罩属于可回收垃圾 B.为了防止感染“新冠病毒”,坚持每天使用无水酒精杀菌消毒 C.以纯净物聚丙烯为原料生产的熔喷布,在口罩材料中发挥着不可替代的作用 D.中国研制的新冠肺炎疫苗已进入临床试验阶段,抗病毒疫苗需要低温保存 8.通常检测 SO2 含量是否达到排放标准的反应原理是 SO2+H2O2+BaCl2=BaSO4↓+2HCl。设 NA 表示阿伏加德 罗常数的值,下列说法错误的是 A.生成 2.33gBaSO4 沉淀时,转移电子数目为 0.02NA B.SO2 具有漂白性,从而可使品红褪色 C.17gH2O2 中含有非极性键的数目为 0.5NA D.0.1molBaCl2 晶体中所含分子总数为 0.1NA 9.下列实验操作与预期实验目的或所得实验结论一致的是 选项 实验操作和现象 预期实验目的或结论 A 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼 烧,火焰显黄色 说明该食盐试样不含 KIO3 B SiO2 能与氢氟酸及碱反应 SiO2 是两性氧化物 C 向两支盛有 KI3 的溶液的试管中,分别滴加淀粉溶液 和 AgNO3 溶液,前者溶液变蓝,后者有黄色沉淀 KI3 溶液中存在平衡: �� � ⇌I2+I- D 室温下向 CuCl2 和少量 FeCl3 的混合溶液中,加入铜 屑,充分搅拌,过滤,得蓝绿色溶液 除去杂质 FeCl3 得纯净 CuCl2 溶液 10.W、X、Y、Z 是原子序数依次增大的前四周期元素,W、X 是空气中含量最高的两种元素,Y 的合金是当 今世界使用量最大的合金,Z 的单质常温下为液态。下列说法不正确的是 A.单质 Z 保存时需要加水形成液封 B.Y 的金属性弱于第三周期的所有金属元素 C.W 与 X 能形成二元化合物并非全部是酸性氧化物 D.向 YZ2 溶液中通人少量氯气会发生置换反应 11.BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,合成方法有如下两种: 下列说法错误的是 A. 能与 Na2CO3 溶液反应 B. 与 BHT 互为同系物 C.BHT 久置于空气中会被氧化 D.两种方法的反应类型都是加成反应 12.某溶液中可能含有 Na+、K+、NH4 +、Cu2+、SO42-、SO32-、MnO4 -、Cl-、Br-、CO32-等离子,且所含离子 的物质的量的浓度都相等。往该溶液中加入过量的 BaCl2 和盐酸的混合溶液,无白色沉淀生成。某同学另取 少量原溶液,设计并完成了如下实验: 则关于原溶液组成的判断中正确的是: A.肯定不存在的离子是 Cu2+、SO42-、CO32-、MnO4 -,而是否含 NH4 +另需实验验证; B.肯定存在的离子是 SO32-、Br-,且 Na+、K+至少有一种存在; C.无法确定原溶液中是否存在 Cl-; D.若步骤中 Ba(NO3)2 和 HNO3 溶液改用 BaCl2 和盐酸的混合溶液,对溶液中离子的判断无影响。 13.已知草酸为二元弱酸: H2C2O4 HC2O +H+ Ka1 HC2O C2O +H+ Ka2 常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的 KOH 溶液,所得溶液中 H2C2O4、HC2O 、 C2O 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法不正确的是 A.pH=1.2 的溶液中:c(K+)+c(H+)=c(OH−)+c(H2C2O4) B.pH=2.7 的溶液中: =1 000 C.将相同物质的量的 KHC2O4 和 K2C2O4 固体完全溶于水所得混合液的 pH 为 4.2 D.向 pH=1.2 的溶液中加 KOH 溶液,将 pH 增大至 4.2 的过程中水的电离度一定增大 二、非选择题:共 58 分,第 26~28 题为必考题,每个试题考生都必须作答。第 35~36 题为选考题,考生根据要 求作答。 (一)必考题:共 43 分。 26.(14 分)钼酸钠晶体(Na2MoO4·2H2O)是一种金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的 MoS2) 制备钼酸钠的两种途径如图所示: (1)途径 I 碱浸时发生反应的化学反应方程式为________________________________________。 (2)途径 II 氧化时还有 Na2SO4 生成,则反应的离子方程式为_____________________________。 (3)已知途径 I 的钼酸钠溶液中 c(MoO42-)=0.40 mol/L,c(CO32-)=0.10mol/L。由钼酸钠溶液制备钼酸钠晶体 时,需加入 Ba(OH)2 固体以除去 CO32-。当 BaMoO4 开始沉淀时,CO32-的去除率是____________[已知 Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]。 (4)分析纯的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径 I 所 产生的气体一起通入水中,得到正盐的化学式是__________________________。 (5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速 率实验结果如下图: ①当硫酸的浓度大于 90%时,碳素钢腐蚀速率几乎为零,原因是________________________。 ②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为 300mg·L-1,则缓蚀效果最好时钼酸钠(M=206g/mol) 的物质的量浓 度为__________________(计算结果保留 3 位有效数字)。 (6)二硫化钼用作电池的正极材料时接受 Li+的嵌入,锂和二硫化钼形成的二次电池的总反应 为:xLi+nMoS2 Lix(MoS2)n。则电池放电时正极的电极反应是:_____________________。 27.(14 分)甲酸(化学式 HCOOH,分子式 CH2O2,相对分子质量 46),俗名蚁酸,是最简单的羧酸,无色而有 刺激性气味的易挥发液体。熔点为 8.6 ℃,沸点 100.8℃,25℃电离常数 Ka=1.8×10-4。某化学兴趣小组进行 以下实验。 Ⅰ.用甲酸和浓硫酸制取一氧化碳 A. B. C. D. (1)请说出图 B 中盛装碱石灰的仪器名称__________。用 A 图所示装置进行实验。利用浓硫酸的脱水性, 将甲酸与浓硫酸混合,甲酸发生分解反应生成 CO,反应的化学方程式是________。 (2)如需收集 CO 气体,连接上图中的装置,其连接顺序为:a→__________(按气流方向,用小写字母表示)。 Ⅱ.对一氧化碳的化学性质进行探究 资料:ⅰ.常温下,CO 与 PdCl2 溶液反应,有金属 Pd 和 CO2 生成,可用于检验 CO; ⅱ.一定条件下,CO 能与 NaOH 固体发生反应:CO+NaOH 47�K 10MPa HCOONa 利用下列装置进行实验,验证 CO 具有上述两个性质。 (3)打开 k2,F 装置中发生反应的化学方程式为_____________;为了使气囊收集到纯净的 CO,以便循环使 用,G 装置中盛放的试剂可能是_________。 (4)现需验证 E 装置中 CO 与 NaOH 固体发生了反应,某同学设计下列验证方案:取少许固体产物,配置成 溶液,在常温下测该溶液的 pH,若 pH>7,证明 CO 与 NaOH 固体发生了反应。该方案是否可行,请简述你 的观点和理由:________,_________。 (5)25℃甲酸钠(HCOONa)的水解平衡常数 Kh 的数量级为____________。若向 100ml 0.1mol.L-1 的 HCOONa 溶液中加入 100mL0.2mol.L-1 的 HCl 溶液,则混合后溶液中所有离子浓度由大到小排序为_________。 28.(15 分)1799 年,英国化学家汉弗莱·戴维发现了 N2O 气体。在食品行业中,N2O 可用作发泡 剂和密封剂。 (1)N2 是硝酸生产中氨催化氧化的副产物,NH3 与 O2 在加热和催化剂的作用下生成 N2O 的化学方程式为 ________。 (2)N2O 在金粉表面发生热分解反应:2N2O(g) =2N2(g)+O2(g) △H。 已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) △H1=-1010KJ/mol 4NH3(g)+3O2(g) =2N2(g)+6H2O(l) △H2=-1531KJ/mol △H=__________。 (3)N2O 和 CO 是环境污染性气体,研究表明,CO 与 N2O 在 Fe+作用下发生反应:N2O(g)+CO(g)⇌ CO2(g) 十 N2(g)的能量变化及反应历程如下图所示,两步反应分别为:反应①Fe++N2O⇌FeO+N2;反应② ______________ 由图可知两步反应均为____(填“放热”或“吸热”)反应,由______(填“反应①或反应②”)决定反应达到平衡所用 时间。 (4)在固定体积的密闭容器中,发生反应:N2O(g)+CO(g)⇌ CO2(g)+N2(g),改变原料气配比进行多组实验(各 次实验的温度可能相同,也可能不同),测定 N2O 的平衡转化率。部分实验结果如图所示: ①如果要将图中 C 点的平衡状态改变为 B 点的平衡状态,应采取的措施是:____ ; ②图中 C、D 两点对应的实验温度分别为 TC 和 TD,,通过计算判断 TC____TD(填“>”“=”或“<”)。 (5)在某温度下,向 1L 密闭容器中充入 CO 与 N2O,发生反应:N2O(g)+CO(g)⇌ CO2(g)十 N2(g),随着反 应的进行,容器内 CO 的物质的量分数变化如下表所示: 时间/min 0 2 4 6 8 10 物质的量分数 50.0% 40.25% 32.0% 26.2% 24.0% 24.0% 则该温度下反应的平衡常数 K=____。 (二)选考题:共 15 分。请考生从 2 道化学题中任选一题作答。如果多做,则按所做的第一题计分。 35.[化选修 3:物质结构与性质](15 分) Fe、Cu、Cr 都是第四周期过渡元素,回答下列问题。 (1)FeCl3 是一种常用的净水剂,氯元素的原子核外有____种不同运动状态的电子;有___种不同能级的电子, 基态 Fe3+的电子排布式为___。 (2)实验室中可用 KSCN 或 K4[Fe(CN)6]来检验 Fe3+。FeCl3 与 KSCN 溶液混合,可得到配位数为 5 的配合物 的化学式是____;K4[Fe(CN)6]与 Fe3+反应可得到一种蓝色沉淀 KFe[Fe(CN)6],该物质晶胞的 1 � 结构如图所示(K+ 未画出),则一个晶胞中的 K+个数为 ___。 (3)Cu2+能与乙二胺(H2N-CH2-CH2-NH2)形成配离子。该配离子中含有的化学键类型有 __ (填字母) a.配位键 b.极性键 c.离子键 d.非极性键, 乙二胺中共有____个σ键,C 原子的杂化方式为 ___。 (4)金属铜的晶胞为面心立方最密堆积,边长为 361pm。又知铜的密度为 9.0g·cm-3,则铜原子的直径约为 ____pm。 (5)Cr 是周期表中第ⅥB 族元素,化合价可以是 0~+6 的整数价态。回答下列问题。某化合物的化学式为 Na3CrO8,其阴离子结构可表示为 ,则 Cr 的化合价为____。CrO42-呈四面体构型,结构为 , Cr2O72-由两个 CrO42-四面体组成,这两个 CrO42-四面体通过共用一个顶角氧原子彼此连接,结构为 。 则由 n(n>1)个 CrO42-通过顶角氧原子连续的链式结构的化学式为____。 36.[化选修 5:有机化学基础](15 分) 氯吡格雷是一种用于预防和治疗因血小板高聚集引起的心、脑及其他动脉循环障碍疾病的药物。以 A 为原料 合成该药物的路线如图: (1)A 的化学名称是__,C 中的官能团除了氯原子,其他官能团名称为__。 (2)A 分子中最少有__原子共面。 (3)C 生成 D 的反应类型为__。 (4)A 与新制 Cu(OH)2 反应的化学方程式为__。 (5)物质 G 是物质 A 的同系物,比 A 多一个碳原子,符合以下条件的 G 的同分异构体共有__种。 ①除苯环之外无其他环状结构;②能发生银镜反应。③苯环上有只有两个取代基。 其中核磁共振氢谱中有 4 个吸收峰,且峰值比为 2∶2∶2∶1 的结构简式为__。 (6)已知: ,写出以苯甲醇为有机原料制备化合物 的合成路线(无机试剂任选)。查看更多