2021届高考化学一轮复习弱电解质的电离作业
考点规范练22 弱电解质的电离
(时间:45分钟 满分:100分)
考点规范练第44页
一、选择题(本题共10小题,每小题5分,共50分。每小题只有一个选项符合题目要求)
1.下列电离方程式中正确的是( )。
A.NaHSO4溶于水:NaHSO4Na++H++SO42-
B.次氯酸电离:HClOClO-+H+
C.HF溶于水:HF+H2OH3O++F-
D.NH4Cl溶于水:NH4++H2ONH3·H2O+H+
答案:C
解析:NaHSO4是强电解质,溶于水后能完全电离,电离方程式应使用“”,A项错误;HClO是弱酸,电离方程式中应使用“”,B项错误;NH4Cl溶于水的电离方程式是NH4ClNH4++Cl-,D项错误。
2.下列关于pH=3的CH3COOH溶液的叙述正确的是( )。
A.溶液中H2O电离出的c(OH-)=1.0×10-3 mol·L-1
B.加入少量CH3COONa固体后,溶液pH升高
C.加0.1 mol·L-1 CH3COONa溶液使pH>7,则c(CH3COO-)=c(Na+)
D.与等体积pH=11的NaOH溶液混合,所得溶液呈中性
答案:B
解析:酸抑制水的电离,pH=3的CH3COOH溶液,酸提供的c(H+)=1.0×10-3 mol·L-1,水电离产生的c(H+)=c(OH-)=1.0×10-11 mol·L-1,A项错误;CH3COOH溶液存在电离平衡:CH3COOHCH3COO-+H+,加入少量CH3COONa固体后,增大了c(CH3COO-),平衡左移,c(H+)减小,溶液pH升高,B项正确;根据电荷守恒:c(H+)+c(Na+)=c(CH3COO-)+c(OH-),溶液pH>7,c(H+)
HY>HZ
B.反应HZ+Y-HY+Z-能够发生
C.相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液的pH最大
D.相同温度下,1 mol·L-1 HX溶液中HX的电离常数大于0.1 mol·L-1 HX溶液中HX的电离常数
答案:B
解析:相同温度下,K(HZ)>K(HY)>K(HX),所以酸的强弱关系为HZ>HY>HX,可知A、C项不正确,B项正确;电离常数只与温度有关,与浓度无关,D项不正确。
6.25 ℃时,下列有关电解质溶液的说法正确的是( )。
A.稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大
B.向NaF溶液中滴加硫酸至中性时,c(SO42-)K2
答案:B
解析:稀醋酸中加入冰醋酸,醋酸电离平衡右移,但电离度减小,A错误。向NaF溶液中滴加硫酸至中性时,根据物料守恒:c(Na+)=c(HF)+c(F-);根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(F-)+2c(SO42-),消去c(Na+)可得:c(HF)+c(H+)=c(OH-)+2c(SO42-);溶液显中性,则c(H+)=c(OH-),所以c(HF)=2c(SO42-),则c(SO42-)Ka(HZ)>Ka2(H2S)>Ka(HR)
B.结合H+的能力:Z->S2->R->HS-
C.同温同浓度下,溶液的pH:NaHS>NaR>Na2S>NaZ
D.HZ与Na2S反应的离子方程式:HZ+S2-HS-+Z-
答案:B
解析:由题给两个反应可知,酸性强弱关系为H2S>HR>HS->HZ,酸性越强,Ka越大,所以相同温度下电离平衡常数:Ka1(H2S)>Ka(HR)>Ka2(H2S)>Ka(HZ),A项错误;酸性越弱,酸越难电离,对应酸根离子越易结合H+,所以结合H+能力:Z->S2->R->HS-,B项正确;依据“越弱越水解”,同温同浓度下,NaZ溶液的pH最大,C项错误;HZ与Na2S不反应,D项错误。
8.根据下表提供的数据可知,在溶液中能大量共存的粒子组是( )。
化学式
电离常数
CH3COOH
K=1.8×10-5
HCN
K=4.9×10-10
H2CO3
K1=4.4×10-7,K2=4.7×10-11
A.H2CO3、HCO3-、CH3COO-、CN-
B.HCO3-、CH3COOH、CN-、CO32-
C.HCN、HCO3-、CN-、CO32-
D.HCN、HCO3-、CH3COO-、CN-
答案:D
解析:根据表中电离常数可知,酸性:CH3COOH>H2CO3>HCN>HCO3-。A项,H2CO3的酸性强于HCN,H2CO3和CN-能够反应生成HCO3-和HCN,在溶液中不能大量共存,故A错误;B项,CH3COOH的酸性强于H2CO3、HCN,CH3COOH能够与HCO3-、CN-、CO32-反应,在溶液中不能大量共存,故B错误;C项,HCN的酸性强于HCO3-,HCN与CO32-反应生成HCO3-,在溶液中不能大量共存,故C错误;D项,HCN、HCO3-、CH3COO-、CN-之间不反应,在溶液中能够大量共存,故D正确。
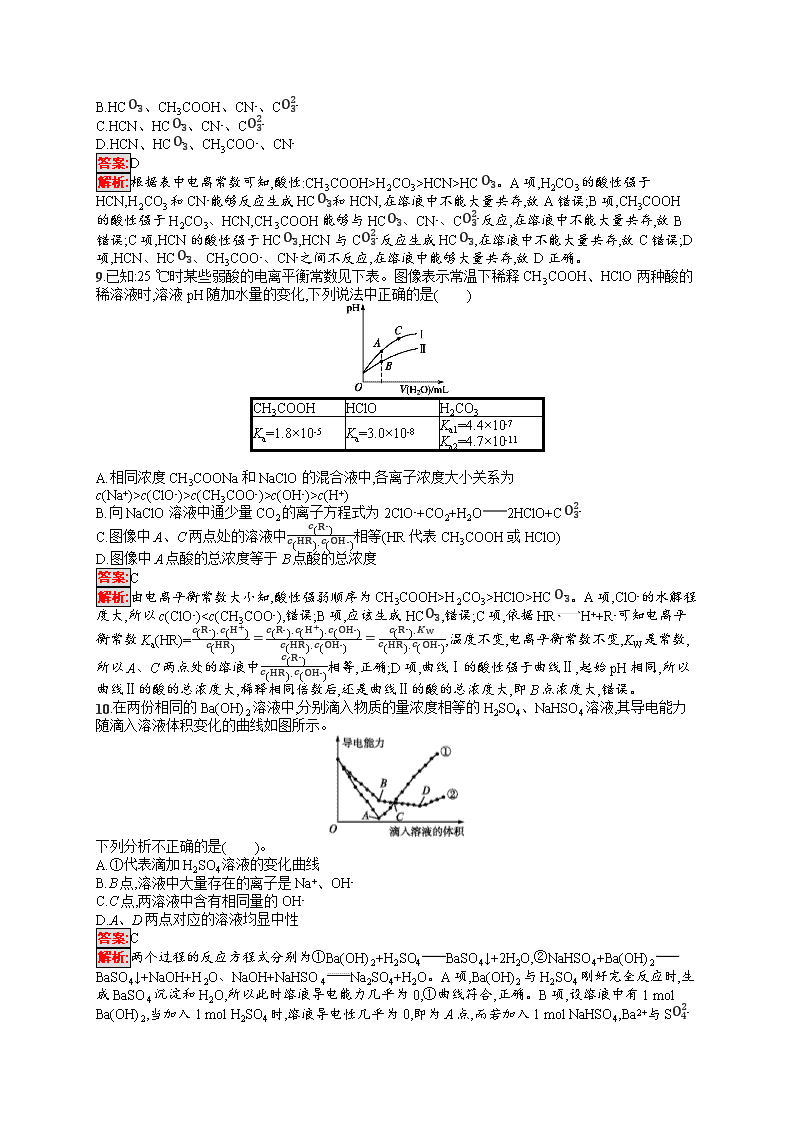
9.已知:25 ℃时某些弱酸的电离平衡常数见下表。图像表示常温下稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法中正确的是( )
CH3COOH
HClO
H2CO3
Ka=1.8×10-5
Ka=3.0×10-8
Ka1=4.4×10-7
Ka2=4.7×10-11
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度大小关系为
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.向NaClO溶液中通少量CO2的离子方程式为2ClO-+CO2+H2O2HClO+CO32-
C.图像中A、C两点处的溶液中c(R-)c(HR)·c(OH-)相等(HR代表CH3COOH或HClO)
D.图像中A点酸的总浓度等于B点酸的总浓度
答案:C
解析:由电离平衡常数大小知,酸性强弱顺序为CH3COOH>H2CO3>HClO>HCO3-。A项,ClO-的水解程度大,所以c(ClO-)K(HClO)>K2(H2CO3),发生反应的离子方程式为CO2+ClO-+H2OHClO+HCO3-。在NaClO溶液中ClO-+H2OHClO+OH-,若ClO-水解的浓度为
x mol·L-1,水解后c(HClO)=c(OH-)=x mol·L-1,
由K(HClO)=c(ClO-)·c(H+)c(HClO)=c(ClO-)·KWc(HClO)·c(OH-),即(1.2-x)×10-14x2=3.0×10-8,
解得:x=2.0×10-3.5,故pOH=-lg(2×10-3.5)=3.2,pH=10.8。
(3)设该温度下,0.10 mol·L-1的CH3COOH溶液中CH3COO-的浓度为y mol·L-1, K(CH3COOH)=c(CH3COO-)·c(H+)c(CH3COOH)=y20.10-y=1.96×10-5,解得y=1.4×10-3。
12.(2019江西新余一中、宜春一中高三联考)(8分)食醋中含有CH3COOH。请回答下列问题:
(1)下列说法正确的是 。
A.向某温度下的CH3COOH溶液中通入HCl气体,醋酸的电离平衡常数会增大
B.向0.1 mol·L-1 CH3COOH溶液中通入HCl气体,溶液中c(H+)c(CH3COOH)值增大
C.食醋加水稀释过程中酸味不变
D.等体积等浓度的CH3COOH溶液、HCl溶液分别与足量NaHCO3反应,放出的气体体积相等
(2)研究CH3COOH的电离平衡。已知在25 ℃时,CH3COOH、H2CO3、H2SO3的电离平衡常数如下表所示。
酸
电离常数
CH3COOH
K=1.8×10-5
H2CO3
K1=4.1×10-7 K2=5.6×10-11
H2SO3
K1=1.5×10-2 K2=1.0×10-7
①H2CO3第一步电离的电离常数表达式为 。
②CH3COOH溶液加入Na2SO3溶液中是否能发生反应? (填“能”或“不能”);若能,其产物为 ,NaHSO3溶液呈酸性的原因为 。
③CH3COOH溶液加水稀释100倍,图中的纵坐标可以是 。
A.溶液的pH
B.CH3COOH的电离常数
C.溶液的导电能力
D.CH3COOH的电离程度
答案:(1)BD
(2)①K1=c(H+)·c(HCO3-)c(H2CO3) ②能 NaHSO3、CH3COONa
HSO3-的电离程度大于其水解程度 ③C
解析:(1)电离常数只与温度有关,温度不变,电离平衡常数不变,A项错误;0.1 mol·L-1 CH3COOH溶液中存在电离平衡:CH3COOHCH3COO-+H+,通入HCl气体,c(H+)增大,平衡左移,c(CH3COOH)增大,但c(H+)增大的程度远大于c(CH3COOH)增大的程度,所以c(H+)c(CH3COOH)值增大,B项正确;食醋加水稀释过程中,c(H+)降低,酸味变淡,C项错误;CH3COOH和HCl都是一元酸,两者溶液的体积和浓度相等时,消耗的NaHCO3的量相等,放出的CO2的体积也相等,D项正确。
(2)①H2CO3的第一步电离方程式为H2CO3H++HCO3-,K1=c(H+)·c(HCO3-)c(H2CO3)。②根据CH3COOH和H2SO3的电离常数,可知酸性:H2SO3>CH3COOH>HSO3-,根据“强酸制弱酸”原理,CH3COOH能与Na2SO3反应生成NaHSO3和CH3COONa。HSO3-的电离程度大于其水解程度,导致NaHSO3溶液呈酸性。③CH3COOH溶液加水稀释,CH3COOH的电离程度增大,但n(H+)增大的程度小于溶液体积增大的程度,故c(H+)减小,因此pH增大,A项、D项错误;电离常数只与温度有关,因此稀释时CH3COOH的电离常数不变,B项错误;加水稀释时溶液中离子浓度减小,故溶液的导电能力降低,C项正确。
13.(16分)现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定增大的是 。
A.c(H+)
B.c(H+)c(CH3COOH)
C.c(H+)·c(OH-)
D.c(OH-)c(H+)
(2)取10 mL的乙溶液,加入等体积的水,醋酸的电离平衡 (填“向左”“向右”或“不”)移动;另取10 mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)c(CH3COOH)的比值将 (填“增大”“减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为V(甲) (填“>”“<”或“=”)V(乙)。
(4)已知25 ℃时,三种酸的电离平衡常数如下:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数K1
1.8×10-5
4.4×10-7
3.0×10-8
电离平衡常数K2
—
4.7×10-11
—
下列四种离子结合H+能力最强的是 。
A.HCO3-
B.CO32-
C.ClO-
D.CH3COO-
(5)常温下,取甲溶液稀释到体积为原来的100倍,其pH= ;取99 mL甲溶液与1 mL 1 mol·L-1的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH= 。
答案:(1)BD (2)向右 减小 (3)< (4)B (5)4 10
解析:(1)CH3COOH溶液加水稀释过程中促进电离,但c(H+)减小,A错误;c(H+)c(CH3COOH)=c(H+)c(CH3COOH)×c(CH3COO-)c(CH3COO-)=Kc(CH3COO-),K不变,醋酸根离子浓度减小,则稀释过程中比值变大,B正确;温度不变,KW不变,C错误;稀释过程促进电离,c(H+)减小,c(OH-)增大,则c(OH-)c(H+)的值变大,D正确。
(2)醋酸是弱电解质,加水稀释促进醋酸电离,所以醋酸电离平衡向正反应方向移动;向醋酸中加入醋酸钠固体,溶液中醋酸根离子浓度增大,抑制醋酸电离,则氢离子浓度减小,醋酸分子浓度增大,所以c(H+)c(CH3COOH)减小。
(3)pH相等的醋酸和盐酸,醋酸的浓度大于盐酸,等体积等pH的两种酸,醋酸的物质的量大于HCl,酸的物质的量越多需要等浓度的氢氧化钠溶液体积越大,所以消耗的NaOH溶液的体积大小关系为V(甲)H2CO3>HClO>HCO3-,酸性越弱,对应的酸根离子结合氢离子的能力越强,则结合氢离子能力最强的为CO32-。
(5)pH=2的盐酸稀释到原体积的10n倍,pH增大n,所以取甲溶液稀释到原体积的100倍,pH为4;99 mL 0.01 mol·L-1的盐酸与1 mL 1 mol·L-1的NaOH溶液混合,溶液显碱性,c(OH-)=1×1-99×0.01100 mol·L-1=10-4 mol·L-1,溶液的pH=10。
14.(15分)Ⅰ.已知常温下,在NaHSO3溶液中c(H2SO3)①>③;④中SO32-水解,②中SO32-与NH4+水解,相互促进,水的电离程度增大。(2)反应物为HSO3-、KIO3,生成物有I2、SO42-,根据电荷守恒配平。
Ⅱ.氨水与盐酸等体积混合后的溶液中的电荷守恒关系式为c(NH4+)+c(H+)=c(Cl-)+c(OH-),因c(NH4+)=c(Cl-),故有c(H+)=c(OH-),溶液显中性。Kb=c(NH4+)·c(OH-)c(NH3·H2O)=0.005×10-7a2-0.005=10-9a-0.01。