- 2021-07-09 发布 |
- 37.5 KB |
- 30页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习原电池原理及其应用作业
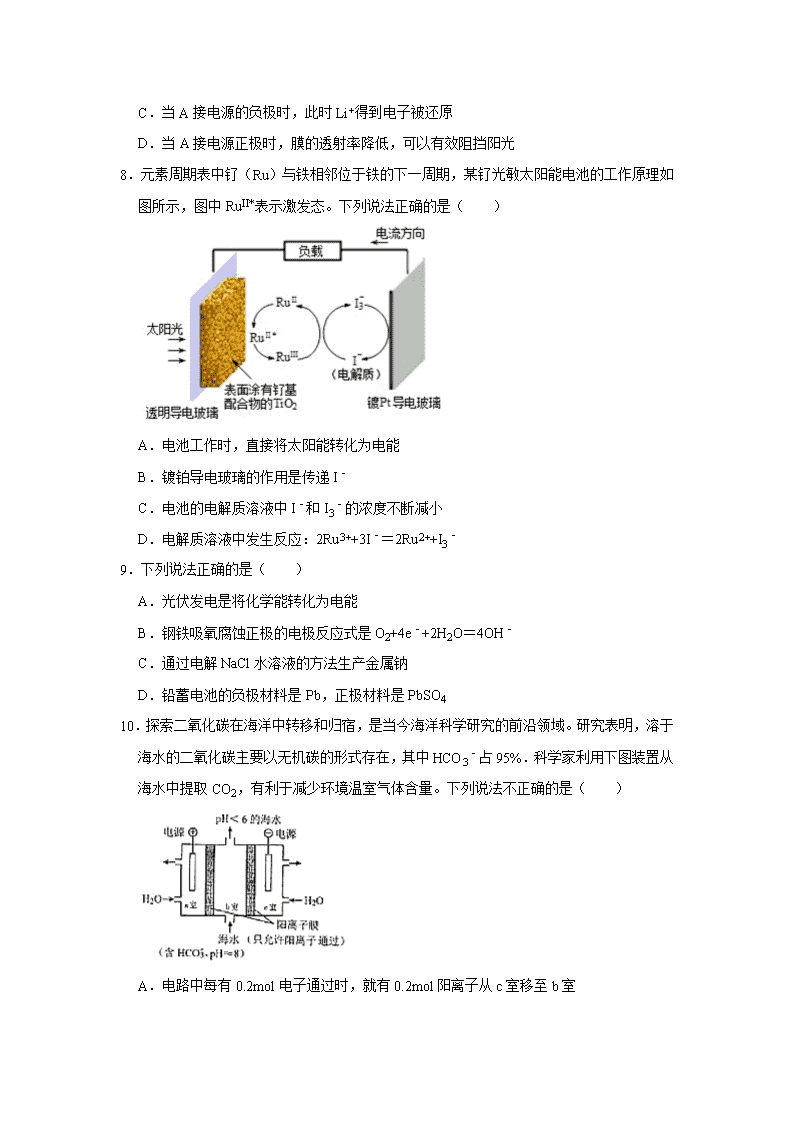
原电池原理及其应用 一.选择题(共20小题) 1.下列对原电池的分析不正确的是( ) A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al﹣3e﹣=Al3+ B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al﹣3e﹣+4OH﹣=AlO2﹣+2H2O C.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu﹣2e﹣=Cu2+ D.由Al、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu﹣2e﹣=Cu2+ 2.设计如图装置研究电化学反应,a、b可用导线连接。下列叙述错误的是( ) A.a、b不连接时,铁片上有气泡产生 B.a、b连接时,铜片上发生反应:2H++2e→H2↑ C.a、b连接时,溶液中产生电子的定向移动 D.无论a和b是否连接,铁片上都会发生氧化反应 3.利用某些装置可以实现化学能和电能之间的相互转化,例如原电池、电解池。下列关于铜﹣锌(硫酸)原电池的说法正确的是( ) A.该原电池是实现电能转化为化学能的装置 B.该原电池在工作时,Zn2+向铜片附近迁移 C.该原电池的正极是铜,发生氧化反应 D.该原电池的电子从铜出发通过外电路流向锌 4.如图所示原电池的盐桥中装有饱和K2SO4溶液,电池工作一段时间后,甲烧杯中溶液颜色不断变浅。下列叙述中正确的是( ) A.b极是电池的正极 B.甲烧杯中K+经盐桥流向乙烧杯 C.甲烧杯中溶液的pH逐渐减小 D.电池的总反应离子方程式为:MnO4﹣+5Fe2++8H+═Mn2++5Fe3++4H2O 5.将碳棒和铁棒平行插入NaCl溶液中,两棒的液面以上部分用铜丝相连、并接入电流计,电流计指针偏转。以下说法正确的是( ) A.碳棒作负极 B.电子自铁棒通过铜丝流向碳棒 C.该装置是电解池 D.铜丝失去电子发生还原反应 6.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间。以下叙述正确的是( ) A.两烧杯中铜片表面均有气泡产生 B.甲烧杯中的电流与阳离子流向均为Zn→Cu C.两烧杯中溶液的pH均增大 D.两烧杯在相同时间内转移电子数相等 7.电致变色玻璃以其优异的性能将成为市场的新宠,如图所示五层膜的玻璃电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是( ) A.当B外接电源负极时,膜由无色变为蓝色 B.当B外接电源负极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3 C.当A接电源的负极时,此时Li+得到电子被还原 D.当A接电源正极时,膜的透射率降低,可以有效阻挡阳光 8.元素周期表中钌(Ru)与铁相邻位于铁的下一周期,某钌光敏太阳能电池的工作原理如图所示,图中RuII*表示激发态。下列说法正确的是( ) A.电池工作时,直接将太阳能转化为电能 B.镀铂导电玻璃的作用是传递I﹣ C.电池的电解质溶液中I﹣和I3﹣的浓度不断减小 D.电解质溶液中发生反应:2Ru3++3I﹣=2Ru2++I3﹣ 9.下列说法正确的是( ) A.光伏发电是将化学能转化为电能 B.钢铁吸氧腐蚀正极的电极反应式是O2+4e﹣+2H2O=4OH﹣ C.通过电解NaCl水溶液的方法生产金属钠 D.铅蓄电池的负极材料是Pb,正极材料是PbSO4 10.探索二氧化碳在海洋中转移和归宿,是当今海洋科学研究的前沿领域。研究表明,溶于海水的二氧化碳主要以无机碳的形式存在,其中HCO3﹣占95%.科学家利用下图装置从海水中提取CO2,有利于减少环境温室气体含量。下列说法不正确的是( ) A.电路中每有0.2mol电子通过时,就有0.2mol阳离子从c室移至b室 B.b室发生反应的离子方程式为:H++HCO3﹣=CO2↑+H2O C.a室中OH﹣在电极板上被氧化 D.若用氢氧燃料电池供电,则电池负极反应可能发生的反应为:H2+2OH﹣﹣2e﹣=2H2O 11.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述不正确的是( ) A.锌电极上发生氧化反应 B.电池工作一段时间后,甲池的 c(SO42﹣)减小 C.电池工作一段时间后,乙池溶液的总质量增加 D.阳离子通过交换膜向正极移动,保持溶液中电荷平衡 12.某电源装置如图所示,电池总反应为 2Ag+Cl2═2AgCl.下列说法不正确的是( ) A.正极反应为 Cl2+2e﹣═2Cl﹣ B.放电时,交换膜左侧电极棒质量不断增大 C.若用 NaCl 溶液代替盐酸,则电池总反应随之改变 D.当电路中转移 0.01mol e﹣时,交换膜左则溶液中约减少 0.02mol 离子 13.锂亚硫酰氯(Li/SOCl2)电池是实际应用电池系列中比能量最高的一种电池,剖视图如图所示,一种非水的LiAlCl4的SOCl2溶液为电解液。亚硫酸氯既是电解质,又是正极活性物质,其中碳电极区的电极反应式为2SOCl2+4e﹣═4Cl﹣+S+SO2↑,该电池工作时,下列说法错误的是( ) A.锂电极区发生的电极反应:Li﹣e﹣═Li+ B.放电时发生的总反应:4Li+2SOCl2═4LiCl+SO2↑+S C.锂电极上的电势比碳电极上的低 D.若采用水溶液代替SOCl2溶液,电池总反应和效率均不变 14.我国科研人员借助太阳能,将光解水制H2与脱硫结合起来,既能大幅度提高光解水制H2的效率,又能脱除SO2,工作原理如下图所示。下列说法不正确的是( ) A.该装置可将太阳能转化为化学能 B.催化剂a表面发生还原反应,产生H2 C.催化剂b附近的溶液pH增大 D.吸收1molSO2,理论上能产生1molH2 15.电化学气敏传感器可用于监测环境中NH3的含量,其中工作原理如图所示。则下列说法正确的是( ) A.电流由a极流向b极 B.溶液中的OH﹣向b极移动 C.a极的电极反应式为:4NH3﹣12e﹣═2N2+12H+ D.b极的电极反应式为:3O2+12e﹣+6H2O═12OH﹣ 16.现有一种锂离子二次电池,其工作原理如图。放电时生 成的Li2CO3固体和碳储存于碳纳米管中。下列说法错误的是( ) A.该电池中的有机溶剂不能含活性较大的氢 B.充电时,Y为阳极,Li+向X电极移动 C.放电时,负极反应为2Li+CO32﹣﹣2e﹣═Li2CO3 D.放电时,电池总反应为3CO2+4Li═2Li2CO3+C 17.最近我国成功研制出高效电催化固氮催化剂Mo2N,如图所示,在0.1mol•L﹣1盐酸溶液中,在一定电压下具有较高的产氨速率和稳定的电流效率。下列判断错误的是( ) A.石墨电极为阳极 B.P为阳离子交换膜 C.Mo2N/GCE电极区反应式为N2+6H++6e﹣=2NH3 D.为提高溶液的导电性,可在石墨电极区加入适量的盐酸 18.太阳能电池是以表面涂有钌(Rii)基配合物的TiO2光敏染料的透明导电玻璃和镀Pt导电玻璃为极板。其工作原理如下图所示: 下列关于该电池叙述正确的是( ) A.电池工作时电能由光能直接转化而来,不涉及化学能转化 B.电池工作时的总反应为:RuⅡ+I3﹣═RuⅢ+3I﹣ C.当太阳光照射光敏染料时,光敏染料所在电极的电势低于镀Pt导电玻璃电极 D.电池工作时,为持续供电,需要定期补充有关电解质 19.图为利用电化学方法处理有机废水的原理示意图。下列说法正确的是( ) A.a、b极不能使用同种电极材料 B.工作时,a极的电势低于b极的电势 C.工作一段时间之后,a极区溶液的pH增大 D.b极的电极反应式为:CH3 COO﹣+4H2O﹣8e﹣=2HCO3﹣+9H+ 20.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以硫酸为电解质的燃料电池发电.电池负极反应为( ) A.H2+2OH﹣﹣2e﹣=2H2O B.O2+4H++4e﹣=2H2O C.H2﹣2e﹣=2H+ D.O2+2H2O+4e﹣=4OH﹣ 二.填空题(共5小题) 21.乙醇是一种可再生能源,可用它来制成燃料电池(如图),试写出其负极的电极反应式 . 22.锂空气电池比传统的锂离子电池拥有更强的蓄电能力,是传统锂电池容量的10 倍,其工作原理示意图如图所示. 放电时,b 电极为电源的 极,电极的反应为 ;充电时,ɑ电极应与外接电源 极相连接. 23.由A、B、C、D四种金属按下表中装置进行实验. 装置 现象 二价金属A不断溶解 C的质量增加 A上有气体产生 根据实验现象回答下列问题: (1)装置甲中负极的电极反应式是 . (2)装置乙中正极的电极反应式是 . (3)装置丙中溶液的pH (填“变大”、“变小”或“不变”). (4)四种金属活泼性由强到弱的顺序是 . 24.蓄电池是一种反复充电、放电的特定装置.已知一种蓄电池在充电和放电时发生的反应如下:NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2. (1)此蓄电池在充电时,电池负极应与外加电源的 极连接,电极反应式为: (2)以铜为电极,用此蓄电池作电源,电解以下溶液,开始阶段发生反应:Cu+2H2O═Cu(OH)2+H2↑的有 A.稀H2SO4 B.NaOH溶液 C.Na2SO4溶液 D.CuSO4溶液 E.NaCl溶液 (3)假如用此蓄电池电解以下溶液 (电解池两极均为惰性电极),工作一段时间后,蓄电池内部消耗了0.36 g水.请回答下列问题: ①电解足量N(NO3)x溶液时某一电极析出了a g金属N,则金属N的相对原子质量R的计算公式为R= (用含a、x的代数式表示). ②电解含有0.1 mol•L﹣1的CuSO4溶液100 mL,阳极产生标准状况下的气体体积为 L;将电解后的溶液加水稀释至2L,溶液的pH= (4)熔融盐燃料电池是以熔融碳酸盐为电解质、CH4为燃料、空气为氧化剂、稀土金属材料为电极的新型电池.已知该熔融盐电池的负极的电极反应是:CH4﹣8e﹣+4CO32﹣═5CO2+2H2O,则正极的电极反应式为 (5)有一种用CO2为主要原料生产甲醇燃料的方法: 已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(g);△H=﹣a kJ•mol﹣1、 CH3OH(g)═CH3OH(l);△H=﹣b kJ•mol﹣1、 2H2(g)+O2(g)═2H2O(g);△H=﹣c kJ•mol﹣1、 H2O(g)═H2O(l);△H=﹣d kJ•mol﹣1. 则表示CH3OH(l)燃烧热的热化学方程式为 . 25.(1)据报道以硼氢化合物NaBH4(H的化合价为﹣1价)和H2O2作原料的燃料电池,可用作通信卫星电源.负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图1所示.写出该电池放电时负极的电极反应式: (2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂. 已知:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=﹣534kJ•mol﹣1 H2O2(l)=H2O(l)+O2(g)△H=﹣98.6kJ•mol﹣1 写出常温下,N2H4(l) 与 H2O2(l)反应生成N2和H2O的热化学方程式 . (3)O3可由臭氧发生器(原理如右图2所示)电解稀硫酸制得. ①图中阴极为 (填“A”或“B”). ②若C处通入O2,则A极的电极反应式为: (4)向一密闭容器中充入一定量一氧化碳跟水蒸气发生反应 CO(g)+H2O(g)═CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是 (选填编号). A.v正(H2O)=v逆(H2) B.容器中气体的压强不再发生改变 C.H2O的体积分数不再改变 D.容器中CO2和H2的物质的量之比不再发生改变 E.容器中气体的密度不再发生改变 (5)温度T1时,在一体积为2L的密闭容积中,加入0.4molCO2和0.4mol的H2,反应中c(H2O)的变化情况如图3所示,T1时反应CO(g)+H2O(g)═CO2(g)+H2(g)第4分钟达到平衡.在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化趋势的曲线. 三.解答题(共4小题) 26.废水中过量的氨氮(NH3和NH4+)会导致水体富营养化。某科研小组用NaClO氧化法处理氨氮废水。已知:①HClO的氧化性比NaClO强;②NH3比NH4+更易被氧化;③国家标准要求经处理过的氨氮废水pH要控制在6~9。 (1)pH=1.25时,NaClO可与NH4+反应生成N2等无污染物质,该反应的离子方程式为 。 (2)进水pH对氨氮去除率和出水pH的影响如下图所示 ①进水pH为1.25~2.75范围内,氨氮去除率随pH升高迅速下降的原因是 ②进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是 ③进水pH应控制在 左右为宜。 (3)为研究空气对NaClO氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是 (填字母)。 a.O2的氧化性比NaClO弱 b.O2氧化氨氮速率比NaClO慢 c.O2在溶液中溶解度比较小 d.空气中的N2进入溶液中 (4)利用微生物燃料电池可以对氨氮废水进行处理,其装置如图所示。闭合电路后,负极室与正极室均产生氮气,则负极室中NH4+发生反应的电极反应式为 。该装置除了能对氨氮废水进行处理外,另一个突出的优点是 。 27.锂在有机合成、电池等领城中有重要的作用。 Ⅰ.LiAlH4的制备和应用如图所示。 (1)锂元素在元素周期表中的位置 。 (2)写出A的电子式 。 (3)LiAlH4是有机合成中常用的还原剂,试写出反应③的化学方程式 。 Ⅱ.磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,是以铁棒为阳极,石墨为阴极,电解磷酸二氢铵、氯化锂混合溶液,析出磷酸亚铁锂沉淀,在800℃左右、惰性气体氛围中煅烧制得。在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如图: 请回答下列问题: (1)制备磷酸亚铁锂必须在惰性气体氛围中进行,其原因是 。 (2)阳极生成磷酸亚铁锂的电极反应式为 。 (3)写出M与足量氢氧化钠溶液反应的化学方程式 。 (4)该电池充电时阳极的磷酸亚铁锂生成磷酸铁,则放电时正极的电极反应式为 。 28.Li﹣CuO二次电池的比能量高、工作温度宽,性能优异,广泛应用于军事和空间领域. (1)Li﹣CuO电池中,金属锂做 极. (2)比能量是指消耗单位质量的电极所释放的电量,用来衡量电池的优劣.比较Li、Na、Al分别作为电极时比能量的大小: . (3)通过如下过程制备CuO CuCuSO4溶液Cu2(OH)2CO3沉淀CuO ①过程Ⅰ,H2O2的作用是 . ②过程Ⅱ产生Cu2(OH)2CO3的离子方程式是 . ③过程Ⅱ,将CuSO4溶液加到Na2CO3溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如下: 已知:Cu2(OH)2CO3中铜元素的百分含量为57.7%. 二者比值为1:0.8时,产品中可能含有的杂质是 ,产生该杂质的原因是 . ④过程Ⅲ反应的化学方程式是 . (4)Li﹣CuO二次电池以含Li+的有机溶液为电解质溶液,其工作原理示意如图2.放电时,正极的电极反应式是 . 29.常见的纽扣电池为Ag﹣Zn电池,它用不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极壳一端填充Ag2O和少量石墨组成的正极活性材料,负极盖一端填充Zn﹣Hg合金作负极的活性材料,电解质溶液为浓KOH溶液.写出此电池的正极和负极反应式以及电池总反应式. 原电池原理及其应用 参考答案与试题解析 一.选择题(共20小题) 1.【分析】A.该原电池中,Al易失电子作负极,负极上发生氧化反应; B.该原电池中,Al易失电子作负极,负极上Al失电子和氢氧根离子反应生成偏铝酸根离子和水; C.该原电池中,Al发生钝化现象,所以Cu易失电子作负极; D.该原电池中,Al易失电子作负极. 【解答】解:A.该原电池中,Al易失电子作负极,负极上发生氧化反应,电极反应式为Al﹣3e﹣=Al3+,故A正确; B.该原电池中,Al易失电子作负极,负极上Al失电子和氢氧根离子反应生成偏铝酸根离子和水,电极反应式为Al﹣3e﹣+4OH﹣=AlO2﹣+2H2O,故B正确; C.该原电池中,Al发生钝化现象,所以Cu易失电子作负极,电极反应式为Cu﹣2e﹣=Cu2+,故C正确; D.该原电池中,Al易失电子作负极,电极反应式为Al﹣3e﹣=Al3+,故D错误; 故选:D。 2.【分析】a和b不连接时,铁发生化学腐蚀,铁和氢离子发生置换反应;a和b用导线连接时,该装置构成原电池,铁作负极、Cu作正极,电子从负极沿导线流向正极,据此分析解答。 【解答】解:A.a和b不连接时,铁和氢离子发生置换反应,所以铁片上会有气泡逸出,故A正确; B.a和b用导线连接时,该装置构成原电池,铁易失电子作负极、Cu作正极,H+从铜片上获得锌失去的电子,则铜片上发生反应:2H++2e→H2↑,故B正确; C.a和b用导线连接时,该装置构成原电池,电子在外电路从铁片流向铜片,溶液中产生离子的定向移动,故C错误; D.无论a和b是否用导线连接,铁片均会溶解,发生氧化反应,故D正确; 故选:C。 3.【分析】A、原电池将化学能转化为电能; B、铜﹣锌(硫酸)原电池铜是正极,而原电池中阳离子向正极移动; C、原电池正极发生还原反应,负极发生氧化反应; D、原电池中电子从负极沿导线流向正极。 【解答】解:A.原电池将化学能转化为电能,故A错误; B、铜﹣锌(硫酸)原电池铜是正极,而原电池中阳离子向正极移动,所以Zn2+向正极铜片附近迁移,故B正确; C、原电池正极发生还原反应,负极发生氧化反应,所以该原电池的正极是铜,发生还原反应,故C错误; D、原电池中电子从负极沿导线流向正极,所以该原电池的电子从锌出发通过外电路流向铜,故D错误; 故选:B。 4.【分析】由Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,所以总的电极反应为:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,结合原电池中负极发生氧化反应,电流从正极流向负极,阴离子向负极移动来解答。 【解答】解:由Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,所以总的电极反应为:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,结合原电池中负极发生氧化反应,电流从正极流向负极,阴离子向负极移动, A、b极是电池的负极,故A错误; B、K+向正极移动,所以乙烧杯中K+经盐桥流向甲烧杯,故B错误; C、甲烧杯中(a电极)发生还原反应,Mn元素的化合价降低,电极反应为MnO4﹣+8H++5e﹣═Mn2++4H2O,所以甲烧杯中溶液的pH逐渐增大,故C错误; D、由总的电极反应可知:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,反应的离子方程式为:MnO4﹣+5Fe2++8H+═Mn2++5Fe3++4H2O,故D正确; 故选:D。 5.【分析】铁、碳和氯化钠溶液构成原电池,发生吸氧腐蚀,铁易失电子发生氧化反应而作负极,碳作正极,电子从负极沿导线流向正极,以此解答该题。 【解答】解:A.铁为负极,碳棒为正极,故A错误; B.该原电池中,铁作负极,碳作正极,电子从负极铁沿导线流向正极碳,故B正确; C.化学能转化为电能,为原电池,故C错误; D.反应中铜不参加反应,正极上氧气得电子,故D错误。 故选:B。 6.【分析】原电池的组成条件是活泼性不同的两个电极、电解质溶液、闭合回路、自发进行的氧化还原反应。装置甲是原电池,锌做负极,铜做正极,气体在铜片上产生,原电池由于在两个电极上发生氧化反应和还原反应,加快了反应速率。乙不是原电池,乙装置是锌与稀硫酸直接接触的反应,铜不与稀硫酸反应,气体在锌片上产生。甲和乙相比,相同点:发生的氧化还原反应原理相同,都消耗H+,反应后溶液PH都增大;不同点:一、气体产生的位置不同,二、反应速率不同,三、能量转化不同。 【解答】解:A、甲是原电池,正极铜片上发生还原反应 2H++2e﹣=H2↑,乙装置中在锌片上发生反应 Zn+2H+=Zn2++H2↑,铜片上无气体产生,故A错误; B、甲装置是原电池,电流由正极Cu流向负极Zn,阳离子流向正极,故B错误; C、两烧杯中的氢离子发生反应,浓度减少,溶液pH增大,故C正确; D、原电池反应加快反应速率,所以两烧杯在相同时间内转移电子数不等,故D错误; 故选:C。 7.【分析】A、当B接外接电源负极时,B为阴极,此时蓝色的Fe4[Fe(CN)6]3得电子成为Li4Fe4[Fe(CN)6]3,此物质为无色透明物质,据此进行分析; B、当B外接电源负极发生的电极反应式为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3; C、A接电源负极,WO3得到电子被还原,电极反应式为WO3+Li++e﹣=LiWO3,据此进行分析; D、当B接外接电源负极时,B为阴极,此时蓝色的Fe4[Fe(CN)6]3得电子成为Li4Fe4[Fe(CN)6]3,此物质为无色透明物质,根据电解池的阴极反应特点来回答判断。 【解答】解:A、当B接外接电源负极时,B为阴极,此时蓝色的Fe4[Fe(CN)6]3得电子成为Li4Fe4[Fe(CN)6]3,此物质为无色透明物质,故当B外接电源负极时,膜由蓝色变为无色,故A错误; B、当B外接电源负极发生的电极反应式为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3,故B正确; C、A接电源负极,WO3得到电子被还原,故C错误; D、B接外接电源负极时,B为阴极,此时蓝色的Fe4[Fe(CN)6]3得电子成为Li4Fe4[Fe(CN)6]3,此物质为无色透明物质,不能有效阻挡阳光,故D错误, 故选:B。 8.【分析】由图中电子的移动方向可知,透明导电玻璃为原电池的负极,发生氧化反应,电极反应为:2Ru2+﹣2e﹣═2Ru3+,镀铂电极为原电池的正极,电解质为I3﹣和I﹣的混合物,I3﹣在正极上得电子被还原,正极反应为I3﹣+2e﹣=3I﹣,电解质溶液中发生2Ru3++3I﹣═2Ru2++I3﹣,据此分析解答。 【解答】解:A.电池工作时,存在的能量转化形式为:光能→化学能→电能,故A错误; B.镀铂导电玻璃上,I3﹣得电子被还原为3I﹣,故B错误; C.由电池中发生的反应可知,I3﹣在正极上得电子被还原为3I﹣,后又被氧化为I3﹣,I3﹣和I﹣相互转化,反应的实质是光敏有机物在激发态与基态的相互转化,电解质溶液中I﹣和I3﹣的浓度基本不变,故C错误; D、电池工作时,负极反应为:2Ru2+﹣2e﹣═2Ru3+,正极反应为I3﹣+2e﹣=3I﹣,又Ru2+和Ru3+,I3﹣和I﹣相互转化,所以电解质溶液中发生2Ru3++3I﹣═2Ru2++I3﹣,故D正确。 故选:D。 9.【分析】A.光伏发电是将光能转化为电能; B.铁发生吸氧腐蚀时,正极上氧气得电子发生还原反应; C.工业上采用电解熔融氯化钠的方法冶炼钠; D.铅蓄电池的负极材料是Pb,正极材料是PbO2. 【解答】解:A.光伏发电是将光能转化为电能,不属于原电池原理,故A错误; B.铁发生吸氧腐蚀时,正极上氧气得电子发生还原反应,正极反应式为O2+4e﹣+2H2O=4OH﹣,故B正确; C.工业上采用电解熔融氯化钠的方法冶炼钠,如果电解氯化钠溶液时,阴极上氢离子放电生成氢气而得不到Na,故C错误; D.铅蓄电池的负极材料是Pb,正极材料是PbO2,故D错误; 故选:B。 10.【分析】 a室接电源的正极,为阳极,水失去电子生成氧气和氢离子,氢离子通过阳离子交换膜进入b室,与b室中的碳酸氢根反应生成二氧化碳气体,c室连接电源的负极,为阴极,水得到电子生成氢气和氢氧根,a室中产生氢离子,用c室排除的碱液将从b室排出的酸性海水调节即可,据此回答。 【解答】解:A、电路中每有0.2mol电子通过时,就有0.2mol阳离子从a室移至b室,故A错误; B、氢离子通过阳离子交换膜进入b室,与b室中的碳酸氢根反应生成二氧化碳气体,所以b室发生反应的离子方程式为:H++HCO3﹣=CO2↑+H2O,故B正确; C、a室中OH﹣在电极板上被氧化,生成氧气和水,故C正确; D、电解质溶液呈碱性,负极发生氧化反应,电极反应式为:H2+2OH﹣﹣2e﹣=2H2O,故D正确; 故选:A。 11.【分析】该原电池总反应为:Zn+Cu2+=Zn2++Cu,Zn发生氧化反应,为负极,Cu电极上发生还原反应,为正极,阳离子交换膜只允许阳离子和水分子通过,两池溶液中硫酸根浓度不变,随反应进行,甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液呈电中性,据此解答。 【解答】解:A.铜锌原电池的电池反应式为:Zn+Cu2+=Zn2++Cu,Zn为负极,发生氧化反应,Cu为正极,正极上铜离子得电子生成Cu,故A正确; B.阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42﹣)不变,故B错误; C.甲池中Zn失电子生成Zn2+,Zn2+通过阳离子交换膜进入乙池,以保持溶液电荷守恒,乙池中Cu2+得到电子生成Cu,Zn的相对原子质量数值大,故C正确; D.甲池中Zn失电子生成Zn2+,Zn2+通过阳离子交换膜进入乙池即正极区,以保持溶液电荷守恒,故D正确, 故选:B。 12.【分析】由电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子, A.正极上氯气得电子; B.放电时,交换膜左侧溶液中生成银离子,银离子与氯离子反应生成氯化银沉淀; C.电解质不参加反应断; D.放电时,交换膜左侧的氢离子向正极移动,氯离子与银离子生成氯化银沉淀。 【解答】解:由电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子, A.正极上氯气得电子生成氯离子,其电极反应为:Cl2+2e﹣═2Cl﹣,故A正确; B.放电时,交换膜左侧溶液中生成银离子,银离子与氯离子反应生成氯化银沉淀,所以交换膜左侧电极棒质量不断增大,故B正确; C.根据电池总反应为2Ag+Cl2═2AgCl可知,用NaCl溶液代替盐酸,电池的总反应不变,故C错误; D.放电时,当电路中转移0.01mol e﹣时,交换膜左侧会有0.01mol氢离子通过阳离子交换膜向正极移动,同时会有0.01molAg失去0.01mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.01mol,则交换膜左侧溶液中约减少0.02mol离子,故D正确。 故选:C。 13.【分析】由反应的化合价变化,可得Li为还原剂,SOCl2为氧化剂,负极材料为Li(还原剂),发生氧化反应,电极反应式为Li﹣e﹣=Li+,正极发生还原反应,电极方程式为:2SOCl2+4e﹣=4Cl﹣+S+SO2,因为构成电池的两个主要成份之一Li能和氧气水反应,且SOCl2也与水反应。 【解答】解:A、负极发生氧化反应,电极反应式为:Li﹣e﹣═Li+,故A正确; B、电池的总反应可表示为4Li+2SOCl2═4LiCl+S+SO2,故B正确; C、锂为负极,碳为正极,所以锂电极上的电势比碳电极上的低,故C正确; D、因为构成电池的材料Li能和水反应,且SOCl2也与水反应,所以必须在无水无氧条件下进行,故D错误; 故选:D。 14.【分析】由电子移动方向可知,催化剂a为正极氢离子得电子生成氢气发生还原反应,催化剂b为负极SO2失电子生成硫酸根发生氧化反应,电极反应为4OH﹣+SO2﹣2e﹣═SO42﹣+2H2O,据此分析解答。 【解答】解:A.由图可知,该装置可将太阳能转化为化学能,故A正确; B.由电子移动方向可知,催化剂a为正极氢离子得电子生成氢气发生还原反应,故B正确; C.催化剂b为负极SO2失电子生成硫酸根发生氧化反应,电极反应为4OH﹣+SO2﹣2e﹣═SO42﹣+2H2O,则附近的溶液pH减小,故C错误; D.由正负极得失电子守恒,吸收1molSO2,理论上能产生1molH2,故D正确; 故选:C。 15.【分析】NH3被氧化为常见无毒物质,生成氮气,Pt电子通入氨气生成氮气,为原电池负极,电极反应式为2NH3﹣6e﹣+6OH﹣=N2+6H2O,则b为正极,氧气得电子被还原,电极反应式为O2+4e﹣+2H2O═4OH﹣,外电路中电流由b极流向a极、内电路中:阳离子移向正极、阴离子移向负极,据此解答。 【解答】解:A.b电极为正极、a电极为负极,电流由b极经过电压表流向a极,故A错误; B.b电极为正极、a电极为负极,内电路中:阳离子移向正极、阴离子移向负极,所以溶液中的OH﹣向a极移动,故B错误; C.a极上NH3被氧化生成氮气,发生失去电子的氧化反应,结合碱性条件有2NH3﹣6e﹣+6OH﹣=N2+6H2O,故C错误; D.b极上氧气得电子被还原,电极反应式为O2+4e﹣+2H2O═4OH﹣或3O2+12e﹣+6H2O═12OH﹣,故D错误; 故选:D。 16.【分析】由信息结合图示知道在放电时发生反应:Li+CO2+O2Li2CO3,二氧化碳中各元素的化合价不变,放电时,Li是负极,发生失电子的氧化反应,阳离子向正极移动;充电时的两极反应和放电时的相反,据此回答即可。 【解答】解:A、金属锂化学性质活泼,该电池中的有机溶剂不能含活性较大的氢,防止金属锂发生反应,故A正确; B、充电时,Y为阳极,电解质中的阳离子移向阴极,即Li+向X电极移,故B正确; C、放电时,负极反应为Li﹣e﹣═Li+,故C错误; D、由信息结合图示知道在放电时发生反应:Li+CO2+O2Li2CO3,故D正确。 故选:C。 17.【分析】A、左边是氮气得电子,发生还原反应,电解池的阴极; B、右边水放电生成氧气和氢离子,左边是氮气得电子结合氢离子生成氨气; C、Mo2N/GCE电极区为阴极,是氮气放电生成氨气; D、石墨电极区加入适量的盐酸,则还原性强的氯离子优先放电。 【解答】解:A、左边是氮气得电子,发生还原反应,电解池的阴极,所以右边的石墨电极为阳极,故A正确; B、右边水放电生成氧气和氢离子,左边是氮气得电子结合氢离子生成氨气,氢离子交换膜进入左边,所以P为阳离子交换膜,故B正确; C、Mo2N/GCE电极区为阴极,是氮气放电生成氨气,所以电极反应式为:N2+6H++6e﹣=2NH3,故C正确; D、石墨电极区加入适量的盐酸,则还原性强的氯离子优先放电,生成氯气,故D错误; 故选:D。 18.【分析】A.电池中存在I3﹣与I﹣的转化; B.电荷不守恒; C.光敏染料所在电极为负极,镀Pt导电玻璃电极为正极; D.由图可知,I3﹣和I﹣相互转化浓度不变。 【解答】解:A.电池中存在I3﹣与I﹣的转化,发生化学变化,即存在化学能的转化,故A错误; B.RuⅡ+I3﹣═RuⅢ+3I﹣反应中电荷不守恒,故B错误; C.由图可知,电子从光敏染料流向镀Pt导电玻璃电极,则光敏染料所在电极为负极,镀Pt导电玻璃电极为正极,所以光敏染料所在电极的电势低于镀Pt导电玻璃电极,故C正确; D.由电池中发生的反应可知,I3﹣在正极上得电子被还原为3I﹣,后又被氧化为I3﹣,I3﹣和I﹣相互转化,反应的实质是光敏有机物在激发态与基态的相互转化,所有化学物质都没有被损耗,不需要补充有关电解质,故D错误。 故选:C。 19.【分析】图示分析可知:b电极CH3 COO﹣失电子生成HCO3﹣,说明b为原电池的负极,所以a为原电池的正极发生还原反应,据此分析解答。 【解答】解:A.根据图知,该装置是燃料电池,能使用同种电极材料,故A错误; B.b电极CH3 COO﹣失电子生成HCO3﹣,说明b为原电池的负极,所以a为原电池的正极,所以a极电势比b极电势高,故B错误; C.a电极生成苯酚和氯离子,则消耗氢离子,但是b电极CH3 COO﹣失电子生成HCO3﹣,电极反应式为:CH3 COO﹣+4H2O﹣8e﹣=2HCO3﹣+9H+,生成的氢离子通过质子交换膜进入a电极,则a极附近电解质c(H+)应不变,pH值不变,故C错误; D.图示分析可知:b电极CH3 COO﹣失电子生成HCO3﹣,电极反应式为:CH3 COO﹣+4H2O﹣8e﹣=2HCO3﹣+9H+,故D正确; 故选:D。 20.【分析】氢气具有还原性,在负极上发生氧化反应,由于电解质溶液呈酸性,则负极上氢气失电子生成氢离子,负极反应为H2=2H++2e﹣,正极反应O2+4H++4e﹣=2H2O. 【解答】解:A、电解质溶液呈酸性,负极上无OH﹣离子参与反应,故A错误; B、负极发生氧化反应,氢气失去电子,该反应为正极反应,故B错误; C、电解质溶液呈酸性,则负极上氢气失电子生成氢离子,电极反应为H2=2H++2e﹣,故C正确; D、负极发生氧化反应,氢气失去电子,该反应为碱性溶液中正极反应,故D错误。 故选:C。 二.填空题(共5小题) 21.【分析】原电池中负极上燃料失电子,碱性条件下,CH3CH2OH反应生成碳酸根离子,据此书写. 【解答】解:原电池中负极上燃料失电子,碱性条件下,CH3CH2OH反应生成碳酸根离子,电极反应式为C2H5OH﹣12e﹣+16OH﹣=2CO32﹣+11H2O, 故答案为:C2H5OH﹣12e﹣+16OH﹣=2CO32﹣+11H2O. 22.【分析】电池放电时,属于原电池,电极a为Li电极,为负极,发生氧化反应,b为正极,发生还原反应,电极方程式为O2+2H2O+4e﹣=4OH﹣;电池充电时,属于电解池,相当于原电池的逆过程,a为阴极,应该与外接电源的负极相连. 【解答】解:电池放电时,属于原电池,电极a为Li电极,为负极,发生氧化反应,b为正极,发生还原反应,电极方程式为O2+2H2O+4e﹣=4OH﹣;电池充电时,属于电解池,相当于原电池的逆过程,a为阴极,应该与外接电源的负极相连,故答案为:正;O2+2H2O+4e﹣=4OH﹣;负. 23.【分析】甲装置中,二价金属A不断溶解说明该装置构成了原电池,且A失电子发生氧化反应而作负极,B作正极; 乙中C的质量增加,说明C上铜离子得电子发生还原反应,则C作原电池正极,B作负极; 丙装置中A上有气体产生,说明A上氢离子得电子发生还原反应,则A作原电池正极,D作负极, 作原电池负极的金属活动性大于作正极金属,所以金属活动性强弱顺序是:D>A>B>C. 【解答】 解:(1)该装置中,二价金属A不断溶解说明A失电子发生氧化反应生成金属阳离子进入溶液而作负极,所以负极电极反应式为A﹣2e﹣═A2+, 故答案为:A﹣2e﹣═A2+; (2)乙装置中,C的质量增加说明C电极上铜离子得电子发生还原反应,则C作正极,电极反应式为Cu2++2e﹣═Cu, 故答案为:Cu2++2e﹣═Cu; (3)丙装置中A上有气体产生,说明A上氢离子得电子发生还原反应而作正极,D作负极,正极上氢离子逐渐析出而导致氢离子浓度逐渐减小,则溶液的pH逐渐增大, 故答案为:变大; (4)通过以上分析知,四种金属活动性强弱顺序是D>A>B>C, 故答案为:D>A>B>C. 24.【分析】(1)此蓄电池在充电时,电池负极应与外加电源的负极连接作阴极,得电子发生还原反应; (2)以铜为电极,用此蓄电池作电源,电解以下溶液,开始阶段发生反应:Cu+2H2O═Cu(OH)2+H2↑,说明阴极为水中氢离子得电子发生还原反应,据此判断; 第(1)题依据电池反应分析,充电为电解池,放电为原电池;放电过程中原电池的负极上失电子发生氧化反应,正极上发生还原反应; (3)放电是原电池反应,NiO2+Fe+O Fe(OH)2+Ni(OH)2,负极:Fe﹣2e﹣+2OH﹣=Fe(OH)2,正极:NiO2+2e﹣+2H2O=Ni(OH)2+2OH﹣;工作一段时间后蓄电池内部消耗了0.36g水,n(H2O)==0.02mol, ①由电子守恒可知,电解N(NO3)x溶液时,某一极增加了agN,2N~2xe﹣; ②n(H2O)==0.02mol,根据方程式,电池转移电子为0.02mol,由离子放电顺序可知,电解含有0.1mol•L﹣1的CuSO4溶液100mL,阳极上氢氧根离子放电生成氧气,阴极上铜离子得电子,以此计算; (4)燃料电池中,正极发生的反应一定是氧气得电子发生还原反应的过程; (5)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=﹣a kJ•mol﹣1; ②CH3OH(g)═CH3OH(l)△H=﹣b kJ•mol﹣1; ③2H2(g)+O2(g)═2H2O(g)△H=﹣c kJ•mol﹣1; ④H2O(g)═H2O(l)△H=﹣d kJ•mol﹣1. 根据盖斯定律,﹣①﹣②+×③+2×④计算得到. 【解答】解:(1)此蓄电池在充电时,电池负极应与外加电源的负极连接作阴极,得电子发生还原反应,反应式为:Fe(OH)2+2e﹣═Fe+2OH﹣;故答案为:负;Fe(OH)2+2e﹣═Fe+2OH﹣; (2)以铜为电极,用此蓄电池作电源,电解以下溶液,开始阶段发生反应:Cu+2H2O═Cu(OH)2+H2↑,说明阴极为水中氢离子得电子发生还原反应,所以可以为活泼的金属阳离子的溶液,故BCE符合,AD不符合,故选:BCE; (3)①负极:Fe﹣2e﹣+2OH﹣=Fe(OH)2,正极:NiO2+2e﹣+2H2O=Ni(OH)2+2OH﹣; 工作一段时间后蓄电池内部消耗了0.36g水,n(H2O)==0.02mol,则电池转移电子为0.02mol; 由电子守恒可知,电解N(NO3)x溶液时,某一极增加了agN,2N~2xe﹣,则设N的相对原子质量为RRR, 2M~2xe﹣ 2R 2x a 0.02mol 解得R=50ax,故答案为:50ax; ②n(H2O)==0.02mol,根据方程式,电池转移电子为0.02mol,由离子放电顺序可知,电解含有0.1mol•L﹣1的CuSO4溶液100mL,阳极上氢氧根离子放电生成氧气,阴极上铜离子得电子, 阳极上:4OH﹣﹣4e﹣=2H2O+O2↑, 4 4 1 0.02mol 0.02mol 0.005mol 则阳极生成0.005mol气体,体积为0.005mol×22.4L/mol=0.112L, 阴极上: Cu2++2e﹣=Cu 1 2 1 0.01mol 0.02mol 0.01mol 则氢氧根离子失电子减少0.02mol,氢离子增加0.02mol,所以溶液中氢离子增加0.02mol; c(H+)==0.01mol/L,所以pH=2, 故答案为:0.112L;2; (4)燃料电池中,正极发生的反应一定是氧气得电子的过程,该电池的电解质环境是熔融碳酸盐,所以电极反应为:O2+2CO2+4e﹣=2CO32﹣ (或2O2+4CO2+8e﹣=4CO32﹣),故答案为:O2+2CO2+4e﹣=2CO32﹣ (或2O2+4CO2+8e﹣=4CO32﹣); (5)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=﹣a kJ•mol﹣1; ②CH3OH(g)═CH3OH(l)△H=﹣b kJ•mol﹣1; ③2H2(g)+O2(g)═2H2O(g)△H=﹣c kJ•mol﹣1; ④H2O(g)═H2O(l)△H=﹣d kJ•mol﹣1. 根据盖斯定律,﹣①﹣②+×③+2×④得到CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+O2(g)=CO2(g)+2H2O(l)△H△H=﹣△H1﹣△H2+△H3+2△H4=﹣(c+2d﹣a﹣b)kJ•mol﹣1,则CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+O2(g)=CO2(g)+2H2O(l)△H=﹣(c+2d﹣a﹣b)kJ•mol﹣1, 故答案为:CH3OH(l)+O2(g)=CO2(g)+2H2O(l)△H=﹣(c+2d﹣a﹣b)kJ•mol﹣1. 25.【分析】(1)原电池负极发生氧化反应,正极反应还原反应,由原电池工作原理图1可知,电极a为负极,电极b为正极,BH4﹣在负极放电生成BO2﹣; (2)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式,据此计算△H; (3)①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极; ②C处通入O2,O2发生还原反应,在酸性条件下生成水; (4)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论; (5)据图象分析,平衡时各物质浓度都是0.10mol/L,其平衡常数K=1,再加入0.1molCO和0.1molH2时,比较K与Q的相对大小,即可判断5min后反应情况. 【解答】 解:(1)原电池负极发生氧化反应,正极反应还原反应,由原电池工作原理图1可知,电极a为负极,电极b为正极,BH4﹣在负极放电生成BO2﹣,电极反应式为BH4﹣﹣8e﹣+8OH﹣=BO2﹣+6H2OMnO2. 故答案为:BH4﹣﹣8e﹣+8OH﹣=BO2﹣+6H2O; (2)已知:①N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣534kJ•mol﹣1 ②H2O2(l)=H2O(l)+1/2O2(g)△H=﹣98.64kJ•mol﹣1 由盖斯定律,①+②×2得N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=﹣534kJ•mol﹣1+2×(﹣98.64kJ•mol﹣1)=﹣731.2kJ•mol﹣1 故答案为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=﹣731.2 kJ/mol; (3)①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极,故答案为:A; ②C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e﹣=2H2O,故答案为:O2+4H++4e﹣=2H2O; (4)A.v正(H2O)=v逆(H2),正逆反应速率相等,说明反应达到平衡状态,故A正确; B.容器中气体的压强不再发生改变,反应前后气体体积不变,压强始终不变,压强不变不能说明反应达到平衡状态,故B错误; C.H2O的体积分数不再改变,说明各组分浓度不变,反应达到平衡状态,故C正确; D.容器中CO2和H2的物质的量之比决定于反应前加入物质的多少,与是否平衡无关,故C错误; E.容器中气体的密度不再发生改变,容器体积不变,气体质量不变,密度始终不变,密度不变不能说明反应达到平衡状态,故E错误; 故答案为:AC; (5)据图象分析,平衡时各物质浓度都是0.10mol/L,其平衡常数K=1,再加入0.1molCO和0.1molH2时,其浓度熵Q==1=K,平衡不移动,所以水蒸气浓度不再变化,图象为,故答案为: . 三.解答题(共4小题) 26.【分析】(1)pH=1.25时,NaClO可与NH4+反应生成N2等无污染物质,次氯酸根离子被还原为氯离子和水,结合电荷守恒、电子守恒、原子守恒配平书写离子方程式; (2)①进水pH为1.25~2.75范围内,氨氮去除率随pH升高迅速下降是c(OH﹣)较大,抑制NaClO水解,c(HClO)较小致氧化能力弱; ②进水pH为2.75~6.00范围内氨氮去除率随pH升高而上升,氨气含量增大氨氮易被氧化; ③结合图象变化可知进水pH应控制在1.0左右; (3)其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变,说明O2氧化氨氮速率比NaClO慢,比次氯酸钠氧化性弱,溶液中溶解的氧气少等原因; (4)负极室中NH4+发生反应的失电子发生氧化反应生成氮气,除了能对氨氮废水进行处理外,另一个突出的优点是化学能转化为电能利用。 【解答】解:(1)pH=1.25时,NaClO可与NH4+反应生成N2等无污染物质,次氯酸根离子被还原为氯离子,结合电荷守恒、电子守恒、原子守恒配平书写离子方程式:3ClO﹣+2NH4+=N2↑+3Cl﹣+2H+, 故答案为:3ClO﹣+2NH4+=N2↑+3Cl﹣+2H+; (2)①进水pH为1.25~2.75范围内,氨氮去除率随pH升高迅速下降的原因是:随着PH升高,NaClO含量增大,氧化性能降低,导致氨氮去除率下降, 故答案为:随着PH升高,NaClO含量增大,氧化性能降低,导致氨氮去除率下降; ②进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是:随着PH升高氨氮废水中氨气含量增大,氨氮更易被氧化, 故答案为:随着PH升高氨氮废水中氨气含量增大,氨氮更易被氧化; ③进水pH应控制在1.50左右,氨氮去除率会较大, 故答案为:1.50; (3)研究空气对NaClO氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是:O2的氧化性比NaClO弱、O2 氧化氨氮速率比NaClO慢、O2在溶液中溶解度比较小,故选abc, 故答案为:abc; (4)负极室中NH4+发生反应的失电子发生氧化反应生成氮气,电极反应为:2NH4+﹣6e﹣=N2↑+8H+,除了能对氨氮废水进行处理外,另一个突出的优点是化学能转化为电能利用 故答案为:2NH4+﹣6e﹣=N2↑+8H+;将化学能转化为电能。 27.【分析】Ⅰ.锂和氢气加热反应生成LiH,和氯化铝在乙醚中反应生成LiCl和LiAlH4,乙酸被LiAlH4还原为乙醇,乙醇和乙酸在浓硫酸作用下发生酯化反应生成乙酸乙酯和水, (1)锂元素原子核电荷数3,核外两个电子层,最外层1个电子; (2)A为LiH为离子化合物; (3)反应③为乙酸和乙醇发生的酯化反应; Ⅱ.(1)磷酸亚铁锂中亚铁离子易被氧化; (2)阳极上Fe失电子和磷酸二氢根离子、锂离子反应生成磷酸亚铁锂; (3)M与足量氢氧化钠溶液反应发生酯键水解生成、碳酸钠、甲醇和乙二醇; (4)锂离子电池在充电过程中的阳极产物,可写出电解的阳极电极反应式,电池放电时正极反应式与电解阳极反应式相反。 【解答】解:Ⅰ.(1)锂元素原子核电荷数3,核外两个电子层,最外层1个电子,在元素周期表中的位置为:第二周期ⅠA族, 故答案为:第二周期ⅠA族; (2)A为LiH为离子化合物,电子式为Li+[:H]﹣, 故答案为:Li+[:H]﹣; (3)反应③为乙酸和乙醇发生的酯化反应,反应的化学方程式:CH3COOH+CH3CH2OHCH3COO CH2CH3+H2O, 故答案为:CH3COOH+CH3CH2OHCH3COO CH2CH3+H2O; Ⅱ.(1)制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行的原因是:为了防止亚铁化合物被氧化, 故答案为:为了防止亚铁化合物被氧化; (2)阳极上Fe失电子和磷酸二氢根离子、锂离子反应生成磷酸亚铁锂,电极反应式为Fe+H2PO4﹣+Li+﹣2e﹣=LiFePO4+2H+, 故答案为:Fe+H2PO4﹣+Li+﹣2e﹣=LiFePO4+2H+; (3)M与足量氢氧化钠溶液反应发生酯键水解生成、碳酸钠、甲醇和乙二醇,反应的化学方程式:, 故答案为:; (4)锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,电极反应为LiFePO4═FePO4+Li++e﹣,该电池放电时,正极发生还原反应,与充电时的阳极反应相反,电极反应式为:FePO4+Li++e﹣═LiFePO4, 故答案为:FePO4+Li++e﹣=LiFePO4。 28.【分析】(1)失电子的物质为负极; (2)根据金属的相对原子质量和失电子数目判断; (3)①Cu元素的化合价升高,O元素的化合价降低; ②硫酸铜与碳酸钠溶液反应生成Cu2(OH)2CO3; ③Cu2(OH)2CO3中铜元素的百分含量为57.7%,二者比值为1:0.8时,Cu元素的百分含量大于57.1%,可能不含C; ④Cu2(OH)2CO3加热分解生成CuO; (4)由Li+的移动方向可知,CuO为正极,发生还原反应. 【解答】解:(1)Li﹣CuO电池中,Li失去电子,金属锂做负极,故答案为:负; (2)比能量是指消耗单位质量的电极所释放的电量,设质量均为m,则>>,则Li、Na、Al分别作为电极时比能量的大小为Li>Al>Na, 故答案为:Li>Al>Na; (3)①Cu元素的化合价升高,O元素的化合价降低,则H2O2的作用是氧化剂,故答案为:氧化剂; ②过程Ⅱ产生Cu2(OH)2CO3的离子方程式是2Cu2++2CO32﹣+H2O═Cu2(OH)2CO3↓+CO2↑,故答案为:2Cu2++2CO32﹣+H2O═Cu2(OH)2CO3↓+CO2↑; ③Cu2(OH)2CO3中铜元素的百分含量为57.7%,二者比值为1:0.8时,Cu元素的百分含量大于57.1%,可能不含C,则产品中可能含有的杂质是Cu(OH)2,因当Na2CO3用量减少时,c(CO32﹣)变小,CO32﹣水解程度变大,c(OH﹣)/c(CO32﹣)增加,c(OH﹣)对产物的影响增大, 故答案为:Cu(OH)2;当Na2CO3用量减少时,c(CO32﹣)变小,CO32﹣水解程度变大,c(OH﹣)/c(CO32﹣)增加,c(OH﹣)对产物的影响增大; ④过程Ⅲ反应的化学方程式是Cu2(OH)2CO32CuO+CO2↑+H2O,故答案为:Cu2(OH)2CO32CuO+CO2↑+H2O; (4)由Li+的移动方向可知,CuO为正极,发生还原反应,则正极反应为CuO+2e﹣+2Li+═Cu+Li2O,故答案为:CuO+2e﹣+2Li+═Cu+Li2O. 29.【分析】该原电池反应式中,Zn元素化合价由0价变为+2价、Ag元素化合价由+1价变为0价,所以Zn作负极、Ag2O作正极,负极上锌失电子发生氧化反应、正极上氧化银得电子发生还原反应. 【解答】解:该原电池反应式中,Zn元素化合价由0价变为+2价、Ag元素化合价由+1价变为0价,所以Zn作负极、Ag2O作正极,负极上锌失电子发生氧化反应、正极上氧化银得电子发生还原反应,负极反应式为 Zn﹣2e﹣+2OH﹣=Zn(OH)2、正极反应式为Ag2O+2e﹣+H2O=2Ag+2OH﹣,则总反应为总反应 Zn+Ag2O+H2O=2Ag+Zn(OH)2. 答:负极 Zn﹣2e﹣+2OH﹣=Zn(OH)2;正极 Ag2O+2e﹣+H2O=2Ag+2OH﹣;总反应 Zn+Ag2O+H2O=2Ag+Zn(OH)2.查看更多