- 2021-07-09 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021新高考化学二轮总复习专题突破练5B 物质结构与性质 元素周期律 Word版含解析
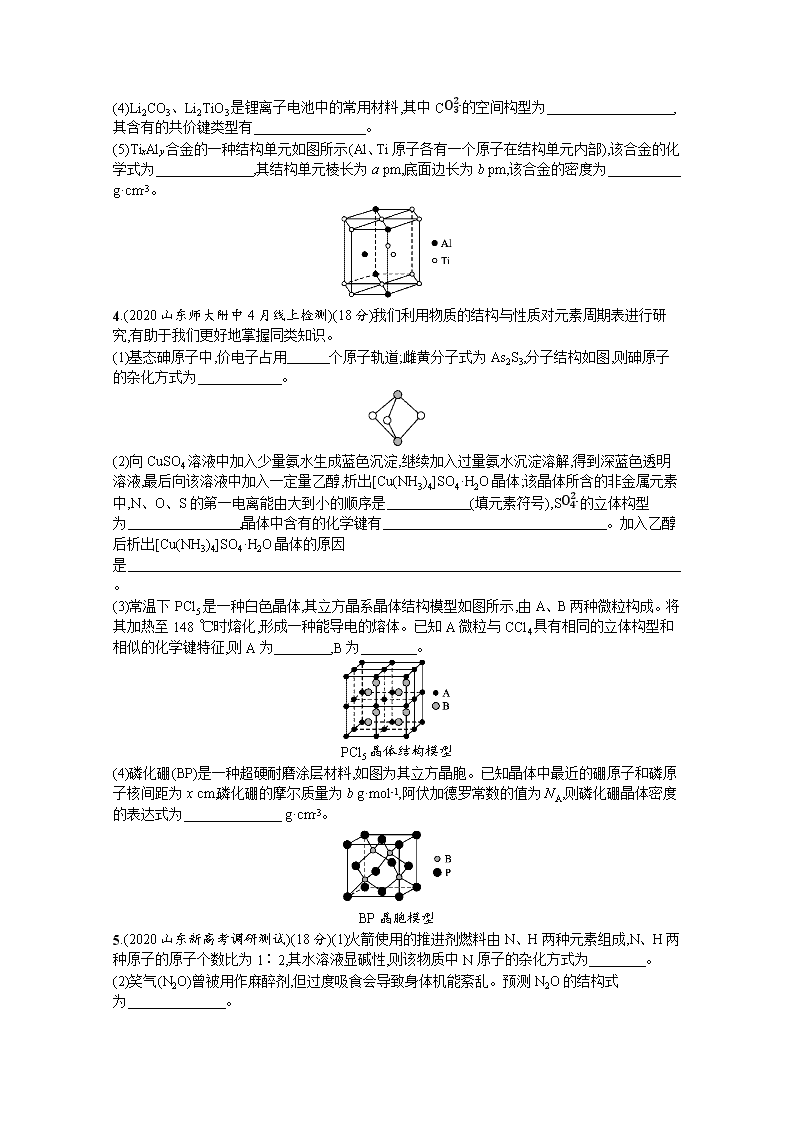
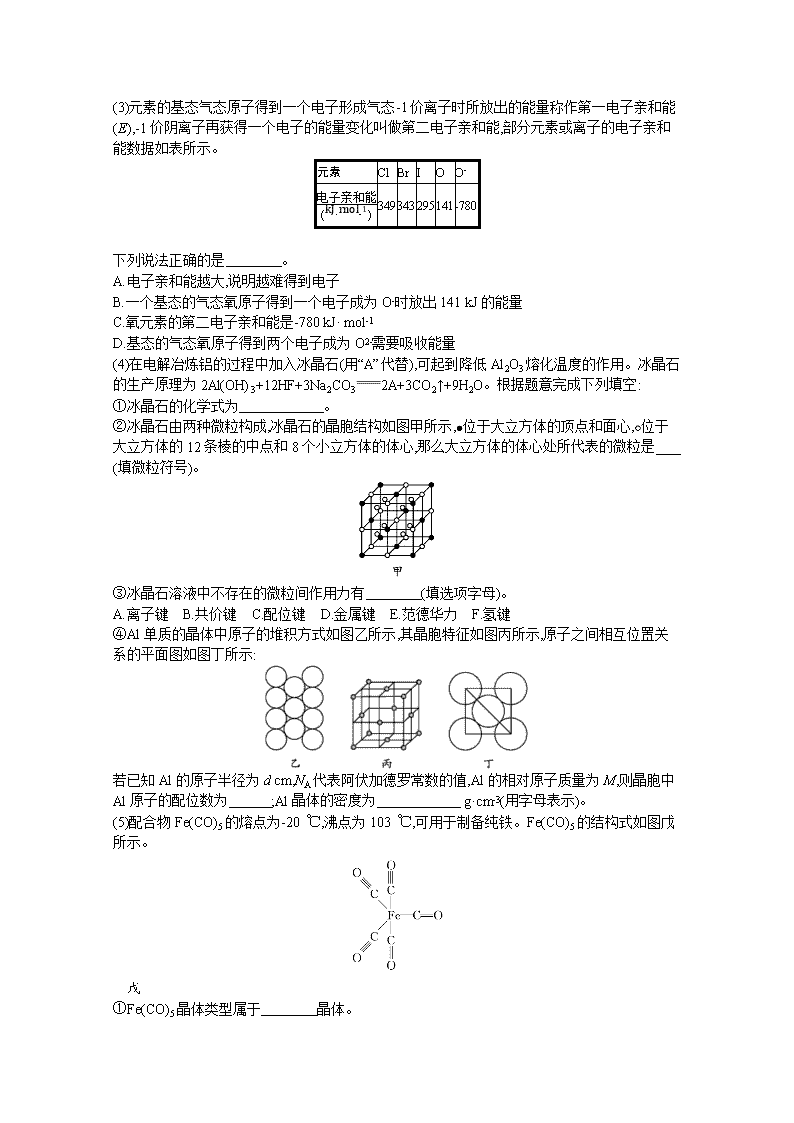
www.ks5u.com 专题突破练5B 物质结构与性质 元素周期律 填空题(本题包括6小题,共100分) 1.(2020安徽皖南八校联考)(15分)已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下均呈气态;Y原子的最外层电子数是其电子层数的2倍;M与X同族;Z、G分别是地壳中含量最高的非金属元素和金属元素。回答下列问题: (1)Y、Z、M、G四种元素的原子半径由大到小的顺序是 (用元素符号表示)。 (2)Z在元素周期表中的位置为 ,M2Z的电子式为 。 (3)上述元素的最高价氧化物对应的水化物中,酸性最强的水化物是 (写化学式)。 (4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且它的产量可以用来衡量一个国家的石油化工发展水平的是 (写名称)。 (5)GQ3溶液与过量的MZX溶液反应的化学方程式为 。 (6)常温下,下列物质不能与G的单质发生反应的是 (填标号)。 A.CuSO4溶液 B.浓硫酸 C.NaOH溶液 D.浓硝酸 E.氧化铜 2.(2020天津南开中学一模)(15分)周期表前四周期的元素X、Y、Z、W,原子序数依次增大,X原子基态时L层中p轨道电子数与s轨道电子数相同;Y原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料;W位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题: (1)X位于元素周期表的第 周期 族。 (2)元素的第一电离能:X (填“>”或“<”,下同)Y;原子半径:X Y。 (3)Y的最高价氧化物对应水化物中酸根离子的立体构型是 (用文字描述)。 (4)Z3+基态核外电子排布式为 ,用铁氰化钾溶液检验Z2+的离子方程式为 。 (5)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 ,它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为 。 3.(2020山东日照一模)(16分)SiC纤维单向增强的TixAly基复合材料可作为高超音速飞行器表面的放热材料。回答下列问题: (1)C元素所在周期中,第一电离能最大的元素是 (填元素符号)。 (2)基态Ti原子的价电子排布式为 ,能量最高的能级有 个空轨道。 (3)甲基硅油结构如图所示,其中Si原子的杂化方式为 ,以甲基硅油为主要成分的硅橡胶能够耐高温的原因是 。 ………… (4)Li2CO3、Li2TiO3是锂离子电池中的常用材料,其中CO32-的空间构型为 ,其含有的共价键类型有 。 (5)TixAly合金的一种结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),该合金的化学式为 ,其结构单元棱长为a pm,底面边长为b pm,该合金的密度为 g·cm-3。 4.(2020山东师大附中4月线上检测)(18分)我们利用物质的结构与性质对元素周期表进行研究,有助于我们更好地掌握同类知识。 (1)基态砷原子中,价电子占用 个原子轨道;雌黄分子式为As2S3,分子结构如图,则砷原子的杂化方式为 。 (2)向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体;该晶体所含的非金属元素中,N、O、S的第一电离能由大到小的顺序是 (填元素符号),SO42-的立体构型为 ,晶体中含有的化学键有 。加入乙醇后析出[Cu(NH3)4]SO4·H2O晶体的原因是 。 (3)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如图所示,由A、B两种微粒构成。将其加热至148 ℃时熔化,形成一种能导电的熔体。已知A微粒与CCl4具有相同的立体构型和相似的化学键特征,则A为 ,B为 。 PCl5晶体结构模型 (4)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其立方晶胞。已知晶体中最近的硼原子和磷原子核间距为x cm,磷化硼的摩尔质量为b g·mol-1,阿伏加德罗常数的值为NA,则磷化硼晶体密度的表达式为 g·cm-3。 BP晶胞模型 5.(2020山东新高考调研测试)(18分)(1)火箭使用的推进剂燃料由N、H两种元素组成,N、H两种原子的原子个数比为1∶2,其水溶液显碱性,则该物质中N原子的杂化方式为 。 (2)笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。预测N2O的结构式为 。 (3)元素的基态气态原子得到一个电子形成气态-1价离子时所放出的能量称作第一电子亲和能(E),-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或离子的电子亲和能数据如表所示。 元素 Cl Br I O O- 电子亲和能(kJ·mol-1) 349 343 295 141 -780 下列说法正确的是 。 A.电子亲和能越大,说明越难得到电子 B.一个基态的气态氧原子得到一个电子成为O-时放出141 kJ的能量 C.氧元素的第二电子亲和能是-780 kJ· mol-1 D.基态的气态氧原子得到两个电子成为O2-需要吸收能量 (4)在电解冶炼铝的过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔化温度的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO32A+3CO2↑+9H2O。根据题意完成下列填空: ①冰晶石的化学式为 。 ②冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,位于大立方体的顶点和面心,位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是 (填微粒符号)。 ③冰晶石溶液中不存在的微粒间作用力有 (填选项字母)。 A.离子键 B.共价键 C.配位键 D.金属键 E.范德华力 F.氢键 ④Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示: 若已知Al的原子半径为d cm,NA代表阿伏加德罗常数的值,Al的相对原子质量为M,则晶胞中Al原子的配位数为 ;Al晶体的密度为 g·cm-3(用字母表示)。 (5)配合物Fe(CO)5的熔点为-20 ℃,沸点为103 ℃,可用于制备纯铁。Fe(CO)5的结构式如图戊所示。 戊 ①Fe(CO)5晶体类型属于 晶体。 ②关于Fe(CO)5,下列说法正确的是 。 A.Fe(CO)5是非极性分子,CO是极性分子 B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键 C.1 mol Fe(CO)5含有10 mol配位键 D.反应Fe(CO)5Fe+5CO没有新化学键生成 6.(2020湖南四校线上联考)(18分)据报道,我国化学研究人员用Ni(NO3)2和Tb(CH3COO)3等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。 请回答下列问题: (1)基态Ni原子的价电子的电子排布图(轨道表示式)为 ,Ni在元素周期表中处于第 纵列。 (2)C、N、O三种元素中电负性最大的是 (填元素符号),C在形成化合物时,主要以共价键为主,原因是 。 (3)Ni(NO3)2中阴离子的立体构型是 ,写出与该阴离子互为等电子体的一种分子的化学式: 。 (4)一维链状配位聚合物中,碳原子的杂化形式为 。 (5)已知CH3COOH的沸点为117.9 ℃,HCOOCH3的沸点为32 ℃,CH3COOH的沸点高于HCOOCH3的主要原因是 。 (6)已知:氧化镍的晶胞结构如图所示。 ①若NA为阿伏加德罗常数的值,晶体密度为ρ g·cm-3,则该晶胞中最近的两个O2-之间的距离为 pm(用含ρ、NA的代数式表示)。 ②某缺陷氧化镍的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为 。 参考答案 专题突破练5B 物质结构与性质 元素周期律 1.答案(1)Na>Al>C>O (2)第二周期ⅥA族 Na+[··O······]2-Na+ (3)HClO4 (4)乙烯 (5)AlCl3+4NaOH3NaCl+NaAlO2+2H2O{或AlCl3+4NaOHNa[Al(OH)4]+3NaCl} (6)E 解析X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。Z、G分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素、G为Al元素,Y的原子最外层电子数是其电子层数的2倍,原子序数小于O,只能处于第二周期,最外层电子数为4,则Y为C元素,X单质在常温下呈气态,则X为H元素,X与M同主族,M原子序数大于O,则M为Na,Q单质常温下为气态,且原子序数大于Al,则Q为Cl。 (1)同周期主族元素自左而右原子半径减小,同主族元素自上而下原子半径增大,故原子半径Na>Al>C>O。 (2)Z为O元素,在元素周期表中的位置为第二周期ⅥA族,M2Z为氧化钠,其电子式为Na+[··O······]2-Na+。 (3)题给元素的最高价氧化物对应的水化物酸性最强的是HClO4。 (4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且它的产量可以用来衡量一个国家的石油化工发展水平的是乙烯。 (5)GQ3溶液与过量的MZX溶液反应的化学方程式为AlCl3+4NaOH3NaCl+NaAlO2+2H2O{或AlCl3+4NaOHNa[Al(OH)4]+3NaCl}。 (6)常温下,不能与Al发生反应的是氧化铜。 2.答案(1)二 ⅣA (2)< > (3)平面三角形 (4)1s22s22p63s23p63d5或[Ar]3d5 3Fe2++2Fe(CN)63-Fe3Fe(CN)62↓ (5)CuCl CuCl+2HCl(浓)H2CuCl3 解析前四周期元素X、Y、Z、W的原子序数依次增大,X原子基态时L层中p轨道电子数与s轨道电子数相同,即电子排布式为1s22s22p2,则X为C元素;Y原子基态时2p原子轨道上有3个未成对的电子,即电子排布式为1s22s22p3,则Y为N元素;Z有多种氧化物,其中一种红棕色氧化物可作涂料,则Z为Fe元素;W位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态,即电子排布式为1s22s22p63s23p63d104s1,则W为Cu元素。 (1)X为C元素,位于元素周期表的第二周期ⅣA族。 (2)X为C元素,Y为N元素,N元素的基态原子的电子排布式为1s22s22p3,p轨道处于半充满状态,较稳定,则第一电离能C查看更多