2020届高考化学一轮复习(苏教版)水的电离和溶液的酸碱性作业
水的电离和溶液的酸碱性
一、选择题(本题共10小题,每小题5分,共50分。每小题只有一个选项符合题目要求)
1.(2019湖北部分重点中学高三上学期起点考试)下列有关滴定操作的说法正确的是( )
A.用25 mL滴定管进行中和滴定时,用去标准液的体积为21.7 mL
B.用标准的KOH溶液滴定未知浓度的盐酸,洗净碱式滴定管后直接取标准KOH溶液进行滴定,则测定结果偏低
C.用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中含有NaOH杂质,则测定结果偏高
D.用未知浓度的盐酸滴定标准的KOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏高
2.(2018贵州七校联考)下列说法不正确的是( )
A.将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是a>c>b
B.常温下,浓度均为0.1 mol·L-1的①醋酸溶液、②盐酸、③醋酸钠溶液,水的电离程度的顺序为③>①>②
C.常温下,将相同体积的pH=3的硫酸和pH=11的一元碱BOH溶液混合,所得溶液可能为中性,也可能为酸性
D.物质的量浓度相同的①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH的顺序为③>①>②
3.已知NaHSO4在水中的电离方程式为NaHSO4Na++H++SO42-。某温度下,向c(H+)=1×10-6mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2mol·L-1。下列对该溶液的叙述不正确的是( )
A.该温度高于25 ℃
B.由水电离出来的H+的浓度为1×10-10mol·L-1
C.加入NaHSO4晶体抑制水的电离
D.取该溶液加水稀释100倍,溶液中的c(OH-)减小
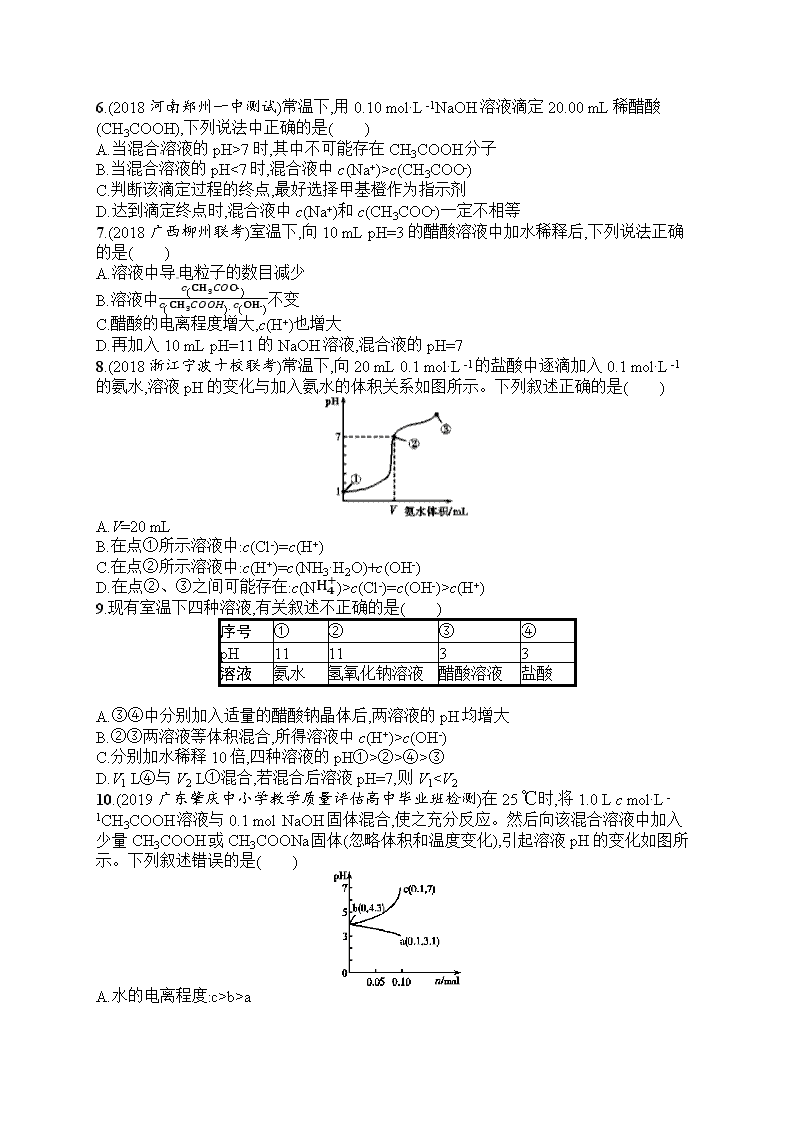
4.(2018河北唐山统考)不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示。下列有关说法不正确的是( )
A.d点对应的食盐水pH=6,呈中性
B.向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-)
C.温度为T ℃时,0.05 mol·L-1Ba(OH)2溶液的pH=11
D.a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同
5.(2019深圳市高级中学高三月考)室温下,下列说法正确的是( )
A.将pH=2的盐酸和pH=4的硫酸等体积混合,所得溶液pH=3
B.HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH大
C.将10 mL pH=3的HA溶液稀释到100 mL,若溶液的pH<4,则HA为弱酸
D.向0.1 mol·L-1氨水中加入少量硫酸铵固体,溶液中c(OH-)/c(NH3·H2O)增大
6.(2018河南郑州一中测试)常温下,用0.10 mol·L-1NaOH溶液滴定20.00 mL稀醋酸(CH3COOH),下列说法中正确的是( )
A.当混合溶液的pH>7时,其中不可能存在CH3COOH分子
B.当混合溶液的pH<7时,混合液中c(Na+)>c(CH3COO-)
C.判断该滴定过程的终点,最好选择甲基橙作为指示剂
D.达到滴定终点时,混合液中c(Na+)和c(CH3COO-)一定不相等
7.(2018广西柳州联考)室温下,向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中c(CH3COO-)c(CH3COOH)·c(OH-)不变
C.醋酸的电离程度增大,c(H+)也增大
D.再加入10 mL pH=11的NaOH溶液,混合液的pH=7
8.(2018浙江宁波十校联考)常温下,向20 mL 0.1 mol·L-1的盐酸中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述正确的是( )
A.V=20 mL
B.在点①所示溶液中:c(Cl-)=c(H+)
C.在点②所示溶液中:c(H+)=c(NH3·H2O)+c(OH-)
D.在点②、③之间可能存在:c(NH4+)>c(Cl-)=c(OH-)>c(H+)
9.现有室温下四种溶液,有关叙述不正确的是( )
序号
①
②
③
④
pH
11
11
3
3
溶液
氨水
氢氧化钠溶液
醋酸溶液
盐酸
A.③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C.分别加水稀释10倍,四种溶液的pH①>②>④>③
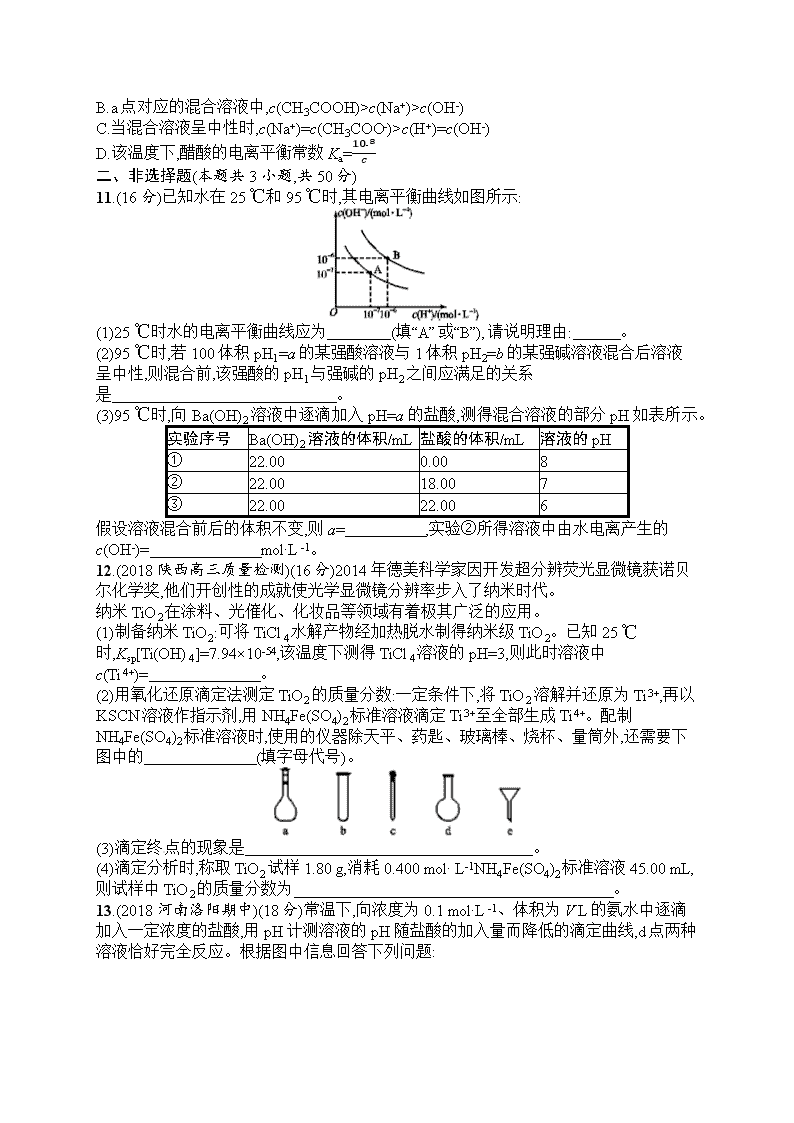
D.V1 L④与V2 L①混合,若混合后溶液pH=7,则V1
b>a
B.a点对应的混合溶液中,c(CH3COOH)>c(Na+)>c(OH-)
C.当混合溶液呈中性时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
D.该温度下,醋酸的电离平衡常数Ka=10-8c
二、非选择题(本题共3小题,共50分)
11.(16分)已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示:
(1)25 ℃时水的电离平衡曲线应为 (填“A”或“B”),请说明理由: 。
(2)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
(3)95 ℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
实验序号
Ba(OH)2溶液的体积/mL
盐酸的体积/mL
溶液的pH
①
22.00
0.00
8
②
22.00
18.00
7
③
22.00
22.00
6
假设溶液混合前后的体积不变,则a= ,实验②所得溶液中由水电离产生的c(OH-)= mol·L-1。
12.(2018陕西高三质量检测)(16分)2014年德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,他们开创性的成就使光学显微镜分辨率步入了纳米时代。
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(1)制备纳米TiO2:可将TiCl4水解产物经加热脱水制得纳米级TiO2。已知25 ℃时,Ksp[Ti(OH)4]=7.94×10-54,该温度下测得TiCl4溶液的pH=3,则此时溶液中c(Ti4+)= 。
(2)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的 (填字母代号)。
(3)滴定终点的现象是 。
(4)滴定分析时,称取TiO2试样1.80 g,消耗0.400 mol·L-1NH4Fe(SO4)2标准溶液45.00 mL,则试样中TiO2的质量分数为 。
13.(2018河南洛阳期中)(18分)常温下,向浓度为0.1 mol·L-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
(1)该温度时NH3·H2O的电离常数K= 。
(2)比较b、c、d三点时的溶液中,由水电离出的c(OH-)大小顺序为 。
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是 (填字母,下同)。
A.c(H+)·c(OH-) B.c(H+)c(OH-) C.c(NH4+)·c(OH-)c(NH3·H2O) D.c(NH3·H2O)·c(H+)c(NH4+)
(4)根据以上滴定曲线判断下列说法正确的是 (溶液中N元素只存在NH4+和NH3·H2O两种形式)。
A.点b所示溶液中:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH= ,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为 。
课时规范练23 水的电离和溶液的酸碱性
1.D 滴定管精确值为0.01 mL,读数应保留小数点后2位,A项错误;用标准KOH溶液滴定未知浓度的盐酸,洗净碱式滴定管后直接取标准KOH溶液进行滴定,由于没有润洗,标准液浓度减小,消耗标准液体积增大,则测定结果偏高,B项错误;所用的固体KOH中混有NaOH,由于相同质量的氢氧化钠和氢氧化钾,氢氧化钠的物质的量大于氢氧化钾的物质的量,故所配的溶液的OH-浓度偏大,导致消耗标准液的体积偏小,则测定结果偏低,C项错误;用未知浓度的盐酸滴定标准的KOH溶液时,若滴定前仰视读数,滴定至终点后俯视读数,导致消耗的盐酸体积偏小,依据c(酸)=c(碱)×V(碱)V(酸)可知测定结果偏高,D项正确。
2.C 稀释碱溶液时,pH逐渐变小,稀释相同倍数时,氢氧化钠溶液的pH变化幅度较大,氨水继续发生电离,pH变化幅度较小,A项正确;醋酸钠为强碱弱酸盐,发生水解反应,促进水的电离,醋酸溶液和盐酸抑制水的电离,由于盐酸是强酸,完全电离,氢离子浓度大,对水的电离的抑制程度大,B项正确;常温下,将相同体积的pH=3的硫酸和pH=11的一元强碱BOH溶液混合,所得溶液呈中性,常温下,将相同体积的pH=3的硫酸和pH=11的一元弱碱BOH溶液混合,碱过量,所得溶液呈碱性,C项错误;(NH4)2SO4和NH4Cl水解,使溶液呈酸性,(NH4)2SO4溶液中H+较多,pH较小,D项正确。
3.D A项,KW=1×10-6×1×10-6=1×10-12,温度高于25 ℃;B、C项,NaHSO4电离出的H+抑制H2O电离,c(H+)H2O=c(OH-)=1×10-10mol·L-1;D项,加H2O稀释,c(H+)减小,而c(OH-)增大。
4.D 由题给图像可知,d点c(H+)=c(OH-)=1×10-6mol·L-1,溶液pH=6,呈中性,A项正确;25 ℃时,向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,溶液pH=7,由电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CH3COO-),因为c(H+)=c(OH-),所以c(Na+)=c(CH3COO-),B项正确;温度为T ℃时,由d点知KW=1×10-12,0.05 mol·L-1的Ba(OH)2溶液中c(OH-)=0.1 mol·L-1,c(H+)=KWc(OH-)=1×10-11mol·L-1,Ba(OH)2溶液的pH=11,C项正确;a点对应的稀硫酸中c(H+)=1×10-6mol·L-1,c(OH-)=1×10-8mol·L-1,水电离出的c(H+)=c(OH-)=1×10-8mol·L-1,水的电离受到抑制,c点对应的CH3COONa溶液中水的电离得到促进,水电离出的c(H+)=c(OH-)=1×10-6mol·L-1,D项错误。
5.C 混合后c(H+)=10-2+10-42 mol·L-1≈0.5×10-2mol·L-1,pH=2.3,故A项错误;根据越弱越水解的原则,HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH小,故B项错误;将10 mLpH=3的HA溶液稀释到100 mL,如pH=4,则HA为强酸,如pH<4,加水促进弱酸的电离,则HA为弱酸,故C项正确;向0.1 mol·L-1氨水中加入少量硫酸铵固体,加入少量硫酸铵固体,平衡向逆方向移动,溶液中c(OH-)c(NH3·H2O)减小,故D项错误。
6.D 当混合溶液的pH>7时,溶质主要是CH3COONa,要发生水解,生成CH3COOH分子,故A项错误;当混合溶液的pH<7时,c(H+)>c(OH-),又溶液中存在电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)4.4时变黄,3.1~4.4时呈橙色,该反应生成物是CH3COONa,水溶液呈碱性,应选用酚酞作指示剂,故C项错误;达到滴定终点时,溶液呈碱性,由电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)>c(Ac-),D项正确。
7.B 加水稀释,电离平衡正向移动,氢离子、硝酸根离子浓度减小,但数目增加,A项错误;分式上下都乘以氢离子浓度,则分式等于醋酸的电离平衡常数除以水的离子积常数,所以室温下不变,B项正确;稀释促进电离,电离程度增大,氢离子浓度减小,C项错误;醋酸的浓度大于0.001 mol·L-1,氢氧化钠的浓度为0.001 mol·L-1,所以二者等体积混合,醋酸有剩余,溶液显酸性,pH<7,D项错误。
8.D NH3·H2O属于弱碱,HCl属于强酸,②点pH=7溶液显中性,氨水稍过量,即V略大于20 mL,故A项错误;根据电荷守恒,有c(H+)=c(Cl-)+c(OH-),故B项错误;②点pH=7,因此c(H+)=c(OH-),故C项错误;②和③之间溶质为NH3·H2O和NH4Cl,因此可能存在c(NH4+)>c(Cl-)=c(OH-)>c(H+),故D项正确。
9.D 从平衡移动角度分析,CH3COONa电离出的CH3COO-:a.与盐酸中的H+结合生成CH3COOH;b.使醋酸溶液中电离平衡CH3COOHCH3COO-+H+左移,两溶液中H+浓度均减小,所以pH均增大,A项正确;假设均是强酸强碱,且物质的量浓度相同,等体积混合后溶液呈中性,但③醋酸是弱酸,其浓度远远大于②,即混合后醋酸过量,溶液显酸性,c(H+)>c(OH-),B项正确;分别加水稀释10倍,假设平衡不移动,那么①②溶液的pH均为10,但稀释氨水使电离平衡NH3·H2ONH4++OH-右移,使①pH>10,同理稀释醋酸溶液后pH<4,C项正确;假设均是强酸强碱,混合后溶液呈中性,V1=V2,但①氨水是弱碱,其浓度远远大于④盐酸,所以需要的①氨水少,即V1>V2,D项错误。
10.D 由图可得,25 ℃时c点pH=7,所以c点水电离出的c(H+)水=c(OH-)水=10-7mol·L-1,b点pH=4.3,所以b点溶液中c(H+)=10-4.3mol·L-1,则由水电离出的c(H+)水=c(OH-)水=10-(14-4.3)mol·L-1=10-9.7mol·L-1,a点pH=3.1,所以a点溶液中c(H+)=10-3.1mol·L-1,则由水电离出的c(H+)水=c(OH-)水=10-(14-3.1)mol·L-1=10-10.9mol·L-1,因此水的电离程度:c>b>a,A项叙述正确;b点时溶液呈酸性,说明加入0.1 mol NaOH固体后CH3COOH有剩余,c(Na+)=0.1 mol·L-1,混合前CH3COOH溶液浓度c应比0.1 mol·L-1大,a点时又加入0.1 mol CH3COOH,因为CH3COOH电离程度很小,所以此时溶液中的c(CH3COOH)一定大于c(Na+),又根据前面的分析a点c(OH-)=10-10.9mol·L-1,所以a点对应的混合溶液中,c(CH3COOH)>c(Na+)>c(OH-),故B项叙述正确;由题意混合溶液中阳离子有Na+和H+,阴离子有CH3COO-和OH-,根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),25 ℃当混合溶液呈中性时,c(H+)=c(OH-)=10-7mol·L-1,则c(Na+)=c(CH3COO-),结合图像可得c(Na+)=0.2 mol·L-1,所以c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故C项叙述正确;由前面的分析并结合图像可得,25 ℃当混合溶液呈中性时,c(H+)=10-7mol·L-1,c(CH3COO-)=0.2 mol·L-1,c(CH3COOH)=(c+0.1-0.2)mol·L-1=(c-0.1)mol·L-1,所以该温度下,醋酸的电离平衡常数Ka=c(CH3COO-)·c(H+)c(CH3COOH)=0.2×10-7c-0.1,故D项叙述错误。
11.答案 (1)A 水的电离是吸热过程,温度较低时,电离程度较小,c(H+)、c(OH-)均较小
(2)a+b=14(或pH1+pH2=14) (3)4 1.0×10-7
解析 (1)温度升高,促进水的电离,水的离子积增大,水中氢离子浓度、氢氧根离子浓度都增大,水的pH减小,但溶液仍然呈中性。因此结合图像中A、B曲线变化情况及氢离子浓度、氢氧根离子浓度可以判断,25 ℃时水的电离平衡曲线应为A。
(2)要注意95 ℃时,水的离子积为1×10-12,即c(H+)·c(OH-)=1×10-12,则等体积强酸、强碱反应至中性时,有pH(酸)+pH(碱)=12。根据95 ℃时混合后溶液呈中性,pH2=b的某强碱溶液中c(OH-)=10b-12mol·L-1;由100V×10-amol·L-1=V×10b-12mol·L-1,可得10-a+2=10b-12,得a+b=14或pH1+pH2=14。
(3)95 ℃,pH=6时溶液呈中性,根据表中实验①数据可得c(OH-)=1.0×10-4mol·L-1,根据表中实验③的数据可以判断,盐酸中的c(H+)与Ba(OH)2溶液中c(OH-)相等,所以a=4,即pH=4;实验②溶液呈碱性,其c(OH-)=22.00×10-4-18.00×10-422.00+18.00 mol·L-1=1.0×10-5mol·L-1,由水电离出的c(OH-)=1.0×10-7mol·L-1。
12.答案 (1)7.94×10-10mol·L-1 (2)ac (3)溶液变为红色,且半分钟内不变色 (4)80%
解析 (1)TiCl4溶液的pH=3,c(OH-)=10-11,Ksp[Ti(OH)4]=7.94×10-54,则c(Ti4+)×c4(OH-)=c(Ti4+)×(10-11)4=7.94×10-54,c(Ti4+)=7.94×10-10 mol·L-1;(2)配制NH4Fe(SO4)2
标准溶液时,使用的仪器有天平、药匙、玻璃棒、烧杯、量筒、容量瓶、胶头滴管等,故选ac;(3)达到滴定终点时,Fe3+不再被还原为Fe2+,所以滴定终点的现象是溶液变为红色,且半分钟内不变色;
(4)设TiO2的质量分数为a,
TiO2 ~ NH4Fe(SO4)2;
80 g 1 mol
1.80 g×a 0.400 mol·L-1×0.045 L
80 g1.80 g×a=1mol0.400mol·L-1×0.045 L,a=0.8=80%。
13.答案 (1)10-5 (2)d>c>b (3)ACD (4)D (5)1 11V9
解析 (1)未加入盐酸前,0.1 mol·L-1氨水的pH=11,则溶液中c(OH-)=1×10-1410-11 mol·L-1=0.001 mol·L-1;由于水的电离程度较小,可忽略水的电离,则溶液中c(NH4+)≈c(OH-)=0.001 mol·L-1;NH3·H2O的电离程度较小,则c(NH3·H2O)≈0.1 mol·L-1,故该温度时NH3·H2O的电离常数K=c(NH4+)·c(OH-)c(NH3·H2O)=0.001×0.0010.1=10-5。
(2)b、c两点溶液中都含有NH3·H2O,抑制水的电离,且c(NH3·H2O)越大,对水的电离的抑制程度越大,d点氨水与盐酸恰好完全反应生成NH4Cl,NH4+发生水解而促进水的电离,故三点水电离出的c(OH-)大小顺序为d>c>b。
(3)滴定时,由b点到c点的过程中,c(H+)·c(OH-)=KW,由于温度不变,则KW不变,A项正确;随着反应的进行,溶液的碱性减弱,溶液中c(OH-)减小而c(H+)增大,故c(H+)c(OH-)的值增大,B项错误;NH3·H2O的电离常数Kb=c(NH4+)·c(OH-)c(NH3·H2O),温度不变,则Kb不变,即c(NH4+)·c(OH-)c(NH3·H2O)保持不变,C项正确;c(NH3·H2O)·c(H+)c(NH4+)=KWKb,温度不变,则KW、Kb均不变,即c(NH3·H2O)·c(H+)c(NH4+)不变,D项正确。
(4)b点溶液为等浓度NH4Cl和NH3·H2O的混合液,溶液呈碱性,说明NH3·H2O的电离程度大于NH4+的水解程度,据电荷守恒可得c(NH4+)+c(H+)=c(OH-)+c(Cl-),据物料守恒可得2c(Cl-)=c(NH4+)+c(NH3·H2O),综合上述两式可得c(NH4+)+2c(H+)=c(NH3·H2O)+2c(OH-),A项错误;c点溶液的pH=7,则有c(H+)=c(OH-),结合电荷守恒式可得c(NH4+)=c(Cl-)>c(H+)=c(OH-),B项错误;d点盐酸与氨水恰好完全反应生成NH4Cl,NH4+发生水解而使溶液呈酸性,但其水解程度较小,故离子浓度关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-),C项错误;当加入盐酸的量较少时,氨水中c(NH3·H2O)较大,生成的NH4Cl较少,溶液中c(NH3·H2O)远大于c(NH4Cl),可能出现c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+),D项正确。
(5)由题图可知,d点盐酸与氨水恰好完全反应生成NH4Cl,由NH3·H2O~HCl可知,c(HCl)=0.1 mol·L-1×VLVL=0.1 mol·L-1,故滴定过程中所用盐酸的pH=1。设e点加入盐酸的体积为x L,则剩余盐酸的量n余(HCl)=0.1 mol·L-1×x L-0.1 mol·L-1×V L=0.1(x-V) mol,此时溶液的pH=2,则有0.1(x-V) mol=10-2mol·L-1×(x+V) L,解得x=11V9。