- 2021-07-09 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年河北省衡水中学高考化学模拟试卷(B卷)(4月份)
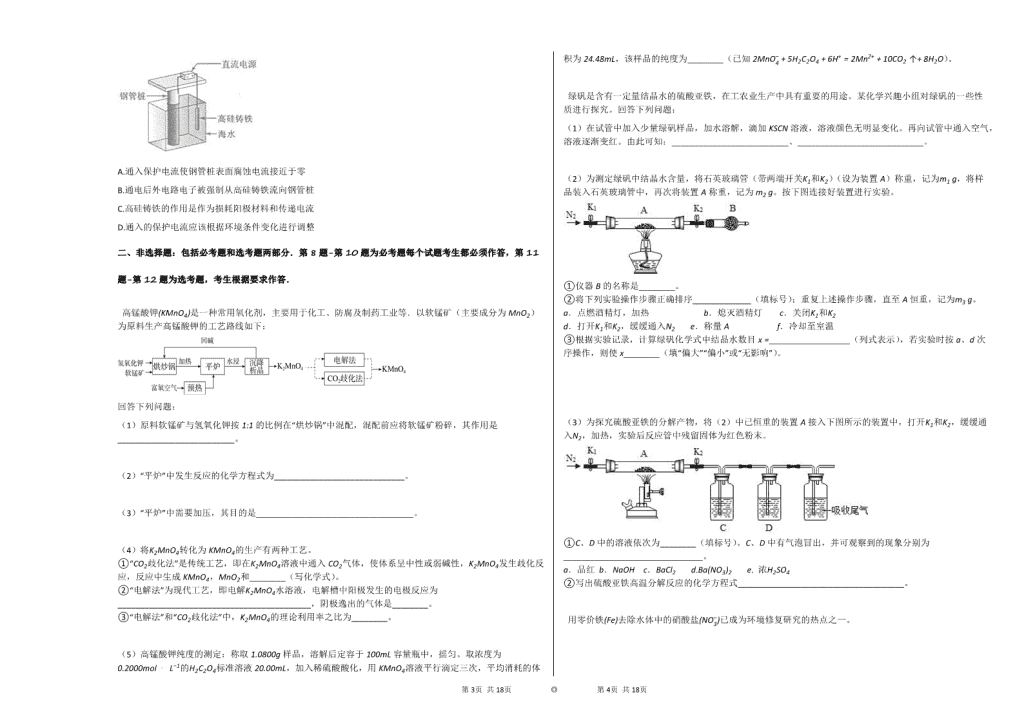
2020年河北省衡水中学高考化学模拟试卷(B卷)(4月份) 一、选择题:本大题包括7小题,每小题6分.在每小题给出的四个选项中,只有一项符合题目要求. 1. 阿伏加德罗常数的值为NA。下列说法正确的是( ) A.1L 0.1mol⋅L−1NH4Cl溶液中,NH4+的数量为0.1NA B.2.4g Mg与H2SO4完全反应,转移的电子数为0.1NA C.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA D.0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA 2. 常温下,下列各组离子在指定溶液中能大量共存的是( ) A.无色透明的溶液中:Fe3+、Mg2+、SCN −、Cl − B.c(H+)/c(OH−)=1×10 −12的溶液中:K+、Na+、CO32−、NO3− C.c(Fe2+ )=1 mol⋅L−1的溶液中:K+、NH4+、MnO4−、SO42− D.能使甲基橙变红的溶液中:Na+、NH4+、SO42−、HCO3− 3. K2Cr2O7溶液中存在平衡:Cr2O72−(橙色)+H2O⇌2CrO42−(黄色)+2H+。用K2Cr2O7溶液进行如图所示实验。结合实验,下列说法不正确的是( ) A.①中溶液橙色加深,③中溶液变黄 B.②中Cr2O72−被C2H5OH还原 C.对比②和④可知K2Cr2O7酸性溶液氧化性强 D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色 4. 为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2,CO2,SO2,NO,CO,不考虑其他成分),设计了如下流程:下列说法不正确的是( ) A.固体Ⅰ中主要含有Ca(OH)2、CaCO3、CaSO3 B.X可以是空气,且需过量 C.捕获剂所捕获的气体主要是CO D.处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2−=N2↑+2H2O 5. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是( ) A.X的简单氢化物的热稳定性比W强 B.Y的简单离子与X的具有相同的电子层结构 C.Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红 D.Z与X属于同一主族,与Y属于同一周期 6. 通过以下反应可获得新型能源二甲醚(CH3OCH3 ),下列说法不正确的是( ) ①C(s)+H2O(g)=CO(g)+H2 (g)ΔH1=a kJ⋅mol−1 ②CO(g)+H2O(g)=CO2(g)+H2 (g)ΔH2=b kJ⋅mol−1 ③CO2 (g)+3H2 (g)=CH3OH(g)+H2O(g)ΔH3=c kJ⋅mol−1 ④2CH3OH(g)=CH3OCH3 (g)+H2O(g)ΔH4=d kJ⋅mol−1 A.反应①、②为反应③提供原料气 B.反应③也是CO2资源化利用的方法之一 C.反应CH3OH(g)=12CH3OCH3 (g)+12H2O(l)ΔH=d2kJ⋅mol−1 D.反应2CO(g)+4H2 (g)=CH3OCH3 (g)+H2O(g)ΔH=( 2b+2c+d ) kJ⋅mol−1 7. 支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极,下列有关表述不正确的是( ) 第17页 共18页 ◎ 第18页 共18页 A.通入保护电流使钢管桩表面腐蚀电流接近于零 B.通电后外电路电子被强制从高硅铸铁流向钢管桩 C.高硅铸铁的作用是作为损耗阳极材料和传递电流 D.通入的保护电流应该根据环境条件变化进行调整 二、非选择题:包括必考题和选考题两部分.第8题-第10题为必考题每个试题考生都必须作答,第11题-第12题为选考题,考生根据要求作答. 高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等.以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下: 回答下列问题: (1)原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是__________________________。 (2)“平炉”中发生反应的化学方程式为_____________________________。 (3)“平炉”中需要加压,其目的是___________________________________。 (4)将K2MnO4转化为KMnO4的生产有两种工艺。 ①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和________(写化学式)。 ②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为___________________________________________,阴极逸出的气体是________。 ③“电解法”和“CO2歧化法”中,K2MnO4的理论利用率之比为________。 (5)高锰酸钾纯度的测定:称取1.0800g样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为0.2000mol⋅L−1的H2C2O4标准溶液20.00mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48mL,该样品的纯度为________(已知2MnO4−+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题: (1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:__________________________、____________________________。 (2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g,将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。 ①仪器B的名称是________。 ②将下列实验操作步骤正确排序_____________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。 a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温 ③根据实验记录,计算绿矾化学式中结晶水数目x=__________________(列式表示),若实验时按a、d次序操作,则使x________(填“偏大”“偏小”或“无影响”)。 (3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热,实验后反应管中残留固体为红色粉末。 ①C、D中的溶液依次为________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________________________。 a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e. 浓H2SO4 ②写出硫酸亚铁高温分解反应的化学方程式_____________________________________。 用零价铁(Fe)去除水体中的硝酸盐(NO3−)已成为环境修复研究的热点之一。 (1)Fe还原水体中NO3−的反应原理如图所示。 ①作负极的物质是________。 ②正极的电极反应式是________。 第17页 共18页 ◎ 第18页 共18页 (2)将足量铁粉投入水体中,经24小时测定NO3−的去除率和pH,结果如下: 初始pH pH=2.5 pH=4.5 NO3−的去除率 接近100% <50% 24小时pH 接近中性 接近中性 铁的最终物质形态 pH=4.5时,NO3−的去除率低。其原因是________。 (3)其他条件与(2)相同,经1小时测定NO3−的去除率和pH,结果如下: 初始pH pH=2.5 pH=4.5 NO3−的去除率 约10% 约3% 1小时pH 接近中性 接近中性 与(2)中数据对比,解释(2)中初始pH不同时,NO3−去除率和铁的最终物质形态不同的原因:________。 (二)选考题:共15分。请考生从给出的题中每科任选一题作答,并用2B铅笔在答题卡上把所选题目的题号涂黑。注意所做题目的题号必须与所涂题目的题号一致,在答题卡选答区域指定位置答题。如果多做,则每学科按所做的第一小题计分。【化学—选修3:物质结构与性质】(15分) 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题: (1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为________nm(填标号)。 A.404.4 B.553.5 C.589.2 D.670.8 E.766.5 (2)基态K原子中,核外电子占据的最高能层的符号是________,占据该能层电子的电子云轮廓图形状为________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是_________________________________________________。 (3)X射线衍射测定等发现,I3AsF6中存在I3+离子.I3+离子的几何构型为________,中心原子的杂化类型为________。 (4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示:K与O间的最短距离为________nm,与K紧邻的O个数为________。 (5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于________位置,O处于________位置. 【化学-选修5:有机化学基础】(15分) 化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下: 已知以下信息: ①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6:1:1. ②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应. 回答下列问题: (1)A的结构简式为_________________. (2)B的化学名称为______________. (3)C与D反应生成E的化学方程式为_____________________________________________________. (4)由E生成F的反应类型为_________________。 (5)G的分子式为______________. (6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有________种;其中核磁共振氢谱为四组峰,峰面积比为3:2:2:1的结构简式为______________、______________. 第17页 共18页 ◎ 第18页 共18页 第17页 共18页 ◎ 第18页 共18页 参考答案与试题解析 2020年河北省衡水中学高考化学模拟试卷(B卷)(4月份) 一、选择题:本大题包括7小题,每小题6分.在每小题给出的四个选项中,只有一项符合题目要求. 1. 【答案】 D 【考点】 阿伏加德罗常数 【解析】 【解答】 A.1L 0.1mol⋅L−1的NH4Cl溶液中含有溶质NH4Cl的物质的量为0.1mol,由于NH4+部分水解,溶液中含有的NH4+的物质的量小于0.1mol,则NH4+的数量小于0.1NA,A错误; B.2.4g Mg的物质的量为0.1mol,与H2SO4反应生成MgSO_4和H2,转移的电子数为0.2NA,B错误; C.标准状况下,氮气与氧气不反应,所以2.24L N2和O2的混合气体的物质的量为0.1mol,所含分子数为0.1 NA,C错误; D.碘与氢气反应的化学方程式为H2(g)+I2(g)⇌2HI(g),由化学方程式可知,反应前后混合气体的总物质的量不变,反应前混合气体的总物质的量为0.2mol,所以反应后混合气体的总物质的量还是0.2mol,其分子总数为0.2NA,D正确。 故选D。 2. 【答案】 B 【考点】 离子共存问题 【解析】 A.无色透明说明溶液中不含有色离子,且离子之间不反应; B.c(H+)/c(OH−)=1×10 −12的溶液,溶液呈碱性,离子之间不反应且和氢氧根离子不反应的能大量共存; C.能和亚铁离子反应的离子不能大量共存; D.能使甲基橙溶液变红色,说明溶液呈酸性,离子之间不反应的能大量共存. 【解答】 解:A.Fe3+呈黄色,不符合无色条件,且Fe3+、SCN −发生络合反应而不能大量共存,故A错误; B.c(H+)/c(OH−)=1×10 −12的溶液,溶液呈碱性,这几种离子之间不反应且都不和氢氧根离子反应,所以能大量共存,故B正确; C.Fe2+、MnO4−发生氧化还原反应而不能大量共存,故C错误; D.能使甲基橙溶液变红色,说明溶液呈酸性,HCO3−能和氢离子反应生成二氧化碳和水而不能大量共存,故D错误; 故选B. 3. 【答案】 D 【考点】 物质制备实验和性质实验应用 化学平衡的影响因素 氧化还原反应 【解析】 增大cH+,题给反应平衡逆向移动,cCr2O72−增大,溶液橙色加深,加入OH−,中和H+,使cH+减小,平衡正向移动,cCrO42−增大,溶液颜色变黄,K2Cr2O7在酸性条件下的氧化性更强。 【解答】 A.①K2Cr2O7溶液中加入H2SO4,增大cH+,题给可逆反应的平衡逆向移动,溶液橙色加深;③K2Cr2O7溶液中加入了NaOH溶液,OH−中和了溶液中的H+,使cH+减小,平衡正向移动,溶液变黄,A正确。 B.②中溶液变成绿色,说明有Cr3+生成,即Cr2O72−被C2H5OH还原为Cr3+,B正确。 C.对比②④可知,酸性条件下Cr2O72−被C2H5OH还原为Cr3+,而碱性条件下Cr2O72−不能被还原,说明酸性条件下K2Cr2O7的氧化性更强,C正确。 D.若向④中加入过量的H2SO4溶液,溶液呈酸性,题给可逆反应的平衡逆向移动,CrO42−转化为Cr2O72−,K2Cr2O7会被C2H5OH还原为Cr3+,溶液变绿色,不会变为橙色,D错误。 故选D。 4. 【答案】 B 【考点】 工艺流程分析及应用 “三废”处理与环境保护 物质分离、提纯、除杂的实验方案设计和基本操作的综合应用 【解析】 工业废气中CO2、SO2可被石灰水吸收,生成固体1为CaCO3、CaSO3,气体1是不能被过量石灰水吸收的N2、NO、CO,气体1通入气体X,用氢氧化钠溶液处理后到的NaNO2,X可为空气,但不能过量,否则得到硝酸钠,NaNO2与含有NH4+的溶液反应生成无污染气体,应生成氮气,则气体2含有CO、N2,捕获剂所捕获的气体主要是CO,以此解答该题. 【解答】 解:工业废气中CO2、SO2可被石灰水吸收,生成固体1为CaCO3、CaSO3,气体1是不能被过量石灰水吸收的N2、NO、CO,气体1通入气体X,用氢氧化钠溶液处理后到的NaNO2,X可为空气,但不能过量,否则得到硝酸钠,NaNO2与含有NH4+的溶液反应生成无污染气体,应生成氮气,则气体2含有CO、N2,捕获剂所捕获的气体主要是CO, A.工业废气中CO2、SO2可被石灰水吸收,生成CaCO3、CaSO3,因氢氧化钙过量,则固体1主要含有Ca(OH)2、CaCO3、CaSO3,故A正确; B.由分析可知,气体1是不能被过量石灰水吸收的N2、NO、CO,气体1通入气体X,用氢氧化钠溶液处理后得到NaNO2,X可为空气,但不能过量,否则得到硝酸钠,故B错误; C.气体2含有CO、N2,所捕获的气体主要是CO,防止污染空气,故C正确; D.NaNO2与含有NH4+的溶液反应生成无污染气体,应生成氮气,发生氧化还原反应,离子方程式为NH4++NO2−=N2↑+2H2O,故D正确。 故答案为B。 5. 【答案】 第17页 共18页 ◎ 第18页 共18页 C 【考点】 原子结构与元素周期律的关系 位置结构性质的相互关系应用 元素周期表的结构及其应用 【解析】 W的简单氢化物可用作制冷剂,常见为氨气,则W为N元素,Y的原子半径是所有短周期主族元素中最大的,应为Na元素,由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生,黄色沉淀为S,则由X、Y和Z三种元素形成的一种盐为Na2S2O3,刺激性气体为SO2,则X为O元素,Z为S元素,结合对应单质、化合物的性质以及元素周期律的递变规律解答该题. 【解答】 解:W的简单氢化物可用作制冷剂,常见为氨气,则W为氮元素,Y的原子半径是所有短周期主族元素中最大的,应为钠元素,由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生,黄色沉淀为S,则由X、Y和Z三种元素形成的一种盐为Na2S2O3,刺激性气体为SO2,则X为氧元素,Z为硫元素。 A.非金属性O>N,元素的非金属性越强,对应的氢化物越稳定,故A正确; B.Y为钠元素,X为氧元素,钠对应的简单离子核外有10个电子,与O2−的核外电子排布相同,故B正确; C.Y与Z形成的化合物为Na2S,为强碱弱酸盐,水解呈碱性,则可使石蕊试液变蓝色,故C错误; D.Z为硫元素,与O同主族,与Na同周期,故D正确; 故选C。 6. 【答案】 C 【考点】 反应热和焓变 【解析】 此题暂无解析 【解答】 A.反应③中的反应物为CO2、H2,由反应可知,反应①、②为反应③提供原料气,故A正确; B.反应③中的反应物为CO2,转化为甲醇,则反应③也是 CO2资源化利用的方法之一,故B正确; C.由反应④可知,物质的量与热量成正比,且气态水的能量比液态水的能量高,则反应CH3OH(g)=12CH3OCH3 (g)+12H2O(l)的ΔH≠d2kJ⋅mol−1,故C错误; D.由盖斯定律可知,②×2+③×2+④得到2CO(g)+4H2 (g)=CH3OCH3 (g)+H2O(g),则ΔH=( 2b+2c+d ) kJ⋅mol−1,故D正确; 故选C。 7. 【答案】 C 【考点】 金属的电化学腐蚀与防护 【解析】 外加电流阴极保护是通过外加直流电源以及辅助阳极,被保护金属与电源的负极相连作为阴极,电子从电源负极流出,给被保护的金属补充大量的电子,使被保护金属整体处于电子过剩的状态,让被保护金属结构电位低于周围环境,从而使得金属腐蚀发生的电子迁移得到抑制,避免或减弱腐蚀的发生,阳极若是惰性电极,则是电解质溶液中的离子在阳极失电子,据此解答. 【解答】 A.被保护的钢管桩应作为阴极,从而使得金属腐蚀发生的电子迁移得到抑制,使钢管桩表面腐蚀电流接近于零,避免或减弱腐蚀的发生,故A正确; B.通电后,惰性高硅铸铁作阳极,海水中的氯离子等在阳极失电子发生氧化反应,电子经导线流向电源正极,再从电源负极流出经导线流向钢管桩,故B正确; C.高硅铸铁为惰性辅助阳极,所以高硅铸铁不损耗,故C错误; D.在保护过程中要使被保护金属结构电位低于周围环境,则通入的保护电流应该根据环境条件变化进行调整,故D正确; 故选C。 二、非选择题:包括必考题和选考题两部分.第8题-第10题为必考题每个试题考生都必须作答,第11题-第12题为选考题,考生根据要求作答. 【答案】 (1)增大反应物接触面积,加快反应速率,提高原料利用率 (2)2MnO2+4KOH+O2 ==== △2K2MnO4+2H2O (3)提高氧气的压强,加快反应速率,增加软锰矿转化率 (4)①KHCO3,②MnO42−−e−=MnO4−,H2,③3:2 (5)95.62% 【考点】 工艺流程分析及综合应用 电解池电极反应式 电解原理及其应用 化学反应速率的调控作用 制备实验方案的设计 氧化还原反应的计算 氧化还原反应 化学方程式的书写 【解析】 (1)固体混合粉碎目的是增大接触面积加快反应速率; (2)流程分析可知平炉中发生的反应是氢氧化钾、二氧化锰和氧气加热反应生成锰酸钾和水; (3)“平炉”中加压能提高氧气的压强,加快反应速率,增加软锰矿转化率; (4)①在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和碳酸氢钾; ②“电解法”为现代工艺,即电解K2MnO4水溶液,在电解槽中阳极,MnO42−失去电子,发生氧化反应,产生MnO4−;在阴极,水电离产生的H+获得电子变为氢气逸出,电极反应式是:2H2O+2e−=H2↑+2OH−; ③依据电解法方程式2K2MnO4+2H2O======通电2KMnO4+2H2↑+2KOH,可知K2MnO4的理论利用率是100%,而在二氧化碳歧化法反应中3K2MnO4+2CO2=2KMnO4+MnO2+K2CO3中K2MnO4的理论利用率是23; 第17页 共18页 ◎ 第18页 共18页 (5)依据离子方程式2MnO4−+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可知KMnO4与草酸反应的定量关系是2KMnO4∼5H2C2O4,配制溶液浓度为c=2×0.2×205×24.48mol/L,则1.0800g样品中含有KMnO4的物质的量n=1001000×2×0.2×205×24.48mol=0.006536mol,KMnO4的质量m=0.006536mol×158g/mol=1.03269g,纯度=实际量样品量×100%; 【解答】 解:(1)原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是增大接触面积加快反应速率,提高原料利用率. (2)流程分析可知平炉中发生的反应是氢氧化钾、二氧化锰和氧气加热反应生成锰酸钾和水,反应的化学方程式为:2MnO2+4KOH+O2 ==== △2K2MnO4+2H2O。 (3)“平炉”中加压能提高氧气的压强,加快反应速率,增加软锰矿转化率; (4)①在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2,二氧化碳在碱性溶液中生成碳酸氢钾,化学式为:KHCO3; ②“电解法”为现代工艺,即电解K2MnO4水溶液,在电解槽中阳极MnO42−失去电子,发生氧化反应,产生MnO4−,电极反应为MnO42−−e−=MnO4−;在阴极,水电离产生的H+获得电子变为氢气逸出,电极反应式是:2H2O+2e−=H2↑+2OH−; ③依据电解法化学方程式2K2MnO4+2H2O ==== 通电2KMnO4+H2↑+2KOH ,可知K2MnO4的理论利用率是100%,而在二氧化碳歧化法反应中3K2MnO4+4CO2+2H2O=2KMnO4+MnO2+4KHCO3 中K2MnO4的理论利用率是23,故“电解法”和“CO2歧化法”中,K2MnO4的理论利用率之比为3:2。 (5)依据离子方程式2MnO4−+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 可知KMnO4与草酸反应的定量关系是2KMnO4∼5H2C2O4, 配制溶液浓度为c=2×0.2×205×24.48mol/L, 1.0800g样品中含有KMnO4的物质的量n=1001000×2×0.2×205×24.48mol=0.006536mol, KMnO4的质量m=0.006536mol×158g/mol=1.03269g, 纯度=实际量样品量×100%即1.032688g1.0800g×100%=95.62%, 【答案】 (1)硫酸亚铁与KSCN不反应,硫酸亚铁易被空气氧化为硫酸铁 (2)①干燥管,②dabcfe,③76(m2−m3)9(m3−m1),偏小 (3)①c、a,产生白色沉淀、品红褪色,②2FeSO4 ==== 高温Fe2O3+SO2↑+SO3↑ 【考点】 物质制备实验和性质实验综合应用 探究铁离子和亚铁离子的转化 铁及其化合物的性质实验 化学方程式的书写 实验装置综合 【解析】 (1)亚铁离子不稳定,易被空气中氧气氧化生成铁离子; (2)①根据仪器的图形可判断仪器名称; ②实验时,为避免亚铁被氧化,应先通入氮气,冷却时注意关闭开关,防止氧气进入,冷却至室温再称量固体质量的变化; ③直至A恒重,记为m3 g,应为FeSO4和装置的质量,则m(FeSO4)=(m3−m1).m(H2O)=(m2−m3),以此计算n(H2O)、n(FeSO4),结晶水的数目等于n(H2O)n(FeSO4);若实验时按a、d次序操作,会导致硫酸亚铁被氧化; (3)硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,C为氯化钡,用于检验SO3,D为品红,可用于检验SO2. 【解答】 解:(1)滴加KSCN溶液,溶液颜色无明显变化,可知硫酸亚铁与KSCN不反应,但亚铁离子不稳定,易被空气中氧气氧化生成铁离子,最终溶液变红色; (2)①由仪器的图形可知B为干燥管; ②实验时,为避免亚铁离子被氧化,应先通入氮气,冷却时注意关闭开关,防止氧气进入,冷却至室温再称量固体质量的变化,则正确的顺序为dabcfe; ③直至A恒重,记为m3 g,应为FeSO4和装置的质量,则m(FeSO4)=(m3−m1)g。m(H2O)=(m2−m3)g,n(H2O)=m2−m318,n(FeSO4)=m3−m1152,结晶水的数目等于n(H2O)n(FeSO4)=76(m2−m3)9(m3−m1);若实验时按a、d次序操作,会导致硫酸亚铁被氧化,使固体质量偏大,则使x偏小; (3)①实验后反应管中残留固体为红色粉末,说明生成Fe2O3,则反应中Fe元素化合价升高,S元素化合价应降低,则一定生成SO2,可知硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,C为氯化钡,用于检验SO3,可观察到产生白色沉淀,D为品红,用于检验SO2,可观察到品红褪色; ②硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,化学方程式为:2FeSO4 ==== 高温Fe2O3+SO2↑+SO3↑。 【答案】 铁,NO3−+8e−+10H+=NH4++3H2O 因为铁表面生成不导电的FeO(OH),阻止反应进一步发生 Fe+2H+=Fe2++H2↑,初始pH较小,氢离子浓度高,产生的Fe2+浓度大,促使FeO(OH)转化为可导电的Fe3O4,使反应进行的更完全,初始pH高时,产生的Fe2+浓度小,从而造成NO3−去除率和铁的最终物质形态不同 【考点】 探究影响化学反应速率的因素 电极反应和电池反应方程式 pH的简单计算 【解析】 第17页 共18页 ◎ 第18页 共18页 (1)由图可知,Fe失去电子,N得到电子; (2)pH=4.5时,NO3−的去除率低,与铁表面生成不导电的FeO(OH)有关; (3)初始pH较小,氢离子浓度高,产生的Fe2+浓度大,促使FeO(OH)转化为可导电的Fe3O4,使反应进行的更完全,初始pH高时,产生的Fe2+浓度小。 【解答】 ①Fe是活泼的金属,根据还原水体中的NO3−的反应原理图可知,Fe被氧化作负极, 故答案为:铁; ②正极发生得到电子的还原反应,因此正极是硝酸根离子被还原为NH4+,为酸性电解质溶液,结合电荷及电子守恒可知电极反应式为NO3−+8e−+10H+=NH4++3H2O, 故答案为:NO3−+8e−+10H+=NH4++3H2O; 从pH对硝酸根去除率的影响来看,初始pH=4.5时去除率低,主要是因为铁离子容易水解生成FeO(OH),同时生成的Fe3O4产率降低,且生成的FeO(OH)不导电,所以NO3−的去除率低, 故答案为:因为铁表面生成不导电的FeO(OH),阻止反应进一步发生; 由表中信息可知(2)中初始pH不同时,NO3−去除率和铁的最终物质形态不同的原因为Fe+2H+=Fe2++H2↑,初始pH较小,氢离子浓度高,产生的Fe2+浓度大,促使FeO(OH)转化为可导电的Fe3O4,使反应进行的更完全;初始pH高时,由于Fe3+的水解,Fe3+越容易生成FeO(OH),产生的Fe2+浓度小,从而造成NO3−去除率和铁的最终物质形态不同, 故答案为:Fe+2H+=Fe2++H2↑,初始pH较小,氢离子浓度高,产生的Fe2+浓度大,促使FeO(OH)转化为可导电的Fe3O4,使反应进行的更完全,初始pH高时,产生的Fe2+浓度小,从而造成NO3−去除率和铁的最终物质形态不同。 (二)选考题:共15分。请考生从给出的题中每科任选一题作答,并用2B铅笔在答题卡上把所选题目的题号涂黑。注意所做题目的题号必须与所涂题目的题号一致,在答题卡选答区域指定位置答题。如果多做,则每学科按所做的第一小题计分。【化学—选修3:物质结构与性质】(15分) 【答案】 (1) A (2) N,球形,K的原子半径较大,且价电子较少,金属键较弱 (3) V形,sp3 (4) 0.315,12 (5) 体心,棱心 【考点】 物质结构与性质综合应用 晶胞和非晶胞 晶胞的计算 原子轨道杂化方式及杂化类型判断 原子结构与元素的性质 原子核外电子排布 同周期元素性质的递变规律 【解析】 (1)紫色波长介于400nm∼435nm之间; (2)基态K原子核外有4个电子层,最高能层为第四层,最外层电子为4s1电子,K和Cr属于同一周期,K的原子半径较大,且价电子较少,金属键较弱; (3)I3+中心原子的价层电子对数为7+1×2−12=4,则为sp3杂化,价层电子对为正四面体,中心I原子的孤电子对数为7−1×2−12=2,为V形; (4)K与O间的最短距离为面对角线的一半;O位于面心,K位于顶点,1个顶点为12个面共有; (5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,个数为8×18=1,则K也为1,应位于体心,则O位于棱心,个数为12×14=3。 【解答】 解:(1)紫色波长介于400nm∼435nm之间,只有A符合,故答案为:A。 (2)基态K原子核外有4个电子层,核外电子排布为:1s22s22p63s23p64s1,最高能层为第四层,即N层;最外层电子为4s1电子,该能层电子的电子云轮廓图形状为球形;K和Cr属于同一周期,K的原子半径较大,且价电子较少,金属键较弱,则金属K的熔点、沸点等都比金属Cr低,故答案为:N; 球形;K的原子半径较大,且价电子较少,金属键较弱。 (3)I3+中心原子的价层电子对数为7+1×2−12=4,则为sp3杂化,中心I原子的孤电子对数为7−1×2−12=2,为V形,故答案为:V形;sp3。 (4)K与O间的最短距离为面对角线的一半,则K与O间的最短距离为22×0.446nm≈0.315nm,与K紧邻的O在以K为顶点的正方形的面心,一个晶胞中距离顶点K最近的有3个O,顶点处的K被8个晶胞共有,面心O被2个晶胞共有,所以与K紧邻的O个数为3×8×12=12,故答案为:0.315;12。 (5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,个数为8×18=1,则K也为1个,应位于体心,则O位于棱心,每个棱为4个晶胞共有,则O个数为12×14=3,故答案为:体心;棱心。 【化学-选修5:有机化学基础】(15分) 【答案】 (1) (2)2−丙醇 (3) (4)取代反应 (5)C18H31NO4 第17页 共18页 ◎ 第18页 共18页 (6)6,, 【考点】 有机化学基础综合应用 同分异构现象和同分异构体 结构简式 有机物的合成 有机化合物命名 有关有机物分子式确定的计算 取代反应与加成反应 【解析】 A的化学式为C2H4O,其核磁共振氢谱为单峰,则A为;B的化学C3H8O,核磁共振氢谱为三组峰,峰面积比为6:1:1,则B的结构简式为CH3CH(OH)CH3;D的化学式为C7H8O2,其苯环上仅有两种不同化学环境的氢,1 mol D可与1 mol NaOH或2 mol Na反应,则苯环上有酚羟基和−CH2OH,且为对位结构,则D的结构简式为,E应为,以此解答该题. 【解答】 解:A的化学式为C2H4O,其核磁共振氢谱为单峰,则A为;B的化学C3H8O,核磁共振氢谱为三组峰,峰面积比为6:1:1,则B的结构简式为CH3CH(OH)CH3;D的化学式为C7H8O2,其苯环上仅有两种不同化学环境的氢,1 mol D可与1 mol NaOH或2 mol Na反应,则苯环上有酚羟基和−CH2OH,且为对位结构,则D的结构简式为,E应为,据此回答问题; (1)由以上分析可知A的结构简式为; (2)B的结构简式为CH3CH(OH)CH3,其化学名称为2−丙醇; (3)D为,对比E的分子式可知,C和D发生取代反应生成E,发生反应生成E的化学方程式为; (4)对比E和F的分子式可知由E生成F的反应类型为取代反应,生成F的同时生成HCl; (5)由结构简式可知有机物G的分子式为C18H31NO4; (6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1 mol的L可与2 mol的Na2CO3反应,说明L的分子结构中含有2个酚羟基和一个甲基,当二个酚羟基在邻位时,苯环上甲基的位置有2种,当二个酚羟基在间位时,苯环上甲基的位置有3种,当二个酚羟基在对位时,苯环上甲基的位置有1种,则满足条件的L共有6种,其中核磁共振氢谱为四组峰,峰面积比为3:2:2:1的结构简式为或。 第17页 共18页 ◎ 第18页 共18页查看更多