- 2021-07-08 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习硅及其化合物学案
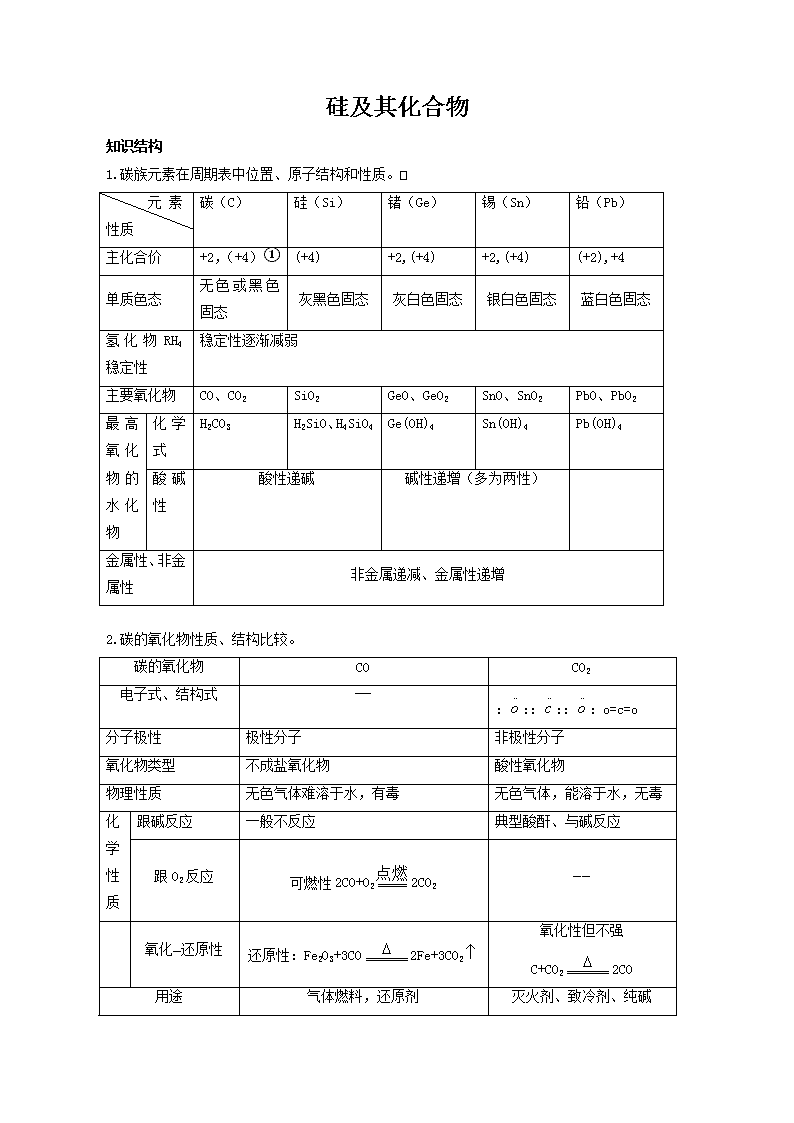
硅及其化合物 知识结构 1.碳族元素在周期表中位置、原子结构和性质。 元 素 性质 碳(C) 硅(Si) 锗(Ge) 锡(Sn) 铅(Pb) 主化合价 +2,(+4)① (+4) +2,(+4) +2,(+4) (+2),+4 单质色态 无色或黑色固态 灰黑色固态 灰白色固态 银白色固态 蓝白色固态 氢化物RH4稳定性 稳定性逐渐减弱 主要氧化物 CO、CO2 SiO2 GeO、GeO2 SnO、SnO2 PbO、PbO2 最高氧化物的水化物 化学式 H2CO3 H2SiO、H4SiO4 Ge(OH)4 Sn(OH)4 Pb(OH)4 酸碱性 酸性递碱 碱性递增(多为两性) 金属性、非金属性 非金属递减、金属性递增 2.碳的氧化物性质、结构比较。 碳的氧化物 CO CO2 电子式、结构式 —— ::::::o=c=o 分子极性 极性分子 非极性分子 氧化物类型 不成盐氧化物 酸性氧化物 物理性质 无色气体难溶于水,有毒 无色气体,能溶于水,无毒 化 学 性 质 跟碱反应 一般不反应 典型酸酐、与碱反应 跟O2反应 可燃性2CO+O22CO2 —— 氧化—还原性 还原性:Fe2O3+3CO2Fe+3CO2 氧化性但不强 C+CO22CO 用途 气体燃料,还原剂 灭火剂、致冷剂、纯碱 三、知识点、能力点提示 1.碳族元素的特点 1)碳族元素处于元素周期表的中间位置,获电子或失电子能力都较差,常温下,化学性质都不活泼。 2)碳族元素重要性质: ①化合价。在化合物中除硅表现+4价外,其余表现+2价和+4价。在与氢 形成化合物中,碳和硅表现-4价。②C、Si、Ge、Sn、Pb随核电荷数增加,原子半径逐渐增 大 ,非金属性逐渐减弱,金属性逐渐增强,其变化趋势比氮族元素更为明显。锗的金属性明显 地强于非金属性。③最高价氧化物的水化物的酸碱性随元素核电荷增加酸性减弱,碱性增强 。④气态氢化物的稳定性,随元素核电荷增加而逐渐减弱。⑤碳族元素正4价化合物比正二 价化合物稳定,但铅的正二价化合物比较稳定,如PbSO4. 2.硅和硅的化合物 1)组成和结构。 ①硅的单质构成的晶体属于原子晶体,具有正四面体空间网状结构。与金钢石比较,性质相 似,又有差异。 ②SiO2晶体是由硅原子和氧原子按1∶2比率组成,属于原子晶体。具有立体网状结构。 2)重要性质 物理性质 ①Si、SiO2、H2SiO3、H4SiO4均难溶于水。 ②Si、Ge是良好的半导体。 化学性质 硅的重要反应: ①Si+2F2SiF4↑ ②Si+O2SiO2 二氧化硅的重要反应: ①SiO2+2CSi+2CO(制粗硅) [SiCl4+2H2Si+4HCl](制纯硅) ②SiO2+CaOCaSiO3 ③SiO2+CaCO3CaSiO3+CO2 (除脉石造渣) ④SiO2+2NaOHNa2SiO3+H2O(腐蚀玻璃) ⑤SiO2+4HFSiF4↑+2H2O(刻画玻璃) ⑥SiO2+3CSiC+2CO↑(制金钢砂) 硅酸、硅酸钠的重要反应 Na2SiO3+2HClH2SiO3↓+2NaCl Na2SiO3+CO2+H2OH2SiO3↓+Na2CO3 H2SiO3SiO2+H2O 3.硅酸盐工业 ①硅酸盐工业概念; ②制水泥的重要原料; ③制玻璃主要原料、主要反应,玻璃种类及用途。 4.硅和硅的化合物的转变关系。 5.硅及其重要化合物间的转化关系。查看更多