- 2021-07-08 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高三化学每天一练
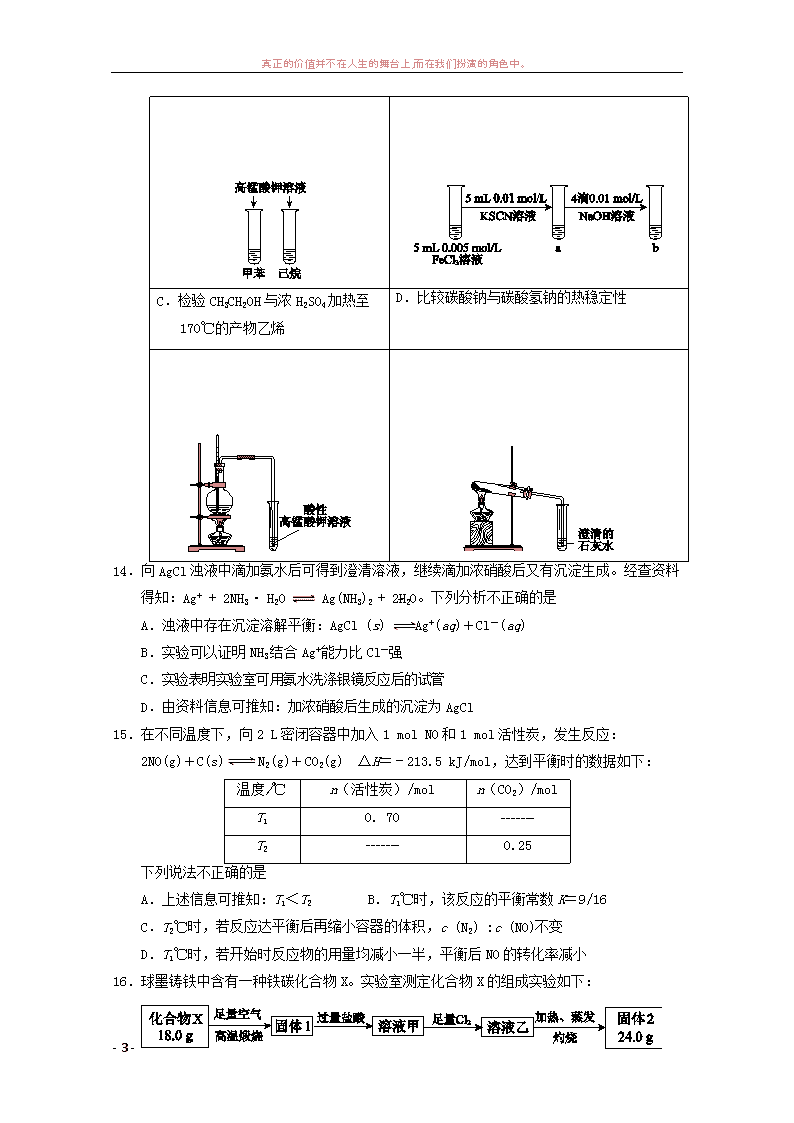
真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 1 - 练习 3 一.选择题(每小题只有 1 个选项符合题意。) 1.下列叙述中不正确...的是 A.SO2 是大气污染物之一 B.食物腐败变质发生了化学变化 C.凡含有添加剂的食物对人体健康均有害,不宜食用 D.废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源 2.下列有关物质水解的说法正确的是 A.纤维素不能水解成葡萄糖 B.油脂水解产物之一是甘油 C.蛋白质水解的最终产物是多肽 D.蔗糖水解产物仅有葡萄糖 3.下列有关化学用语表示正确的是 A.氮气的电子式: B.羟基的电子式: C.氯离子的结构示意图: D.质子数为 92、中子数为 146 的铀(U)原子的核素符号: 4.下列物质的水溶液:①NaOH、②CH3COOH、③NH3、④NaHCO3、⑤Cl2,不能..溶解 CaCO3 的是 A.①③④ B.①④⑤ C.②④ D.②⑤ 5.下列有关钢铁腐蚀与防护的说法不正确...的是 A.生铁比纯铁容易生锈 B.钢铁的腐蚀生成疏松氧化膜,不能保护内层金属 C.钢铁发生吸氧腐蚀时,正极反应式为:O2+2H2O+4e-== 4OH- D.为保护地下钢管不受腐蚀,可使其与直流电源正极相连 6. 下列应用不涉及...氧化还原反应的是 A.铝热法冶炼难熔金属 B.工业上电解熔融状态 Al2O3 制备 Al C.Na2O2 用作呼吸面具的供氧剂 D.实验室用 NH4Cl 和 Ca(OH)2 制备 NH3 7.化学与社会密不可分,利用化学反应可实现物质转化和能量转化,下列说法不正确...的是 A.播撒碳酸钙粉末可治理被酸雨污染的湖泊 B.火力发电是将化学能直接转化为电能 C.维生素 C 具有还原性,可消除体内具有强氧化性的物质 D.过量服用阿司匹林引起酸中毒,可静脉注射 NaHCO3 溶液解毒 8.NA 表示阿伏加德罗常数的值,下列说法正确的是 A.0.1 mol 甲烷含有的电子数为 NA B.1 L 0.1 mol/L Na2CO3 溶液中含有的 CO3 数目为 0.1 NA 146 92U -2 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 2 - C.1 L pH=1 的硫酸溶液中含有的 H+ 数为 0.2 NA D.标准状况下,2.24 L CO 和 CO2 混合气体中含有的氧原子数为 0.15NA 9.已知 34Se、35Br 位于同一周期,根据元素在周期表中的位置,判断下列说法正确的是 A.离子还原性:Cl->Br- B.气态氢化物的稳定性:H2S>H2Se C.原子半径:Cl>Br>Se D.酸性:H2SeO4>HBrO4>HClO4 10.芥子醇是合成工程纤维的单体,结构简式如图。下列有关芥子醇的说法不正确...的是 A.分子式为 C11H14O4 B.存在顺反异构现象 C.能发生水解反应 D.能与溴水反应 11.能正确表示下列反应的离子方程式是 A.铝放入烧碱溶液中溶解:Al+2OH- = AlO2 +H2↑ B.碳酸钙溶于醋酸溶液:CaCO3+2H+ = Ca2++CO2↑+H2O C.稀硫酸中加氢氧化钡溶液至中性:H+ + OH- = H2O D.氯化铁溶液呈酸性:Fe3+ + 3H2O Fe(OH)3 +3H+ 12. 分别依据下列实验事实,得出的结论正确的是 实验事实 结论 A 苯酚和水的浊液中,加碳酸钠溶液,溶液变澄清 苯酚的酸性比碳酸强 B 将“84”消毒液(含 NaClO)滴入品红溶液中,褪色 缓慢,若同时加入食醋,红色很快褪为无色 随溶液 pH 减小,“84” 消毒液的氧化能力增强 C 铜放入稀硫酸中,无明显现象,再加入硝酸钠固体, 溶液变蓝,有明显的气泡放出,铜溶解 硝酸钠可以加快铜与稀 硫酸的反应速率 D 向 2 mL 0.1 mol/L 的硝酸银溶液中加入 1 mL0.1 mol/L NaCl 溶液,出现白色沉淀,再加入几滴 0.1 mol/L Na2S 溶液,有黑色沉淀生成 氯化银的溶解度大于硫 化银 13.下列图示的实验操作,不能..实现相应实验目的的是 A.鉴别甲苯与己烷 B.研究浓度对 Fe3++3SCN- Fe(SCN)3 的影响 - 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 3 - C.检验 CH3CH2OH 与浓 H2SO4 加热至 170℃的产物乙烯 D.比较碳酸钠与碳酸氢钠的热稳定性 14.向 AgCl 浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料 得知:Ag+ + 2NH3· H2O Ag(NH3)2 + 2H2O。下列分析不正确...的是 A.浊液中存在沉淀溶解平衡:AgCl (s) Ag+(aq)+Cl-(aq) B.实验可以证明 NH3 结合 Ag+能力比 Cl-强 C.实验表明实验室可用氨水洗涤银镜反应后的试管 D.由资料信息可推知:加浓硝酸后生成的沉淀为 AgCl 15.在不同温度下,向 2 L 密闭容器中加入 1 mol NO 和 1 mol 活性炭,发生反应: 2NO(g)+C(s) N2(g)+CO2(g) ΔH=﹣213.5 kJ/mol,达到平衡时的数据如下: 温度/℃ n(活性炭)/mol n(CO2)/mol T1 0. 70 _______ T2 _______ 0.25 下列说法不正确...的是 A.上述信息可推知:T1<T2 B.T1℃时,该反应的平衡常数 K=9/16 C.T2℃时,若反应达平衡后再缩小容器的体积,c (N2) :c (NO)不变 D.T1℃时,若开始时反应物的用量均减小一半,平衡后 NO 的转化率减小 16.球墨铸铁中含有一种铁碳化合物 X。实验室测定化合物 X 的组成实验如下: + 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 4 - 下列说法不正确...的是 A.固体 2 是氧化铁 B.X 的化学式可以表示为 Fe3C2 C.溶液甲中可能含有 Fe3+ D.X 与足量的热浓硝酸反应有 NO2 和 CO2 生成 二,填空题 17.(共 6 分)金属 Na 、Mg、 Al 有广泛的应用。 (1)周期表中 Na、Mg、Al 所在周期是 。 (2)为比较 Na、Mg、Al 的金属性,进行了如下实验: 实验 1:各取 1.0 g 金属钠和镁,分别加入到 5 mL 水中,钠与水反应剧烈,镁与水反应 缓慢。 实验 2:各取 1.0 g 的镁条和铝条,分别加入到 5 mL 1.0 mol/L 盐酸中,镁与盐酸反应 剧烈,铝与盐酸反应较剧烈。 已知:元素金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度来判断。 由实验 1 和实验 2 得出的结论是 ,用原 子 结 构 理 论 解 释 : 同 周 期 元 素 从 左 到 右, 。 (3)Na、Mg、Al 都可以用于制备储氢的金属氢化物。 ① NaH 是离子化合物,能与水发生氧化还原反应生成 H2,该反应的还原剂是 。 ② NaAlH4 是 一 种 良 好 的 储 氢 材 料 。 NaAlH4 与 水 反 应 的 化 学 方 程 式 是 。 18.(共 6 分)现有下列浓度均为 0.1 mol/L 的电解质溶液: ① Na2CO3、② NaHCO3、③ 、④ CH3COONH4、⑤ NH4HCO3 (1)上述 5 种物质的溶液既能与盐酸又能与烧碱溶液反应的是(填写序 号) 。 ( 2 ) 已 知 溶 液 ④ 呈 中 性 , 该 溶 液 中 离 子 浓 度 由 大 到 小 的 顺 序 是 。 ( 3 ) 已 知 溶 液 ⑤ 呈 碱 性 , 比 较 ④ 、 ⑤ 两 溶 液 的 酸 碱 性 , 可 以 得 出 的 结 论 是 。 19.(10 分)自然界中氮元素有多种存在形式。 ( 1 ) 合 成 氨 反 应 的 化 学 方 程 式 是 。 (2)NH3 在一定条件下可被氧化。 已知:ⅰ.4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH=﹣1269 kJ/mol 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 5 - ⅱ. 1 断开 1 mol H-O 键与断开 1 mol H-N 键所需能量相差约 kJ; ② H-O 键比 H-N 键(填“强”或“弱”)______。 2 图中 b 点,U(正)______ U(逆)。(填“>”、“=”或“<”) ② 图中 a 点,容器内气体 n(N2):n(NH3)= 。 ( 4 ) 水 中 的 氨 在 微 生 物 作 用 下 可 被 氧 化 为 亚 硝 酸 , 其 化 学 方 程 式 是 。 ( 5 ) 电 解 法 能 将 碱 性 溶 液 中 的 NO2 转 化 为 N2 而 除 去 , 其 电 极 反 应 式 是 。 20.(10 分)某厂以重晶石(有效成分是 BaSO4)为主要原料制取 Ba(OH)2·8H2O 晶体的示意图 如下: 已知:i.BaSO4(s)+2C(s)=2CO2(g)+BaS(s) ΔH1=+226.2 kJ/mol C(s)+CO2(g)=2CO(g) ΔH2=+172.5kJ/mol ii.某些物质的溶解度(g/100g)简表 回答下列问题: (1)炭与重晶石直接反应的热化学方程式是:BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH= 10℃ 20℃ 40℃ 60℃ 80℃ Ba(OH)2·8H2O 2.48 3.89 8.22 20.9 101 NaOH 98.0 109 129 174 314 NaCl 35.8 35.9 36.4 37.1 38.0 BaCl2 33.5 35.8 40.8 46.2 52.5 - (3)右图是某压强下, N2 与 H2 按体积 比 1: 3 投料时,反应混合物中氨的 体积分数随温度的变化曲线。其中 一条是经过一定时间反应后的曲 线,另一条是平衡时的曲线。 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 6 - kJ/mol。 (2)由 BaCl2 溶液可通过不同途径得到 Ba(OH)2·8H2O。 途径 1: 1 得到固体 1 的离子方程式是 。 ② 固 体 2 与 水 反 应 的 化 学 方 程 式 是 。 途径 2: 途径 2 中的“操作”是加热浓缩,冷却结晶,过滤。依据上述溶解度简表分析,过滤时 的 最 佳 温 度 是 ______ ; 能 从 混 合 液 中 得 到 Ba(OH)2·8H2O 晶 体 的 原 因 是 。 (3)若向滤液 1 中加入 CuO 粉末,可直接得到含 Ba(OH)2·8H2O 晶体和 CuS 的浊液,反应化 学方程式是__ ___。将该浊液加热到 80℃左右浓缩,趁热过滤,冷 却滤液至室温,再过滤,即可得到 Ba(OH)2·8H2O 晶体。上述操作中趁热..过滤的原因 是 。 21.(10 分)某中药主要含二硫化亚铁(FeS2),某学习小组欲用下图所示装置进行实验,测 定其铁、硫元素的质量分数。 (1)装置中,A 为高温灼烧装置,B 为气体吸收装置,C 为检测尾气中是否含有SO2 的传感器。 取 m g 该中药样品于装置 A 中,经充分反应,使硫元素全部转化为 SO2 和 SO3,在 B 中得 到白色沉淀,传感器(装置 C)未检测到 SO2。 ① 装置 B 中的 H2O2 反应时表现出了 性。 ② 欲 计 算 硫 元 素 的 质 量 分 数 , 需 测 量 的 数 据 是 。 样品 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 7 - ③ 传感器的工作原理如下图所示。 传 感 器 中 阴 极 的 电 极 反 应 式 是 。 (2)为测定铁元素的质量分数,继续实验。 a.将 A 装置中的剩余固体用足量盐酸酸浸,有少量 H2 产生。充分反应后过滤, 得到黄色滤液; b.向滤液中滴加 TiCl3 溶液,至恰好完全反应,TiCl3 被氧化为 TiO2+; c.用滴定法测定 Fe2+的量,消耗 v mL n mol/LK2Cr2O7 溶液。 ① a 中滤液含有的金属阳离子是 。 ② b 中反应的离子方程式是 。 ③ c 中 K2Cr2O7 被 还 原 为 Cr3+ , 样 品 中 铁 元 素 质 量 分 数 的 数 学 表 示 式 是 。 22.(16 分)华法林是一种治疗心脑血管疾病的药物,其合成路径如下 (部分反应条件略去)。 已知: 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 8 - (1)A 属于芳香烃,名称是 。 ( 2 ) B→C 的 化 学 方 程 式 是 。 (3)D 的含氧官能团名称是 。 (4)E 的结构简式是 ( 5 ) F→K 的 化 学 方 程 式 是 。 (6)由 E 与 N 合成华法林的反应类型是 _。 (7)下列说法正确的是 。 a.M 与 N 互为同分异构体 b.将 L 与足量的 NaOH 溶液反应,1 mol L 消耗 4 mol NaOH c. E 最多可与 5 mol 氢气加成 d.B 可以发生消去反应 (8)L→M 的转化中,会产生少量链状高分子聚合物,该反应的化学方程式是 。 第Ⅰ卷(选择题 共 42 分) 1~6 小题,每小题 2 分;7~16 小题,每小题 3 分。 题号 1 2 3 4 5 6 7 8 答案 C B C A D D B A 题号 9 10 11 12 13 14 15 16 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 9 - 答案 B C D B C C D B 第Ⅱ卷(非选择题 共 58 分) 说明:其他合理答案均可参照本标准给分。 17.(共 6 分) (1)第三周期(1分) (2)金属性 Na>Mg>Al (1分) 原子半径..逐渐减小..,失.电子能力逐渐减弱..(1分,答出关键字得分) (3)①NaH(1分) ②NaAlH4+2H2O=NaAlO2+4H2↑(2 分,反应物和生成物、配平各 1 分) 18.(共 6 分) (1)②④⑤(2 分) (2) c(CH3COO-)= c(NH4 +)> c(H+)= c(OH-)(2 分,准确表述出各种离子浓度关系得分) (3)HCO3 -的水解程度比 CH3COO-大或 CH3COOH 酸性比 H2CO3 强 (2 分,答对两点中任意一点可得分) 19.(共 10 分) (1)N2+ 3H2 2NH3(2 分,有错不得分) (2)① 72.6 (1 分) ② 强(1 分) (3)① > (1 分) ② 1∶4(2 分) (4)2NH3 + 3O2 === 2HNO2 + 2H2O(1 分,有错不得分) (5)2NO2 -+ 6e- + 4H2O =N2↑+8OH-(2 分,气体符号错不扣分,其他有错不得分) 20.(共 10 分) (1)+571.2 (2 分) (2)途径 1:① CO3 2-+Ba2+ =BaCO3↓(1 分) ② BaO+9H2O=Ba(OH)2·8H2O(1 分) 途径 2:20℃或常温(2 分,答其他温度不得分) 20℃时 4 种物质中 Ba(OH)......2.·.8H..2.O.溶解度最小..... (1 分,答常温得分,不答温度不得分) (3)BaS+CuO+9H2O=Ba(OH)2·8H2O+CuS(2 分,反应物生成物和配平各 1 分) 为减少过滤过程中 Ba(OH)2·8H2O 的损失(1 分) 21.(共 10 分) (1)① 氧化性(2 分) ② B 中沉淀的质量(1 分,其他答案不得分) ③ 2HSO3 -+2H++2e-= S2O4 2-+2H2O(2 分,有错不得分) 微生物 高温高压 催化剂 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 10 - (2)① Fe3+、Fe2+(2 分,各 1 分,有错不得分) ② Fe3+ + Ti3+ +H2O= Fe2++TiO2+ +2H+(2 分,有错不得分) ③ (1 分) 22.(共 16 分) (1)甲苯(2 分) (2) (2 分) (3)醛基(2 分) (4) (2 分) (5) (2 分,条件和可逆号 1 分,反应物生成物 1 分) (6)加成反应(2 分) (7)ac(2 分,有错不得分) (8) (2 分,计量数、条件错扣 1 分,反应物生成物错不得分)查看更多