- 2021-07-08 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版物质的制备作业
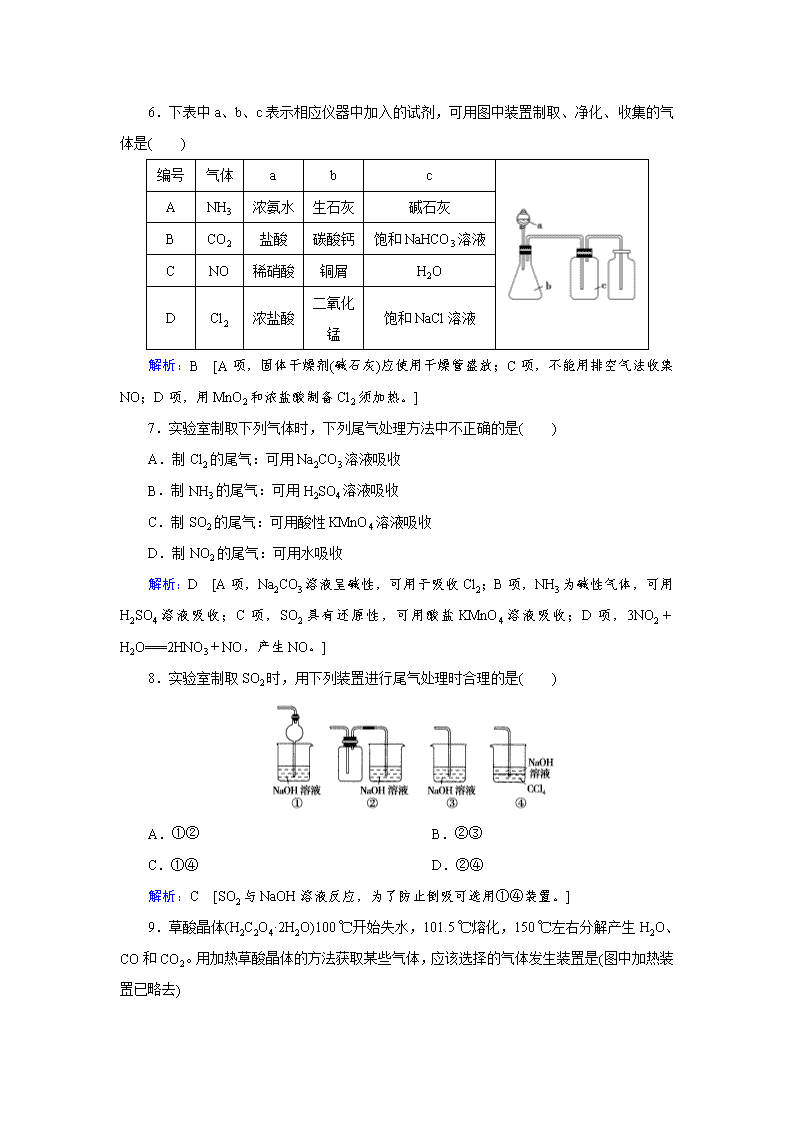
物质的制备 1.实验室对制备气体反应的基本要求是:反应条件易满足、能平稳地产生气流、所得气体中尽可能不含杂质成分(除少量水蒸气及少量原料汽化形成的物质)。下列反应一般能用于实验室制备气体的是( ) A.Na2O2与CO2反应制备O2 B.H2O2与MnO2混合制备O2 C.加热浓硝酸制备NO2 D.浓NaOH溶液与NH4Cl溶液混合加热制备NH3 解析:B [A项,制备的O2中易混入CO2杂质;C项,4HNO3(浓)4NO2↑+O2↑+2H2O,即NO2中易混入O2;D项,应使用Ca(OH)2和NH4Cl制备NH3。] 2.下列制备NH3的发生装置不正确的是( ) 解析:C [用Ca(OH)2和NH4Cl固体制备NH3时,试管口应略向下倾斜,防止生成的水倒流至试管底引起试管炸裂。] 3.用KMnO4和浓盐酸可制备Cl2:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。下列装置可用于上述反应制备Cl2的是( ) 解析:C [由题给反应及化学方程式,可排除A、D两项;KMnO4为粉末状固体,故不能选用B装置。] 4.下列制备和收集气体的实验装置合理的是( ) 解析:D [A中加热的试管管口应略向下倾斜;B中NO很容易被空气中的氧气氧化,不能用排空气法收集;C中氢气的密度比空气小,所以集气瓶中的进气导管应比出气导管短。] 5.下列有关气体的除杂或收集方法,说法合理的是( ) A.要除去NO中混有的NO2,可以将混合气体先通过足量水,然后用CaCl2干燥 B.CO2中混有的CO气体可用点燃法除去 C.除去H2S中混有的水蒸气,用浓硫酸干燥即可 D.如图装置只能用来收集CO2,不能收集H2、NH3等 解析:A [A项,NO中混有NO2时,先通过足量水,NO2与水发生反应得到稀硝酸和NO,然后通过CaCl2干燥即可得到纯净的NO,正确。B项,由于CO2不支持燃烧,无法用点燃法除去CO2中混有的CO,可将混合气体通过灼热的CuO,利用CO的还原性将CO除去,错误。C 项,H2S具有还原性,能被浓硫酸氧化,错误。D项,用图示装置收集气体时,从a端进气可收集CO2等密度比空气大的气体,从b端进气可收集H2、NH3等密度比空气小的气体,错误。] 6.下表中a、b、c表示相应仪器中加入的试剂,可用图中装置制取、净化、收集的气体是( ) 编号 气体 a b c A NH3 浓氨水 生石灰 碱石灰 B CO2 盐酸 碳酸钙 饱和NaHCO3溶液 C NO 稀硝酸 铜屑 H2O D Cl2 浓盐酸 二氧化锰 饱和NaCl溶液 解析:B [A项,固体干燥剂(碱石灰)应使用干燥管盛放;C项,不能用排空气法收集NO;D项,用MnO2和浓盐酸制备Cl2须加热。] 7.实验室制取下列气体时,下列尾气处理方法中不正确的是( ) A.制Cl2的尾气:可用Na2CO3溶液吸收 B.制NH3的尾气:可用H2SO4溶液吸收 C.制SO2的尾气:可用酸性KMnO4溶液吸收 D.制NO2的尾气:可用水吸收 解析:D [A项,Na2CO3溶液呈碱性,可用于吸收Cl2;B项,NH3为碱性气体,可用H2SO4溶液吸收;C项,SO2具有还原性,可用酸盐KMnO4溶液吸收;D项,3NO2+H2O===2HNO3+NO,产生NO。] 8.实验室制取SO2时,用下列装置进行尾气处理时合理的是( ) A.①② B.②③ C.①④ D.②④ 解析:C [SO2与NaOH溶液反应,为了防止倒吸可选用①④装置。] 9.草酸晶体(H2C2O4·2H2O)100 ℃开始失水,101.5 ℃熔化,150 ℃左右分解产生H2O、CO和CO2。用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去) 解析:D [草酸晶体加热过程中有水生成,不能采用A、B,否则生成的水冷凝后会使仪器破裂;因草酸晶体在101.5 ℃熔化,而150 ℃才分解,使用C装置会使液态草酸流出,不合适,D装置符合题意。] 10.(1)下表是实验室制备气体的有关内容,根据表中所列实验原理,从下列装置中选择合适的发生装置,将其编号填入下表的空格中。 编号 实验内容 实验原理 发生装置 ① 制氧气 H2O2→O2 ② 制氨气 NH4Cl→NH3 ③ 制氯气 HCl→Cl2 (2)上述实验中,从制备过程看,必须选择合适的氧化剂才能实现的是 ________ (填气体的化学式,下同);从反应中有无电子转移的角度看,明显不同于其他气体的是_______,写出实验室制取该气体的化学方程式:___________________________________________ ________________________________________________________________________。 (3)制备Cl2需用8 mol·L-1的盐酸100 mL,现用12 mol·L-1的盐酸来配制: ①需要12 mol·L-1的盐酸的体积为 ________ mL(精确到0.1 mL)。 ②在容量瓶的使用中,下列操作不正确的是 ________ (填写标号)。 A.使用容量瓶前检查它是否漏水 B.容量瓶用蒸馏水洗净后,再用待配溶液润洗 C.配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到距刻度线1~2 cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和刻度线相平 D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底, 把容量瓶倒转和摇动多次 解析:(1)用H2O2制取O2时采用MnO2作催化剂,故应用固+液―→气装置;用NH4Cl固体和Ca(OH)2固体制取NH3,应用固+固气装置;制取Cl2时用浓盐酸和MnO2固体在加热条件下反应,应用固+液气装置。(3)②容量瓶使用前需要检漏,A项正确;容量瓶洗净后不需要润洗,否则会引起误差,故B项错误;配制溶液时,应先将浓盐酸在烧杯内稀释并冷却至室温后再转移至容量瓶中,故C项错误;定容后需将容量瓶翻转摇匀,故D项正确。 答案:(1)①C ②B ③A (2)Cl2 NH3 Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O (3)①66.7 ②B、C 11.工业上,向500~600 ℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行实验。 回答下列问题: (1)制取无水氯化铁的实验中,A中反应的化学方程式为_________________________, 装置B中加入的试剂是_____________________________________________。 (2)制取无水氯化亚铁的实验中,装置A用来制取 ________ 。尾气的成分是 _______。若仍用D装置进行尾气处理,存在的问题是_______ 、 ________________ 。 (3)若操作不当,制得的FeCl2会含有少量FeCl3,检验FeCl3常用的试剂是 ________ 。欲制得纯净的FeCl2,在实验操作中应先_______________________________________, 再________________________________________________________________________。 解析:(1)根据装置示意图,制取无水氯化亚铁的实验中,装置A为制取氯气的实验装置,发生反应为二氧化锰与浓盐酸反应生成氯化锰、氯气和水;装置B的作用是除去混杂在氯气中的水蒸气,故B中加入的试剂为浓硫酸。(2)根据题给信息,在制取无水氯化亚铁实验中,装置A是用于制取HCl气体;经浓H2SO4 干燥后,在硬质玻璃管中发生反应:Fe+2HCl===FeCl2+H2,则尾气的成分是氯化氢和氢气;若仍用D装置进行尾气处理,则因氯化氢极易溶于水,故会产生倒吸,且氢气与NaOH溶液不反应,可燃性气体氢气也不能被吸收。(3)检验氯化铁溶液常用的试剂是KSCN溶液;欲制得纯净的氯化亚铁,应防止装置中氧气的干扰,在实验过程中应先点燃A处的酒精灯,利用产生的氯化氢气体排出装置中的空气,再点燃C处的酒精灯。 答案:(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 浓硫酸 (2)HCl HCl和H2 发生倒吸 没有处理氢气 (3)KSCN溶液 点燃A处的酒精灯(赶尽装置内的空气) 点燃C处的酒精灯 12.在梨、香蕉等水果中存在着乙酸正丁酯。实验室制备乙酸正丁酯的反应、装置示意图和有关数据如下: CH3COOH+CH3CH2CH2CH2OH CH3COOCH2CH2CH2CH3+H2O 水中溶解性 密度(g·cm-3) 沸点 相对分子质量 乙酸 溶于水 1.049 2 118 60 正丁醇 微溶于水 0.809 8 117.7 74 乙酸正丁酯 微溶于水 0.882 4 126.5 116 实验步骤: Ⅰ.乙酸正丁酯的制备 在A中加入7.4 g正丁醇、6.0 g乙酸,再加入数滴浓硫酸,摇匀,放入1~2颗沸石。按图安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口,通入冷凝水,缓慢加热A。在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高度不变,使油层尽量回到圆底烧瓶中。反应达到终点后,停止加热,记录分出水的体积。 Ⅱ.产品的精制 把分水器中的酯层和A中反应液倒入分液漏斗中,分别用少量水、饱和碳酸钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置后过滤,将产物常压蒸馏,收集124~126 ℃的馏分,得到5.8 g产品。请回答下列问题: (1)冷水应从冷凝管的 ________ (填“a”或“b”)口通入。 (2)产品的精制过程中,第一次水洗的目的是 ________________ ,第二次水洗的目的是 ________________ ,洗涤完成后将有机层从分液漏斗的 ________ (填“上口”或“下口”)转移到锥形瓶中。 (3)本实验提高产品产率的方法是_________________________________________ ________________________________________________________________________。 (4)判断反应终点的依据是______________________________________________。 (5)该实验过程中,生成乙酸正丁酯的产率是_______________________________。 解析:(1)冷凝管从下管口进水,上管口出水,使水充满冷凝管,提高冷凝效果。(2)由于反应可逆,硫酸作催化剂,产品中有乙酸、硫酸残留,第一次水洗除去大部分乙酸、硫酸;第二次水洗除去未反应的Na2CO3和生成的钠盐;酯的密度小于水,在水的上层,从分液漏斗的上口倒出乙酸正丁酯。(3)根据化学平衡移动原理,分离出生成物能促进平衡正向移动,提高产率。(4)乙酸和正丁醇发生酯化反应生成乙酸正丁酯和水,分离器中的水层会不断上升,当分离器中的水面高度保持不变时,表明该酯化反应已经完成。(5)理论上生成乙酸正丁酯11.6 g,则产率为5.8 g÷11.6 g×100%=50%。 答案:(1)a (2)除去大部分乙酸、正丁醇和硫酸 除去残留的钠盐上口 (3)使用分水器分离酯化反应生成的水,使平衡正向移动 (4)分水器中的水层不再增加 (5)50% 13.过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下: 已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。 (1)用上述方法制取CaO2·8H2O的化学方程式是_________________________________ ________________________________________________________________________。 (2)检验“水洗”是否合格的方法是_______________________________________ ________________________________________________________________________。 (3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种) ①________________________________________________________________________; ②________________________________________________________________________。 (4)测定产品中CaO2含量的实验步骤: 第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。 第二步:向上述锥形瓶中加入几滴淀粉溶液。 第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。 (已知:I2+2S2O===2I-+S4O) ①CaO2的质量分数为 ________ (用字母表示); ②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 ________ (填“不受影响”、“偏低”或“偏高”),原因是____________ ________________________________________________________________________。 答案:(1)CaCl2+H2O2+2NH3+8H2O===CaO2·8H2O↓+2NH4Cl (2)取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀 (3)①温度低可减少过氧化氢的分解,提高过氧化氢的利用率 ②该反应是放热反应,温度低有利于提高CaO2·8H2O的产率 (4)① ②偏高 滴速太慢,S2O在滴定过程中被氧气氧化查看更多