- 2021-07-08 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版高中化学必修1课件:第2章 第3节 氧化还原反应(3)
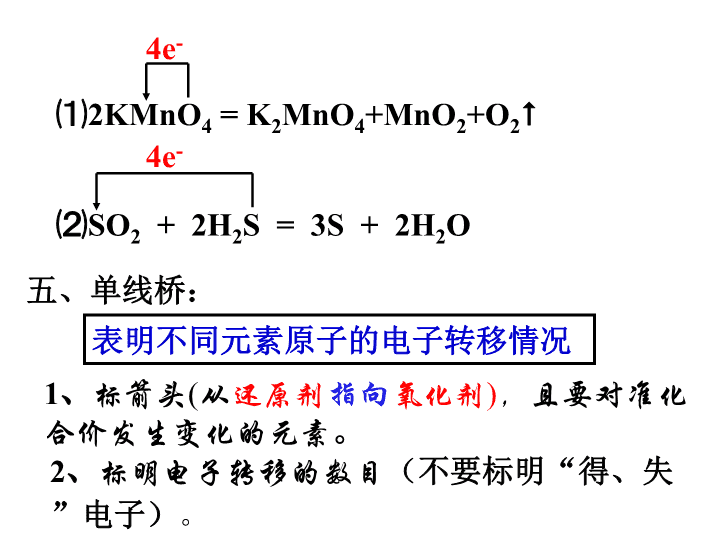
氧 化 还 原 反 应 (第三课时) [知识回顾] 用双线桥描述下列氧化还原反应 ⑴2KMnO4 = K2MnO4+MnO2+O2 ⑵SO2 + 2H2S = 3S + 2H2O 表明反应前后同一元素原子的电子转移情况 双线桥: 1、标价:标化合价发生改变的元素 2、连桥: 连同一元素不同价态,且由反应物指 向生成物。 3、在桥上标明得失电子总数、化合价升降、被 氧化、被还原等 ⑴2KMnO4 = K2MnO4+MnO2+O2 ⑵SO2 + 2H2S = 3S + 2H2O 4e- 4e- 五、单线桥: 表明不同元素原子的电子转移情况 1、标箭头(从还原剂指向氧化剂),且要对准化 合价发生变化的元素。 2、标明电子转移的数目(不要标明“得、失” 电子)。 六、氧化还原反应基本概念之间的关系 还原剂 还原性 氧化反应 氧化产物 氧化剂 氧化性 还原反应 还原产物 具有 失电子 价升高 具有 得电子 价降低 含价升 高元素 含价降 低元素 ①同时存在 ②得失电子相等 常见的强氧化剂: 常见的强还原剂: O2、 Cl2、 HNO3 、H2O2、浓硫酸 、KMnO4 、 FeCl3等 Al 、 Zn 、 Fe 、 C 、 H2 、CO等 【思考与练习】 2KMnO4 = K2MnO4+MnO2+O2 指出下列反应的氧化剂、还原剂、氧化产 物、还原产物 七、氧化性还原性强弱的比较 【思考与探究】 已知反应:Fe+CuSO4=Cu+FeSO4,请找出 该反应的氧化剂、还原剂、氧化产物、还原产物 , 并比较氧化剂与氧化产物的氧化性强弱,还原剂 与还原产物的还原性强弱。 还原性: 还原剂 还原产物 氧化性: Fe > Cu Cu2+ > Fe2+ 氧化剂 氧化产物 1、根据氧化还原反应进行的方向判断 氧化剂 + 还原剂 = 氧化产物 + 还原产物 氧化性: 氧化剂 > 氧化产物 还原性: 还原剂 > 还原产物 2、根据金属活动性顺序判断 ⑴金属性越强----失电子能力越强-- --还原性越强 ⑵金属性越弱-失电子能力越弱-其对应 离子(得电子能力越强)氧化性越强 根据下列反应判断有关物质还原性由强到弱 的顺序是 ( ) H2SO3 + I2 + H2O == 2HI + H2SO4 2FeCl3 + 2HI == 2FeCl2 + 2HCl + I2 3FeCl2 + 4HNO3 == 2FeCl3 + NO↑ + 2H2O + Fe(NO3)3 A. H2SO3 > I- > Fe2+ > NO B. I- > Fe2+ > H2SO3 > NO C. Fe2+ > I- > H2SO3 > NO D. NO > Fe2+ > H2SO3 > I- A 【思考与练习】 八、氧化还原反应的几个重要的规律 试判断下列元素所处价态的氧化性、还原性: C C Fe Fe S S S H Cl Cl N 【思考与探究】 1、价态律: 元素处于最低价:只有还原性,无氧化性 元素处于最高价:只有氧化性,无还原性 元素处于中间价态:具有双重性 【思考与练习】 1、C + CO2 2、Fe + FeCl3 3、SO2 + H2SO4 (浓) 4、H2S + H2SO4(浓) 想一想,下列反应能否发生?能发生 的,请预测有关产物? 2、转化律 同种元素不同价态之间发生氧化还原 反应时,价态的变化“只靠拢,不交叉”。 指出下列反应中的氧化产物和还原产物: ⑴KClO3 + 6HCl = 3Cl2 ↑+ KCl + 3H2O ⑵H2S + H2SO4(浓)= S ↓+ SO2↑ + 2H2O 3、电子守恒律 还原剂失电子总数 = 氧化剂得电子总数 即:化合价升高总数 = 化合价降低总数 【思考与练习】 1、单质X2和Y2起反应生成化合物的分子式是 XY,已知X是正价,下列叙述正确的是 ( ) A、X2被还原,X2是还原剂 B、Y2被氧化,Y2是氧化剂 C、X2被氧化,X2是还原剂 D、Y2被氧化,Y2是还原剂 C 2、已知反应:3Cl2+8NH3=N2+6NH4Cl参加反应 的NH3和作为还原剂的NH3的个数比为_________4∶ 1 【巩固练习】查看更多