- 2021-07-08 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届一轮复习人教版碳、硅及其化合物学案
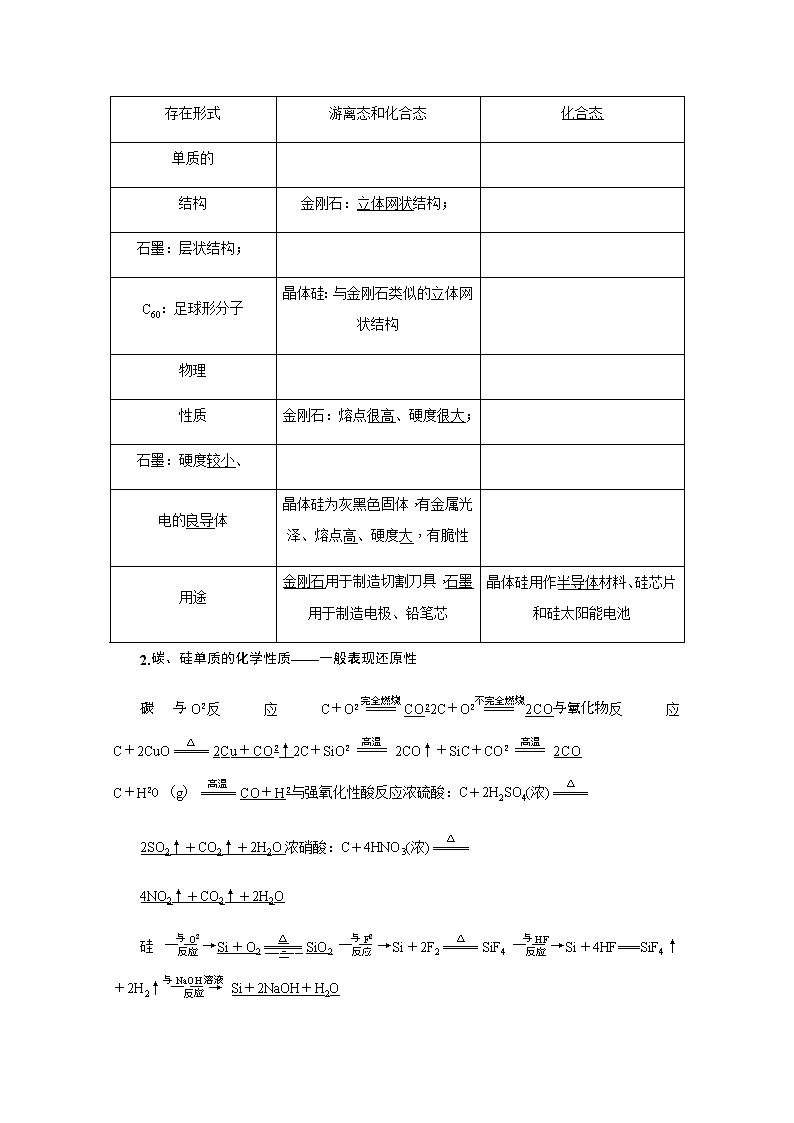
第四章 非金属及其化合物 第一节 碳、硅及其化合物 [高考备考指南] 考纲定位 1.了解碳、硅元素单质及其重要化合物的制备方法,掌握其主要性质及其应用。 2.了解碳、硅元素单质及其重要化合物对环境的影响。 3.以上各部分知识的综合应用。 核心素养 1.变化观念——分析碳、硅及其化合物的化学反应,预测在一定条件下碳、硅及其化合物可能发生的化学变化。 2.实验探究——发现或提出对碳、硅及其化合物有探究价值的化学问题,能依据探究目的设计并优化实验方案,完成实验操作,能对观察记录的实验信息进行加工并获得结论。 3.社会责任——关注与碳、硅有关的热点问题(如光导纤维、硅电池、半导体材料),具有可持续发展的意识;赞赏碳、硅及其化合物对社会发展的重大贡献。 碳、硅的单质 (对应复习讲义第37页) 1.碳、硅单质的存在形式、物理性质和用途 碳 硅 存在形式 游离态和化合态 化合态 单质的 结构 金刚石:立体网状结构; 石墨:层状结构; C60:足球形分子 晶体硅:与金刚石类似的立体网状结构 物理 性质 金刚石:熔点很高、硬度很大; 石墨:硬度较小、 电的良导体 晶体硅为灰黑色固体,有金属光泽、熔点高、硬度大,有脆性 用途 金刚石用于制造切割刀具,石墨用于制造电极、铅笔芯 晶体硅用作半导体材料、硅芯片和硅太阳能电池 2.碳、硅单质的化学性质——一般表现还原性 反应反应与强氧化性酸反应浓硫酸:C+2H2SO4(浓) 2SO2↑+CO2↑+2H2O浓硝酸:C+4HNO3(浓) 4NO2↑+CO2↑+2H2O 硅Si+O2SiO2Si+2F2SiF4Si+4HF===SiF4↑+2H2↑ Si+2NaOH+H2O ===Na2SiO3+2H2↑ (类似Al性质) 3.SiO2制粗硅、提纯硅的一般过程 SiO2Si(粗)SiCl4Si (1)硅的性质不活泼,故自然界中存在游离态的硅元素。( ) (2)金刚石、石墨、C60为碳的三种同素异形体。( ) (3)晶体硅熔点高、硬度大,故可用于制作半导体材料。( ) (4)Si和SiO2都可用于制造光导纤维。( ) (5)非金属性:C>Si,则热稳定性:CH4>SiH4。( ) (6)Si为非金属,与酸不能反应。( ) [提示] (1)× (2)√ (3)× (4)× (5)√ (6)× 1.有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列有关硅的说法中,不正确的是( ) A.高纯度的硅广泛用于制作计算机芯片 B.硅可由二氧化硅还原制得 C.低温时,硅与水、空气和酸不反应,但能与氢氟酸反应 D.自然界中硅元素的储量丰富,并存在大量的单质硅 D [硅是一种亲氧元素,主要以氧化物及硅酸盐的形式存在。] 2.(教材改编题)单晶硅是制作电子集成电路的基础材料, 对硅的纯度要求很高。用化学方法可制得高纯度硅,其化学方程式为 ①SiO2+2CSi+2CO↑ ②Si+2Cl2SiCl4 ③SiCl4+2H2Si+4HCl。 下列对上述三个反应的叙述不正确的是( ) A.①③为置换反应 B.②为化合反应 C.①②③均为氧化还原反应 D.三个反应的反应物中硅元素均被还原 D [反应①③为置换反应,反应②为化合反应,三个反应均有元素化合价变化,均属于氧化还原反应,其中反应①和③中硅元素被还原,反应②中硅元素被氧化。] Si单质特性理解误区 (1)Si的还原性大于C,但C却能在高温下还原出Si:SiO2+2CSi+2CO↑。 (2)非金属单质跟碱液作用一般无H2放出,但Si与碱液作用却放出H2:Si+2NaOH+H2O===Na2SiO3+2H2↑。 (3)非金属单质一般不跟非氧化性酸作用,但Si能与HF作用:Si+4HF===SiF4↑+2H2↑。 (4)非金属单质大多为非导体,但Si为半导体。 碳、硅的氧化物 1.一氧化碳的性质及应用 (1)物理性质:无色无味的气体,难溶于水,能使人中毒的原因是:与人体内血红蛋白相结合,因缺氧而中毒。 (2)化学性质及应用(写出有关化学方程式) ①可燃性:2CO+O22CO2,可作燃料。 ②还原性:CO还原Fe2O3的反应为3CO+Fe2O32Fe+3CO2,可用于冶炼金属。 2.CO2与SiO2性质的比较 (1)共性 均属于酸性氧化物,均能与碱、金属氧化物反应,写出二者与NaOH溶液(足量)反应的离子方程式:CO2+2OH-===CO+H2O、SiO2+2OH-===SiO+H2O;二者与CaO反应的化学方程式:CO2+CaOCaCO3、SiO2+CaOCaSiO3。 (2)差异性 ①SiO2与氢氟酸反应的化学方程式:SiO2+4HF===SiF4↑+2H2O。 ②SiO2与Na2CO3、CaCO3的反应——工业制玻璃 SiO2+Na2CO3Na2SiO3+CO2↑; SiO2+CaCO3CaSiO3+CO2↑。 ③CO2与H2O反应的方程式:CO2+H2OH2CO3。 ④SiO2为高硬度、高熔沸点的固体,不溶于水,而CO2为低熔沸点的气体,可溶于水。 3.CO2与SiO2的用途 CO2:制饮料、碳酸盐,干冰用作制冷剂,作灭火剂,干冰还用于人工降雨。 SiO2:制作光导纤维、光学仪器、电子部件,水晶可制作饰品。 CO2与碱反应产物的定量判断 以CO2与NaOH溶液反应为例,将CO2通入NaOH溶液中,可能发生的反应为 ①CO2+2NaOH===Na2CO3+H2O; ②CO2+NaOH===NaHCO3。 当n(OH-)∶n(CO2)的值不同时产物如下: 【例】 标准状况下,将3.36 L CO2气体通入200 mL 1.00 mol·L-1NaOH溶液中,充分反应后溶液中c(CO)与c(HCO)的比值为(不考虑CO、HCO的水解)( ) A.1∶1 B.1∶2 C.2∶1 D.1∶3 [思路点拨] ―→ =―→ ―→确定。 [答案] B [母题变式] (1)将“3.36 L”改为“4.48 L”,溶液中溶质是________。 (2)将“3.36 L”改为“2.24 L”,溶液中溶质是________。 [答案] (1)NaHCO3 (2)Na2CO3 角度1 CO2、CO的性质及应用 1.下列关于CO2、CO的说法正确的是________(填序号)。 ①燃料燃烧产物CO2是一种温室气体,属于大气污染物 ②C的氧化物只有CO和CO2两种 ③将过量CO2分别通入CaCl2溶液、Na2SiO3溶液、NaHCO3溶液、Ca(OH)2溶液均有白色沉淀生成 ④Na、Mg的失火均可用CO2灭火 ⑤CO2、CO均为酸性氧化物,能与NaOH反应 ⑥向NaAlO2溶液中通入过量CO2,生成Al(OH)3和NaHCO3 [答案] ⑥ 2.甲气体可发生如下变化: 甲气体乙气体丙气体乙气体丁固体。则甲、乙、丙、丁分别为( ) A.CO2、CO、O2、CaO B.O2、CO、CO2、CaCO3 C.O2、CO2、CO、CaCO3 D.CO、CO2、O2、Ca(OH)2 C [O2CO2COCO2CaCO3。] 角度2 SiO2的性质及应用 3.(2019·菏泽质检)下列关于SiO2和CO2的说法中正确的是________(填序号)。 ①CO2、SiO2分别是碳酸和硅酸的酸酐(酸性氧化物),均能与NaOH反应 ②SiO2为酸性氧化物,不与任何酸反应 ③光导纤维的主要成分是SiO2,能导电 ④SiO2+2NaOH===Na2SiO3+H2O体现了SiO2为酸性氧化物的性质 ⑤Si→SiO2→H2SiO3→SiO2→SiO均能一步转化 ⑥SiO2+3CSiC+2CO↑中SiO2作氧化剂 ⑦CO2和SiO2常温下都是由相应的分子构成 ⑧存放NaOH溶液的试剂瓶应用橡皮塞,不用玻璃塞的理由是玻璃中含有的SiO2与NaOH反应 [答案] ①④⑧ SiO2的特性及原理 (1)一般情况下,碱性氧化物与酸反应,酸性氧化物与碱反应,不与酸反应,但SiO2是酸性氧化物,却能与氢氟酸反应:SiO2+4HF===SiF4↑+2H2O,所以不能用玻璃容器盛放氢氟酸,可以用氢氟酸刻蚀玻璃。 (2)一般情况下,酸性氧化物与水反应能生成相应的酸,如CO2+H2OH2CO3,但SiO2不溶于水,不与水反应。 (3)一般情况下,因为碳酸的酸性比硅酸强,可发生反应,如Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3,即符合“较强酸制较弱酸”的复分解反应规律。而SiO2与Na2CO3、CaCO3在高温条件下可以发生反应:Na2CO3+SiO2Na2SiO3+CO2↑(原理是:难挥发性物质制备易挥发性物质)。 硅酸、硅酸盐和无机非金属材料 1.硅酸的性质、制备与应用 2.硅酸盐 (1)概念:由硅、氧和金属组成的化合物的总称,是构成地壳岩石的主要成分。 (2)表示方法:硅酸盐矿物的成分复杂,常用氧化物的形式表示它们的组成,如硅酸钠(Na2SiO3)写成Na2O·SiO2,钾云母(K2H4Al6Si6O24)写成K2O·3Al2O3·6SiO2·2H2O。 (3)硅酸钠(Na2SiO3)——又称泡花碱 ①白色、可溶于水的粉末状固体,其水溶液俗称水玻璃,有黏性,水溶液显碱性。 ②与较强的酸反应生成硅酸。 ③用途:黏合剂、耐火阻燃材料。 3.无机非金属材料 (1)传统无机非金属材料,如水泥、玻璃、陶瓷等硅酸盐材料。 ①常见硅酸盐材料比较 水泥 玻璃 陶瓷 生产原料 石灰石、黏土 纯碱、石灰石、石英砂 黏土 主要设备 水泥回转窑 玻璃窑 陶瓷窑 ②玻璃生产中的两个重要反应:Na2CO3+SiO2Na2SiO3+CO2↑;CaCO3+SiO2CaSiO3+CO2↑。 (2)新型无机非金属材料,如高温结构陶瓷、光导纤维、生物陶瓷、压电陶瓷等。 角度1 硅酸及其盐与无机非金属材料 1.下列说法正确的是________(填序号)。 ①HF与SiO2反应实际应用是氢氟酸在玻璃器皿上刻蚀标记 ②硅胶可用作食品干燥剂 ③如图:①中为浓硝酸,②中为Na2CO3,③中为Na2SiO3溶液,可证明酸性:硝酸>碳酸>硅酸 ④合成纤维和光导纤维都是新型无机非金属材料 ⑤Na2SiO3俗名水玻璃,是一种防火剂 ⑥水泥、玻璃、陶瓷的成分只有硅酸盐 [答案] ①② 2.青石棉是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2。青石棉用稀硝酸处理时,还原产物只有NO。下列说法不正确的是( ) A.青石棉是一种硅酸盐材料 B.青石棉中含有一定量的石英晶体 C.青石棉的化学组成可表示为Na2O·3FeO·Fe2O3·8SiO2·H2O D.1 mol青石棉能使稀硝酸中的1 mol HNO3被还原 B [硅酸盐指的是硅、氧与其他化学元素(主要是铝、铁、钙、镁、钾、钠等)结合而成的化合物的总称,故青石棉是一种硅酸盐产品;青石棉是一种纯净物,不可能含有一定量的石英晶体;1 mol Na2O·3FeO·Fe2O3·8SiO2·H2O跟硝酸反应时,失去3 mol电子,故能使稀硝酸中的1 mol HNO3被还原。] 硅酸盐改写成氧化物形式的方法 (1)氧化物的书写顺序:活泼金属氧化物―→较活泼金属氧化物―→二氧化硅―→水。 (2)氧化物前计量数的配置原则:除氧元素外,其他元素按配置前后原子个数守恒原则配置计量数,且不同氧化物间以“·”隔开。 (3)当计量数配置出现分数时应化为整数,如钾长石: KAlSi3O8不能写成K2O·Al2O3·3SiO2,应写成K2O·Al2O3·6SiO2。 角度2 硅及其化合物的转化 3.已知A是带有金属光泽的灰黑色固体单质。根据如图所示的物质之间的转化关系,回答下列有关问题。 (1)写出B、C两物质的名称: B.________、C.________。 (2)写出D→B的化学方程式:___________________________________________ ________________________________________________________________________。 (3)写出B→C的离子方程式:___________________________________________。 [解析] 由题意及转化关系可知A为Si,B为Na2SiO3,C为H2SiO3,D为SiO2。 [答案] (1)硅酸钠 硅酸 (2)SiO2+2NaOH===Na2SiO3+H2O (3)SiO+H2O+CO2===CO+H2SiO3↓ 硅及其化合物之间的常见转化关系 x())查看更多