- 2021-07-08 发布 |
- 37.5 KB |
- 17页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版实验方案的设计与评价学案
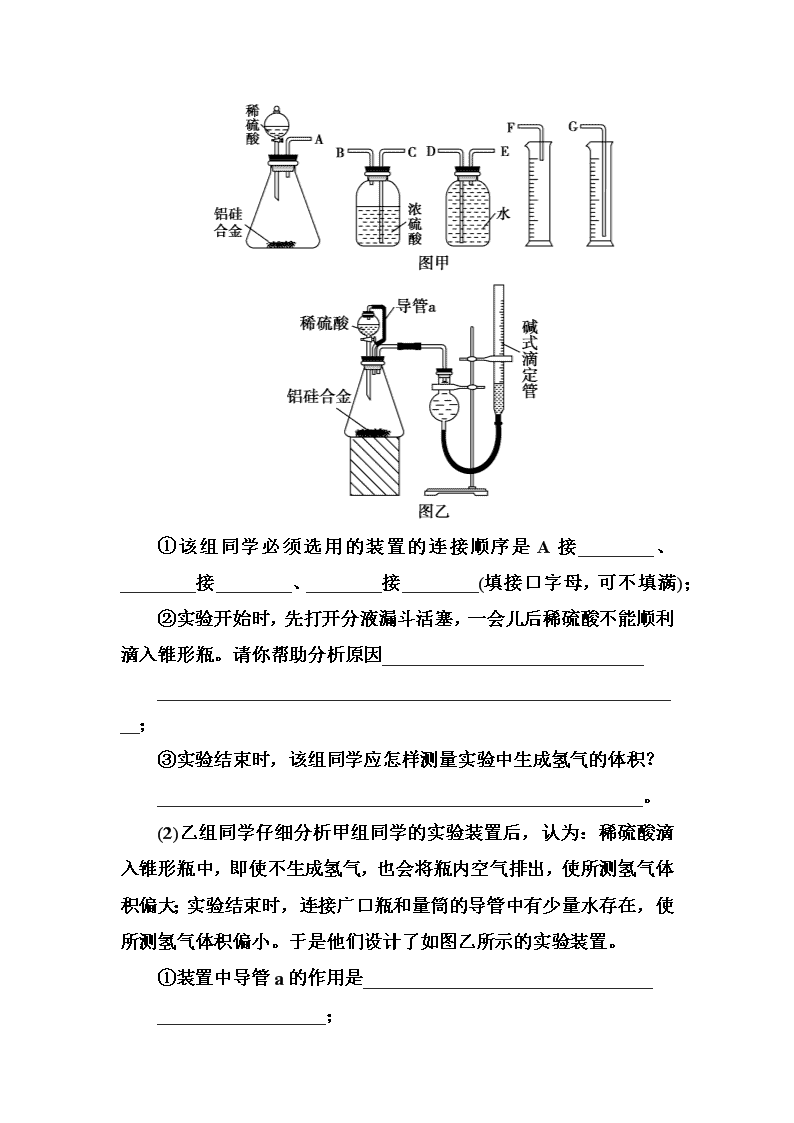
第3讲 实验方案的设计与评价 考纲要求 1.能根据要求,做到设计、评价或改进实验方案。 2.分析或处理实验数据。 考点一 数据的测量方法、过程综合实验题 通过测定物质的质量、气体、液体的体积,对反应过程中物质的含量、变化进行定量的研究,是一种重要的实验方法,通常数据的测定方法有以下几类: 1.沉淀法 根据原子守恒的原理,通过系列反应把欲测定元素转化为沉淀,通过测定沉淀质量,获知目标元素的含量。实验的措施要以目标元素完全转化为沉淀为中心,多涉及沉淀的过滤、洗涤、干燥、称量等操作。 2.测定气体体积法 对于有气体生成的反应,可通过测定生成气体的体积来测定样品的纯度。测定气体体积的具体措施多为排液量气。常见方案如下: 3.测定气体质量法 把生成的气体通入足量的吸收剂,通过测定实验前后吸收剂的质量,获得生成气体的质量,然后进行计算。 4.固体质量差量法 利用固体加热前后或反应前后的质量变化作为已知量,通过方程式找出的差量进行计算。 5.滴定法 利用滴定实验的原理,通过酸碱中和滴定、沉淀滴定、氧化还原滴定等获得待测物质数据,再进行计算,常涉及指示剂的选择,滴定终点的确定等实验考查。 考向一 气体体积的测量 1.(2018·湖北仙桃中学开学摸底)某中学有甲、乙两个探究性学习小组,他们拟用小颗粒状铝硅合金与足量稀硫酸的反应测定通常状况(约20 ℃,1 atm)下气体摩尔体积。 (1)甲组同学拟选用如图甲实验装置完成实验: ①该组同学必须选用的装置的连接顺序是A接________、________接________、________接________(填接口字母,可不填满); ②实验开始时,先打开分液漏斗活塞,一会儿后稀硫酸不能顺利滴入锥形瓶。请你帮助分析原因____________________________ _________________________________________________________; ③实验结束时,该组同学应怎样测量实验中生成氢气的体积? ____________________________________________________。 (2)乙组同学仔细分析甲组同学的实验装置后,认为:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图乙所示的实验装置。 ①装置中导管a的作用是_______________________________ __________________; ②实验中准确测得4个数据:实验前铝硅合金的质量为m1 g,实验后残留固体的质量为m2 g,实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL,则通常状况下气体摩尔体积Vm=________。 解析:(1)①装置的组装顺序:合金与酸反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:(A)接(E),(D)接(G); ②铝与稀硫酸反应产生的氢气使锥形瓶内气压增大,锥形瓶内的压强大于大气压,所以稀硫酸不能顺利滴入锥形瓶中;③实验结束时,该组同学测量实验中生成氢气的体积方法为:待实验装置冷却后,上下移动量筒,使其中液面与广口瓶中液面相平,再平视读取量筒中水的体积,即氢气在通常状况时的体积。 (2)①装置中导管a的作用是:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差;②实验前铝硅合金的质量m1 g,实验后残留固体的质量m2 g,则金属铝的质量是(m1-m2)g,实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL,产生气体体积为(V1-V2)mL即产生的气体物质的量是,根据关系式: 2Al ~ 3H2↑ 2 3 解得Vm=L·mol-1。 答案:(1)E D G ②铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大 ③待实验装置冷却后,上下移动量筒,使其中液面与广口瓶中液面相平,再平视读取量筒中水的体积,即生成氢气在通常状况时的体积 (2)①保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差 ②L·mol-1 考向二 固体质量的测量 2.(2018·河北唐山一中调研)某化学研究小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,在实验室中按以下步骤进行实验: ①称取a g样品,置于烧杯中;②取适量盐酸和适量蒸馏水使样品溶解,准确配制成250 mL溶液;③准确量取25.00 mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;④加入过量氨水,充分搅拌,使沉淀完全;⑤过滤,洗涤沉淀;⑥将沉淀转移至坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色,冷却至室温后,称量;⑦…… 请根据上面的叙述回答下列问题: (1)如图所给仪器中,实验步骤①②③中必须用到的仪器是E和________________(填仪器序号);还缺少的主要仪器名称是________________。 (2)步骤④中所发生反应的离子方程式为_________________。 (3)步骤⑤中洗涤沉淀的操作是__________________________。 (4)若坩埚质量是W1 g,最终坩埚和固体的总质量是W2 g,则样品中铁元素的质量分数为________。 解析:(1)称量需要托盘天平,溶解需要烧杯和玻璃棒,配制需要容量瓶和胶头滴管,注意A仪器不是容量瓶,为圆底烧瓶,第③步量取FeCl3溶液时要用酸式滴定管;(3)判断沉淀是否洗净最简单的方法是判断洗涤液中是否还含有Cl-;(4)生成n(Fe2O3)= mol,所以样品中m(Fe)=×2×56×g=7(W2-W1)g则w(Fe)=×100%=% 答案:(1)CF 250 mL容量瓶、玻璃棒、胶头滴管 (2)Fe3++3NH3·H2O===Fe(OH)3↓+3NH (3)沿波璃棒向过滤器(或漏斗)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作2~3次 (4)% 【技法归纳】 实验方案的设计与评价 设计或评价一个实验方案主要从以下角度考虑: (1)实验原理是否合理。如第1题甲组同学方案中排水量气法中忽略了滴入稀硫酸排出空气的影响。 (2)从原料的用量、成本考虑。一般选择原料用量少,成本低的方案。 (3)从环保角度考虑。 (4)从装置的简易或实验方案的优劣角度考虑。 考点二 数据的分析、处理综合实验题 定量实验,需要对实验测定的数据进行记录、处理、比较、计算,以便达到实验目的,数据处理的常用方法: 1.数据的表格化 对记录的数据进行表格化处理,便于数据的查找、比较、计算。 2.数据的图象化 图象是把实验测得的数据用直线图或曲线图的形式呈现出来,多用于两个量之间关系的描述,具有直观明了的特点。 考向一 实验数据的选择与取舍 1.目前流行的关于生命起源假设的理论认为,生命起源于约40 亿年前的古洋底的热液环境,这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验。 【实验Ⅰ】 确定硫的质量: 按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0 g铁硫簇结构(含有部分不反应的杂质),在试管B中加入50 mL 0.100 mol·L-1的酸性KMnO4溶液,在试管C中加入品红溶液。通入空气并加热,发现固体逐渐转变为红棕色。待固体完全转化后,将B中溶液转移至250 mL容量瓶,洗涤试管B后定容。取25.00 mL该溶液用0.01 mol·L-1的草酸(H2C2O4)溶液滴定剩余的KMnO4。记录数据如下: 滴定次数 待测溶液体积/mL 草酸溶液体积/mL 滴定前刻度 滴定后刻度 1 25.00 1.50 23.70 2 25.00 1.02 26.03 3 25.00 0.00 24.99 相关反应:①2MnO+2H2O+5SO2===2Mn2++5SO+4H+ ②2MnO+6H++5H2C2O4===2Mn2++10CO2↑+8H2O 【实验Ⅱ】 确定铁的质量: 将实验Ⅰ硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6 g固体。 试回答下列问题: (1)判断滴定终点的方法是______________________________。 (2)试管C中品红溶液的作用是_________________________。 有同学提出,撤去C装置对实验没有影响,你的看法是________(填“同意”或“不同意”),理由是__________________。 (3)根据实验Ⅰ和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为________________。 【问题探究】 滴定过程中,细心的同学发现该KMnO4溶液颜色褪去的速率较平常滴定时要快得多。为研究速率加快的原因,该同学继续进行了下列实验,实验数据如下表: 编号 温度/℃ 酸化的H2C2O4 溶液/mL KMnO4] 溶液/mL 溶液褪色时间/s 1 25 5.0 2.0 40 2 25 5.0(另加少量可溶于水的MnSO4粉末) 2.0 4 3 60 5.0 2.0 25 (4)分析上述数据,滴定过程中反应速率加快的一种可能原因是________________________________________________________________________。 解析:(1)KMnO4溶液本身为紫色,而反应后的Mn2+为无色,所以当溶液由紫红色变为无色时,标志达到了滴定终点。 (2)确认SO2是否除净。由于KMnO4溶液本身有颜色,所以颜色不再发生变化时,也可表明SO2被完全吸收。 (3)三次实验所耗草酸溶液分别为:22.20 mL、25.01 mL、24.99 mL,第一组实验数据偏差过大舍去;则平均耗草酸溶液25.00mL,则过量KMnO4:×2×10=1.0×10-3 mol,与SO2反应的KMnO4:0.05 L×0.100 mol·L-1-1.0×10-3 mol=4×10-3 mol,则生成SO2:4×10-3 mol×=0.01 mol。 根据[实验Ⅱ],n(Fe2O3)==0.00375 mol, 则x∶y=(0.00375 mol×2)∶(0.01 mol)=3∶4, 所以FexSy化学式为Fe3S4。 答案:(1)当滴入最后一滴草酸溶液时,锥形瓶中溶液由浅红色变为无色,且半分钟内不变化 (2)验证SO2是否被酸性KMnO4溶液完全吸收 同意 当B中溶液颜色不变化,即可证明SO2已被酸性KMnO4溶液完全吸收 (3)Fe3S4 (4)Mn2+对反应起到催化作用(或反应放热使温度升高),加快反应速率 2.(2018·河北邢台一中月考)金属镁及其化合物在科学研究及生产中具有广泛的用途。 (1)轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,以卤块(主要成分为MgCl2,含Fe2+、Fe3+等杂质离子)为原料制备轻质碳酸镁[MgCO3·Mg(OH)2·3H2O,相对分子质量:196]的工艺流程如下: 生成氢氧化物沉淀的pH(见下表): 物质 Fe(OH)3 Fe(OH)2 Mg(OH)2 开始沉淀时pH 2.7 7.6 9.9 沉淀完全时pH 3.7 9.6 11.1 注:Fe(OH)2沉淀呈絮状,不易从溶液中除去。 ①“氧化”的目的是____________,相关反应的离子方程式为__________________________________________。 ②“热解”过程中反应的离子方程式为___________________。 ③取2.00 g轻质碳酸镁于锥形瓶中,用2 mol·L-1的盐酸进行滴定反应,数据如下: 实验 序号 轻质碳酸镁用量/g 盐酸开始读数/mL 盐酸终止读数/mL 1 2.00 1.00 21.01 2 2.00 21.10 42.03 3 2.00 0.10 20.09 依据上述实验数据,算出轻质碳酸镁的纯度(假设杂质不与盐酸反应)为________________。 解析:(1)①由“Fe(OH)2沉淀呈絮状,不易从溶液中除去”知,氧化的目的是将Fe2+转化为Fe3+,反应中ClO-被还原成Cl-,此过程中有H+参与反应且有水生成。②由于“热解”的产物是CO2 与轻质碳酸镁,故可先写出Mg2++HCO―→MgCO3·Mg(OH)2·3H2O↓+CO2↑,再结合质量守恒原理配平即可。③表中三组数据中,第2组与另外两组差异较大,应舍弃,消耗盐酸的平均体积为20.00 mL,n(HCl)=0.04 mol,由于1 mol轻质碳酸镁可与4 mol HCl反应,故发生反应的MgCO3·Mg(OH)2·3H2O为0.01 mol,质量为1.96 g,故其纯度为×100%=98%。 答案:(1)①将Fe2+氧化成Fe3+ ClO-+2H++2Fe2+===2Fe3++Cl-+H2O ②2Mg2++4HCO+2H2OMgCO3·Mg(OH)2·3H2O↓+3CO2↑ ③98% 考向二 实验数据的综合处理 3.某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。 (1)该反应的离子方程式为___________________________。 (2)提出合理假设,该实验中反应速率明显加快的原因可能是________。 A.反应放热导致温度升高 B.压强增大 C.生成物的催化作用 D.反应物接触面积增大 (3)初步探究,测定反应过程中不同时间溶液的温度,结果如下表: 时间/min 0 5 10 15 20 25 35 50 60 70 80 温度/℃ 25 26 26 26 26 26 26.5 27 27 27 27 结合实验目的和表中数据,你得出的结论是____________________________________________________。 (4)进一步探究:查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用。请完成以下实验设计表并将实验目的补充完整: 实验编号 铜片质量/g 0.1 mol·L-1的硝酸体积/mL 硝酸铜晶体/g 亚硝酸钠晶体/g 实验目的 ① 5 20 实验①和②探究________的影响;实验①和③探究NO的影响 ② 0.5 ③ 0.5 解析:(1)铜与稀HNO3反应离子方程式:3Cu+8H++2NO===3Cu2++2NO↑+4H2O (2)因为铜与硝酸反应是放热反应,随反应的进行,溶液温度升高,A选项合理;反应体系并非密闭体系,压强不变,B不合理;反应生成了Cu2+,有可能Cu2+对该反应有催化作用,C合理;随反应进行,铜片减小,接触面积减小,D不合理;可能的原因是AC。 (3)由表中数据可知整个反应过程中,溶液温度变化很小,且在很长时间段内保持不变,所以温度不是影响反应速率的主要因素。 (4)当探究某一条件对反应速率的影响时,应保持其他条件不变。②中加入了Cu(NO3)2晶体是研究Cu2+对反应速率的影响,所以②③中铜片都取5 g,硝酸都取20 mL,①中不放Cu(NO3)2晶体,也不放 NaNO2晶体;②中不放NaNO2晶体,③中不放Cu(NO3)2晶体。 答案:(1)3Cu+8H++2NO===3Cu2++2NO↑+4H2O (2)AC (3)温度不是导致反应速率明显加快的主要原因 (4) 实验编号 铜片质量/g 0.1 mol·L-1的硝酸体积/mL 硝酸铜晶体/g 亚硝酸钠晶体/g 实验 目的 ① 0 0 Cu2+ ② 5 20 0 ③ 5 20 0 4.现有一份CuO和Cu2O的混合物,用H2还原法测定其中的CuO质量x g,实验中可以测定以下数据:①m:混合物的质量(g)、②m(H2O):生成水的质量(g)、③m(Cu):生成Cu的质量(g)、④V(H2):标准状况下消耗H2的体积(L)。(已知摩尔质量:Cu:64 g·mol-1、CuO:80 g·mol-1、Cu2O:144 g·mol-1、H2O:18 g·mol-1) (1)为了计算x至少需要测定上述4个数据中的______个,这几个数据的组合共有________种。请将这些组合一一填入下列空格中。 说明:①选用m、m(H2O)、m(Cu)、V(H2)表示,不必列出具体算式。 ②每个组合中填一种组合,有几种组合就填几种,不必填满。 (2)从上述组合中选出一个含W的求x的计算式:__________。 (3)以上数据组合中易于取得的一组是________________________。 解析:本题想解决的是CuO和Cu2O二元混合物的质量组成,要通过列二元一次方程组的方法求解,所以需要获得两个数据。将题中所给数据进行排列组合,有下列6种组合。 m、m(H2O) m、m(Cu) m、V(H2) m(H2O)、m(Cu) m(H2O)、V(H2) m(Cu)、V(H2) 在6种组合中不难看出V(H2)、m(H2O)一组不能成立,因为这一组仅与氧元素有关而与铜元素无关,不能形成两个有效的二元一次方程,无法求出CuO和Cu2O的量,所以实际只有5组数据组合是合理的。但这5种组合中,结合氢气要过量的特点,V(H2)这一数据在获得上有一定的困难。测m(H2O)易受空气中的水及CO2的干扰,并且装置复杂,数据合理,但不简易。m及m(Cu)在获取上是最容易且可靠的。 答案:(1)2 5 m、m(H2O) m、m(Cu) m、V(H2) m(H2O)、m(Cu) m(Cu)、V(H2) (2)可从以下三组中任选一组 ①+= ②+= ③+=(任选一个即可) (3)m和m(Cu) 【题后悟道】 定量实验中数据的加工处理 (1)根据实验目的,确定有用有效数据,舍弃无用、无效数据。 (2)确定数据是否有效,常从以下角度考虑。 ①是否符合仪器精度要求。 ②数据是否存在过大的偶然误差。 ③数据的测定是否是在原理要求的条件下测得,尤其要注意气体的体积数据。 (3)表格数据要比较不同数据间的差别,分析出其所代表的化学意义。 (4)图象数据重点在于弄清坐标的含义,然后理清起点、终点、转折点的含义,再通过这些点的坐标数据进行合理的计算得出结论。 (2017·高考天津卷,T4)以下实验设计能达到实验目的的是( ) 实验目的 实验设计 A. 除去NaHCO3固体中的Na2CO3 将固体加热至恒重 B. 制备无水AlCl3 蒸发Al与稀盐酸反应后的溶液 C. 重结晶提纯苯甲酸 将粗品水溶、过滤、蒸发、结晶 D. 鉴别NaBr和KI溶液 分别加新制氯水后,用CCl4萃取 解析:A.加热碳酸氢钠分解生成了碳酸钠,不能达到使用目的;B.直接蒸发AlCl3溶液,铝离子发生水解,最终得到的是Al(OH)3,不能达到目的;C. 重结晶法提纯苯甲酸的方法是:将粗品水溶,趁热过滤,滤液冷却结晶即可,C项不能达到目的;D.NaBr和KI都能与氯水反应生成对应的单质,再用四氯化碳萃取,颜色层不同。故选D。 答案:D查看更多