- 2021-07-08 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习“7+1”小卷练4(全国通用)
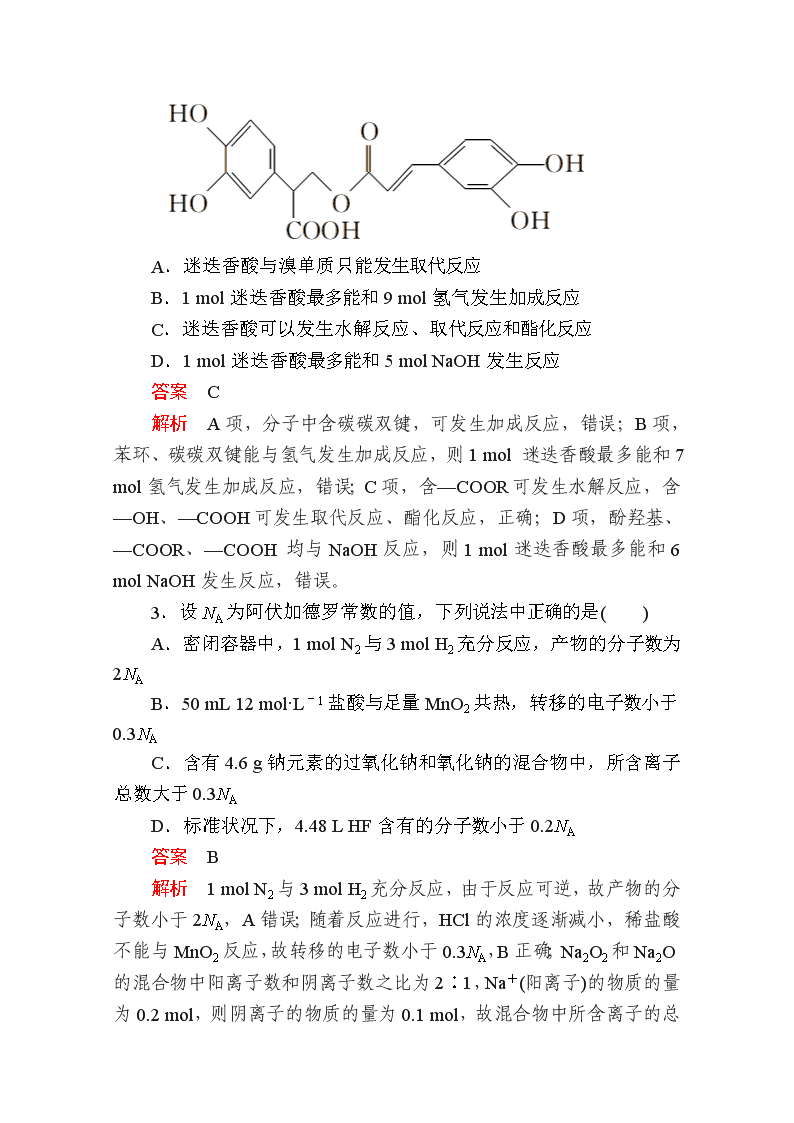
“7+1”小卷练4 1.以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下,下列叙述不正确的是( ) A.加入CaO在减少SO2排放的同时生成建筑材料CaSO4 B.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3 C.隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5 D.烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来 答案 C 解析 高硫铝土矿粉焙烧时会生成SO2,加入CaO会与SO2反应,减少SO2的排放,而且CaSO3最后也会转化为CaSO4,A正确;滤液中含NaAlO2,通入CO2,生成Al(OH)3,过滤、洗涤、灼烧可以得到Al2O3,B正确;FeS2与Fe2O3隔绝空气焙烧的化学方程式为FeS2+16Fe2O311Fe3O4+2SO2,n(FeS2)∶n(Fe2O3)=1∶16,而不是1∶5,C错误;Fe3O4具有磁性,能够被磁铁吸引,D正确。 2.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构简式如图所示。下列叙述正确的是( ) A.迷迭香酸与溴单质只能发生取代反应 B.1 mol迷迭香酸最多能和9 mol氢气发生加成反应 C.迷迭香酸可以发生水解反应、取代反应和酯化反应 D.1 mol迷迭香酸最多能和5 mol NaOH发生反应 答案 C 解析 A项,分子中含碳碳双键,可发生加成反应,错误;B项,苯环、碳碳双键能与氢气发生加成反应,则1 mol 迷迭香酸最多能和7 mol氢气发生加成反应,错误;C项,含—COOR可发生水解反应,含—OH、—COOH可发生取代反应、酯化反应,正确;D项,酚羟基、—COOR、—COOH 均与NaOH反应,则1 mol迷迭香酸最多能和6 mol NaOH发生反应,错误。 3.设NA为阿伏加德罗常数的值,下列说法中正确的是( ) A.密闭容器中,1 mol N2与3 mol H2充分反应,产物的分子数为2NA B.50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数小于0.3NA C.含有4.6 g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数大于0.3NA D.标准状况下,4.48 L HF含有的分子数小于0.2NA 答案 B 解析 1 mol N2与3 mol H2充分反应,由于反应可逆,故产物的分子数小于2NA,A错误;随着反应进行,HCl的浓度逐渐减小,稀盐酸不能与MnO2反应,故转移的电子数小于0.3NA,B正确;Na2O2和Na2O的混合物中阳离子数和阴离子数之比为2∶1,Na+(阳离子)的物质的量为0.2 mol,则阴离子的物质的量为0.1 mol,故混合物中所含离子的总数为0.3NA,C错误;标准状况下,HF为液体,D错误。 4.下列实验中,所采取的分离方法与实验原理都正确的是( ) 答案 D 解析 NO2和NO的混合气体能与NaOH溶液发生反应:2NaOH+NO2+NO===2NaNO2+H2O,A错误;除去乙醇中的水应加入氧化钙,然后蒸馏,熟石灰是Ca(OH)2,没有吸水作用,B错误;除去KNO3中的NaCl,利用冷却热饱和溶液重结晶法分离,是因为KNO3的溶解度受温度变化影响较大,C错误;铝与氢氧化钠溶液反应,而铁不反应,反应后过滤即得铁,D正确。 5.X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断错误的是( ) A.反应③为工业制粗硅的原理 B.Z位于元素周期表第三周期ⅡA族 C.4种元素的原子中,Y原子的半径最小 D.工业上通过电解乙来制取Z 答案 D 解析 由题意及题图分析可知X为C、Y为O、Z为Mg、W为Si,甲为CO2,乙为MgO,丙为SiO2,丁为CO。反应③为工业制粗硅的原理:2C+SiO2Si+2CO↑,故A正确;Z为Mg,位于元素周期表第三周期ⅡA族,故B正确;4种元素的原子中,半径最小的为O,故C正确;工业上通过电解熔融MgCl2得到Mg,故D错误。 6.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是( ) A.铜电极上发生氧化反应 B.电池工作一段时间后,甲池的c(SO)减小 C.电池工作一段时间后,乙池溶液的总质量增加 D.阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 答案 C 解析 锌电极是原电池的负极,发生氧化反应,铜电极是原电池的正极,发生还原反应,A错误;阳离子交换膜不允许阴离子通过,所以电池工作一段时间后,甲池的c(SO)不变,B错误;乙池发生的电极反应为Cu2++2e-===Cu,溶液中Cu2+逐渐减少,为维持溶液中的电荷平衡,Zn2+会不断移向乙池,Zn的摩尔质量大于Cu,使溶液质量增加,C正确;阳离子交换膜只允许阳离子和水分子通过,D错误。 7.室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸溶液,滴定曲线如图所示。下列说法正确的是( ) A.Ⅰ表示的是滴定盐酸的曲线 B.pH=7时,滴定醋酸溶液消耗的V(NaOH)小于20.00 mL C.V(NaOH) =20.00 mL时,两份溶液中c(Cl-)=c(CH3COO-) D.V(NaOH)=10.00 mL时,滴定醋酸溶液所得的溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) 答案 B 解析 0.100 mol·L-1盐酸的pH=1,0.100 mol·L-1醋酸溶液的 pH>1,故Ⅱ表示的是滴定盐酸的曲线,Ⅰ表示的是滴定醋酸溶液的曲线,A错误;若V(NaOH)=20.00 mL,所得溶液的溶质为 CH3COONa,溶液显碱性,pH>7,故pH=7时,滴定醋酸溶液消耗的 V(NaOH)小于20.00 mL,B正确;V(NaOH)=20.00 mL时,两份溶液分别为等浓度的CH3COONa溶液、NaCl溶液,由于CH3COO-发生水解,故c(CH3COO-)查看更多