- 2021-07-08 发布 |
- 37.5 KB |
- 22页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习弱电解质的电离作业
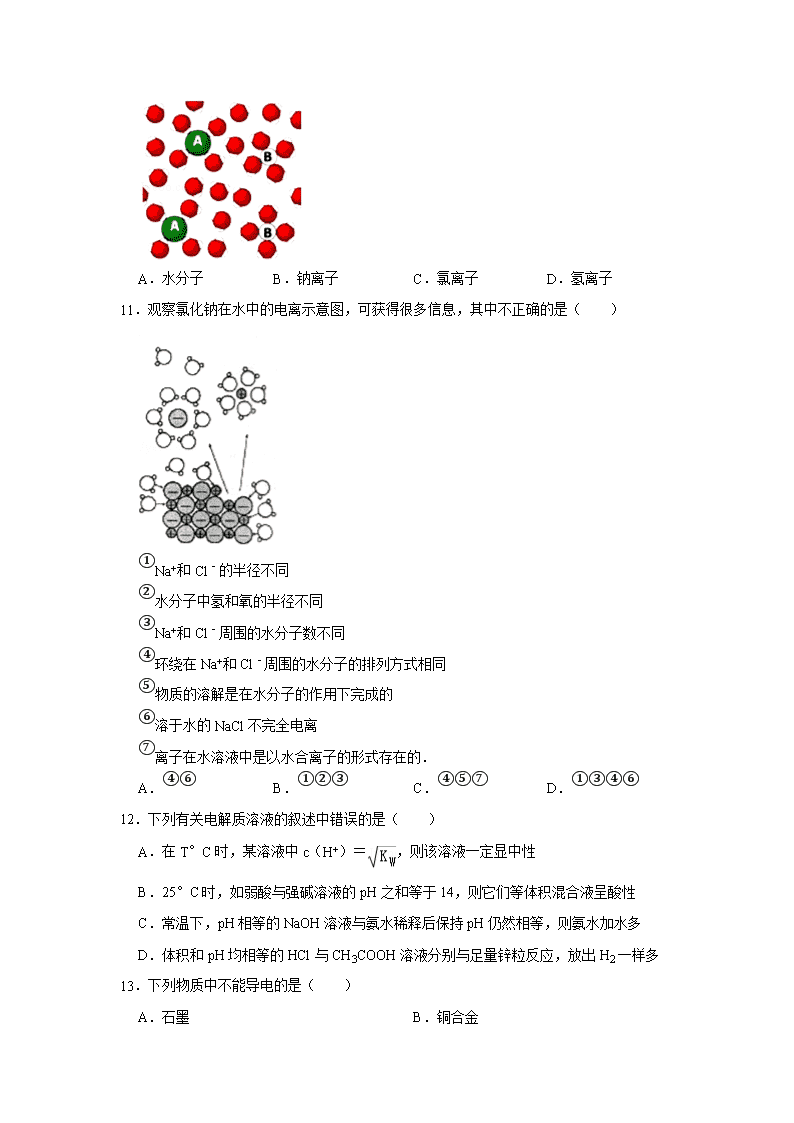
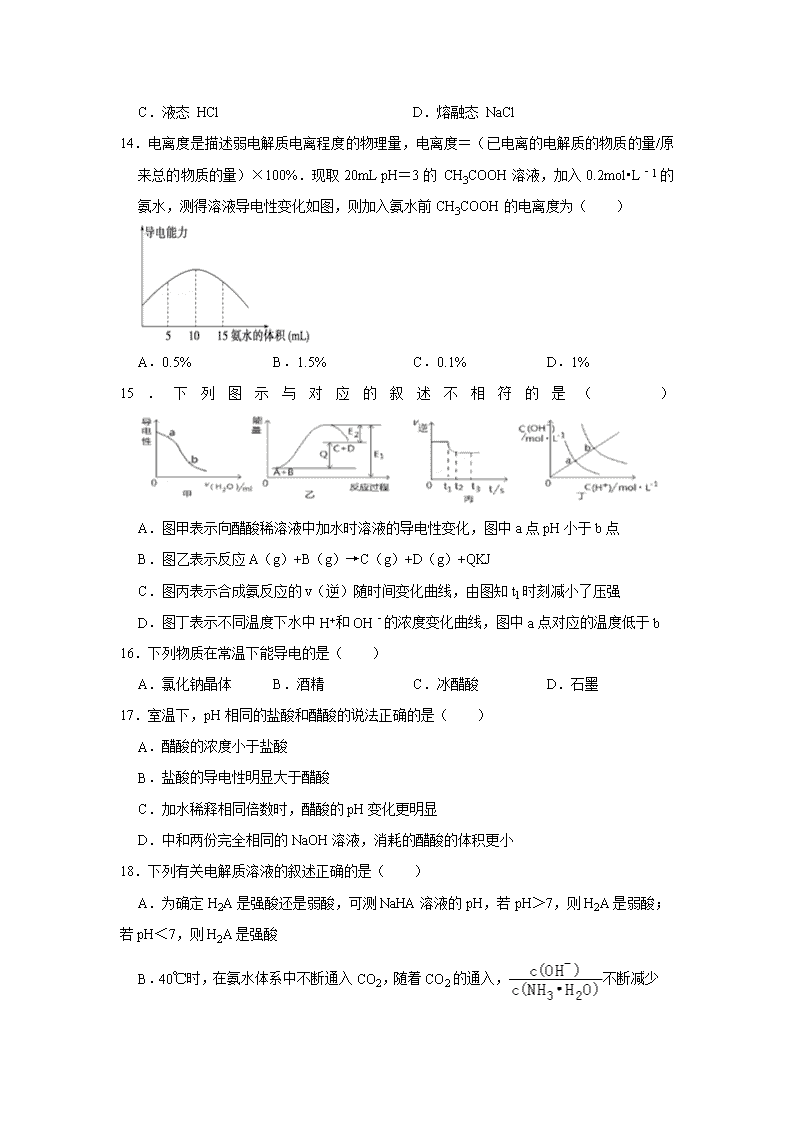
弱电解质的电离 一.选择题(共20小题) 1.电解质一般是指( ) A.可以导电的化合物 B.可以导电的纯净物 C.酸碱盐等的化合物 D.可溶于水的纯净物 2.下列属于非电解质的是( ) A.己烷 B.蔗糖溶液 C.氢气 D.氯化镁 3.下列说法正确的是( ) A.Cl2溶于水得到的氯水能导电,但Cl2不是电解质,而是非电解质 B.只有在电流作用下KHSO4才能电离成K+、H+和SO42﹣ C.强电解质溶液的导电能力不一定都强;弱电解质溶液的导电能力不一定都弱 D.BaSO4难溶于水,故BaSO4是弱电解质;醋酸铅易溶于水,故醋酸铅是强电解质 4.下列物质属于电解质的是( ) A.NaCl溶液 B.SO3 C.NaOH D.Cu 5.下列物质溶于水时会破坏水的电离平衡,且属于强电解质的是( ) A.硫酸钠 B.氯化铝 C.酒精 D.一水合氨 6.属于强电解质的是( ) A.KNO3 B.NH3•H2O C.CH3COOH D.H2O 7.在水溶液中,能完全电离的是( ) A.Al(OH)3 B.C8H18 C.(NH4)2CO3 D.HClO 8.属于弱电解质的是( ) A.一水合氨 B.二氧化碳 C.乙醇 D.硫酸钡 9.下列物质的水溶液中只存在一种分子的是( ) A.NaOH B.NH4Cl C.CH3CH2OH D.HClO 10.如图表示食盐与水混合后微粒的示意图,则微粒A 表示( ) A.水分子 B.钠离子 C.氯离子 D.氢离子 11.观察氯化钠在水中的电离示意图,可获得很多信息,其中不正确的是( ) ①Na+和Cl﹣的半径不同 ②水分子中氢和氧的半径不同 ③Na+和Cl﹣周围的水分子数不同 ④环绕在Na+和Cl﹣周围的水分子的排列方式相同 ⑤物质的溶解是在水分子的作用下完成的 ⑥溶于水的NaCl不完全电离 ⑦离子在水溶液中是以水合离子的形式存在的. A.④⑥ B.①②③ C.④⑤⑦ D.①③④⑥ 12.下列有关电解质溶液的叙述中错误的是( ) A.在T°C时,某溶液中c(H+)=,则该溶液一定显中性 B.25°C时,如弱酸与强碱溶液的pH之和等于14,则它们等体积混合液呈酸性 C.常温下,pH相等的NaOH溶液与氨水稀释后保持pH仍然相等,则氨水加水多 D.体积和pH均相等的HCl与CH3COOH溶液分别与足量锌粒反应,放出H2一样多 13.下列物质中不能导电的是( ) A.石墨 B.铜合金 C.液态 HCl D.熔融态 NaCl 14.电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20mL pH=3的 CH3COOH溶液,加入0.2mol•L﹣1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( ) A.0.5% B.1.5% C.0.1% D.1% 15.下列图示与对应的叙述不相符的是( ) A.图甲表示向醋酸稀溶液中加水时溶液的导电性变化,图中a点pH小于b点 B.图乙表示反应A(g)+B(g)→C(g)+D(g)+QKJ C.图丙表示合成氨反应的v(逆)随时间变化曲线,由图知t1时刻减小了压强 D.图丁表示不同温度下水中H+和OH﹣的浓度变化曲线,图中a点对应的温度低于b 16.下列物质在常温下能导电的是( ) A.氯化钠晶体 B.酒精 C.冰醋酸 D.石墨 17.室温下,pH相同的盐酸和醋酸的说法正确的是( ) A.醋酸的浓度小于盐酸 B.盐酸的导电性明显大于醋酸 C.加水稀释相同倍数时,醋酸的pH变化更明显 D.中和两份完全相同的NaOH溶液,消耗的醋酸的体积更小 18.下列有关电解质溶液的叙述正确的是( ) A.为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 B.40℃时,在氨水体系中不断通入CO2,随着CO2的通入,不断减少 C.常温下。将等体积、等物质的量浓度的NH4HCO3与NaC1溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,则滤液中:c(H+)+c(NH4+)=c(OH﹣)+c (HCO3﹣)+2c(CO32﹣) D.室温下,将0.05mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入0.05mo1CaO,所得溶液中减小 19.下列事实中,能说明醋酸是弱酸的是( ) A.冰醋酸能和氨水反应 B.冰醋酸加水后导电性增强 C.醋酸溶液能溶解CaCO3 D.醋酸溶液加热后c(CH3COO﹣)变大 20.25℃时,改变0.1mol/L弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知δ(RCOOH)=,甲酸(HCOOH)]与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是( ) A.图中M、N两点对应溶液中的c(OH﹣)比较:前者>后者 B.丙酸的电离常数K=10﹣4.88 C.等浓度的HCOONa和CH3CH2COONa两种溶液的pH比较:前者>后者 D.将0.1 mol/L的HCOOH溶液与0.1 mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO﹣)>c(OH﹣)>c(H+) 二.填空题(共4小题) 21.磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4﹣、HPO42﹣、和PO43﹣四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.下图是H3PO4溶液中,各种粒子的物质的量分数δ 随pH的变化曲线: (1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式 . (2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为 .当pH=7时,溶液中主要存在的阴离子(OH﹣离子除外)是 . (3)从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”、或“中”),其原因是 . (4)在Na3PO4溶液中, 3(填“>”、“═”、或“<”);向该溶液中滴入几滴浓KOH溶液后,的值减小,原因是 . 22.在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如图所示是其电流(I)随新物质加入量(m)的变化曲线. 以上4个导电性实验,其中与A图变化趋势一致的是 ,与B图变化趋势一致的是 ,与C图变化趋势一致的是 . ①Ba(OH)2溶液中滴入H2SO4溶液至过量 ②醋酸溶液中滴入NH3•H2O至过量 ③澄清石灰水中通入CO2至过量 ④NH4Cl溶液中逐渐加入适量NaOH固体. 23.已知苯酚()具有弱酸性,其Ka=1.1×10﹣l0 ;水杨酸第一级电离形成的离子 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸) Ka(苯酚)(填“>”或“<”),其原因是 . 24.醋酸是一种常见的弱酸. 假如某醋酸溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10﹣3mol/L,则此时c(CH3COO﹣)约为 mol/L;计算此时醋酸的电离平衡常数Ka(CH3COOH)= .[注:c平衡(CH3COOH)≈0.10mol/L,水的电离可忽略不计]. 三.解答题(共5小题) 25.现有下列十种物质:①液态氯化氢②小苏打 ③固体纯碱 ④二氧化碳⑤葡萄糖 ⑥氢氧化钾 ⑦氢氧化铁胶体 ⑧氨水 ⑨空气 ⑩硫酸铁溶液 (1)上述十种物质中,属于电解质的有 ,属于非电解质的有 . (2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH﹣=H2O,该反应的化学方程式为 . (3)除去③中少量②的操作是 ,化学方程式为 . (4)标准状况下, L ④中含有0.4mol 氧原子. (5)现有100mL⑩溶液中含Fe3+5.6g,则溶液中SO42﹣的物质的量浓度是 . (6)若在⑦中缓慢加入⑥,产生的现象是 . (7)将①加入到⑧中,⑧的导电能力变化为 (填“增强”、“减弱”或“基本不变”). 26.现有下列物质:①KI ②铜 ③稀硝酸 ④NH3⑤NaHSO4⑥Ba(OH)2⑦氢氧化铁胶体 ⑧氨水 (1)按物质的分类方法填写表格的空白处(填物质编号) 分类标准 电解质 盐 非电解质 混合物 属于该类的物质 (2)上述某两种物质在溶液中可发生离子反应:H++OH﹣═H2O,写出该离子反应对应的化学方程式 . (3)物质①的稀溶液在空气中被氧化,加入淀粉溶液显蓝色,则反应的离子方程式为 . 27.往含0.2mol NaOH和0.1mol Ca(OH)2的混合溶液中持续稳定地通入CO2 气体0.5mol.请以CO2的量为横坐标,以溶液中离子的总量为横坐标,画出离子总量随CO2加入量变化的折线图.(不计弱电解质的电离和盐的水解) 28.硼酸晶体呈片状,有滑腻感,可做润滑剂.硼酸对人体的受伤组织有缓和和防腐作用,故可以用于医药和食品防腐等方面.试回答下列问题: (1)从题目信息可知硼酸应属于 酸(填“弱”或“强”) (2)硼酸的分子式为H3BO3,已知H与O成键,则其分子结构式为: . (3)研究表明:在大多数情况下,元素的原子在形成分子或离子时,其最外层有达到8电子稳定结构的趋向.已知0.01mol硼酸可以被20mL 0.5mol•L﹣1NaOH溶液恰好完全中和,据此推测硼酸在水溶液中呈酸性的原因是(用离子方程式表示) ;写出硼酸与NaOH溶液反应的离子方程式: . (4)硼酸和甲醇在浓硫酸存在的条件下,可生成挥发性硼酸酯,试写出硼酸完全酯化的方程式: . (5)科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列. 如图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上.根据下图确定硼化镁的化学式为 . 29.现代化学传感器技术是研究溶液中离子反应的重要手段,某化学兴趣小组用1.0mol/LNaOH溶液滴定25mL未知浓度的盐酸溶液,并用电导率传感器测定过程中的电导率,通过数据采集器自动记录测得的电导率并绘制电导率﹣ V曲线,可显示滴定过程中的突跃现象(如图所示).对于突跃现象最合理的解释是 . 弱电解质的电离 参考答案与试题解析 一.选择题(共20小题) 1.【分析】在水溶液中或熔融状态下能导电的化合物为电解质,据此分析。 【解答】解:A、可以导电的化合物一定是电解质,但电解质不一定能导电,故A错误; B、可以导电的纯净物不一定是电解质,如金属单质,故B错误; C、酸碱盐等化合物一定是电解质,电解质包括酸碱盐等化合物,故C正确; D、可以溶于水的纯净物不一定是电解质,如乙醇,故D错误。 故选:C。 2.【分析】电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等; 非电解质:在水溶液中和熔融状态下不能导电的化合物;例:有机物,非金属氧化物等; 单质和混合物既不是电解质也不是非电解质。 【解答】解:A.己烷在水溶液中和熔融状态下不能导电的化合物,是非电解质,故A正确; B.蔗糖溶液是混合物,不是非电解质,故B错误; C.氢气为单质,不是非电解质,故C错误; D.氯化镁在水溶液中或熔融状态下能导电的化合物,属于电解质,故D错误; 故选:A。 3.【分析】A.氯气为单质; B.熔融状态下硫酸氢钾电离产生钾离子和硫酸氢根离子; C.电解质溶液导电能力与自由移动的离子浓度,离子带电荷数有关; D.电解质强弱与溶解性无关,与电离程度有关。 【解答】解:A.氯气为单质,既不是电解质也不是非电解质,故A错误; B.只有在溶于水,在水分子作用下KHSO4才能电离成K+、H+和SO42﹣,故B错误; C.电解质溶液导电能力与自由移动的离子浓度,离子带电荷数有关,与电解质强弱无关,故C正确; D.电解质强弱与溶解性无关,与电离程度有关,硫酸钡难溶于水,溶于水的部分完全电离,为强电解质,故D错误; 故选:C。 4.【分析】在水溶液中或熔融状态下能导电的化合物为电解质,常见的电解质包括酸、碱、盐和金属氧化物等。 【解答】解:A、氯化钠溶液是混合物,故不是电解质,故A错误; B、SO3在水溶液中和熔融状态下均不能导电,故是非电解质,故B错误; C、NaOH在水溶液中和熔融状态下均能自身电离出自由移动离子而导电,故为电解质,故C正确; D、Cu是单质,故不是电解质,故D错误。 故选:C。 5.【分析】电解质是指在水溶液或熔化状态下能导电的化合物,强电解质是在水溶液中能完全电离的电解质;水的电离方程式为H2O⇌H++OH﹣,加入的物质或离子能影响水电离平衡的移动,则破坏水的电离,据此分析解答。 【解答】解:A.硫酸钠是强酸强碱盐,为强电解质,不能破坏水的电离,故A错误; B.氯化铝在水中完全电离出自由移动的氯离子和铝离子,所以是强电解质,并且铝离子能与水电离出的氢氧根离子结合生成弱电解质氢氧化铝,促进水的电离,故B正确; C.酒精不能破坏水的电离,故C错误; D.一水合氨是碱,能抑制水的电离,且一水合氨是弱电解质,故D错误; 故选:B。 6.【分析】强电解质:在水溶液中或熔融状态下能完全电离的化合物; 弱电解质:在水溶液中或熔融状态下能部分电离的化合物; 【解答】解:A.硝酸钾在水溶液中或熔融状态下能完全电离,为强电解质,故A选; B.一水合氨为弱碱,水溶液中部分电离,为弱电解质,故B不选; C.醋酸为弱酸,水溶液中部分电离,为弱电解质,故C不选; D.水只能部分电离,属于弱电解质,故D不选; 故选:A。 7.【分析】强电解质:在水溶液中或熔融状态下能完全电离的化合物,要包括:强酸(HCl、H2SO4、HNO3等),强碱(NaOH、KOH等),盐(NaCl,CH3COONa等,除Pb(CH3COO)2,HgCl2外,注意沉淀如CaCO3,BaSO4等由于溶于水的部分已全部电离,属于强电解质),金属氧化物(Na2O,MgO等), 弱电解质:在水溶液中或熔融状态下不能完全电离的化合物。主要包括:弱酸(CH3COOH、H3PO4等)、弱碱(NH3•H2O,Cu(OH)2等)。据此判断。 【解答】解:A.氢氧化铝为弱碱,属于弱电解质,部分电离,故A不选; B.C8H18为非电解质,不能电离,故B不选; C.(NH4)2CO3属于盐,为强电解质,水溶液中能够完全电离,故C选; D.HClO为弱酸,属于弱电解质,部分电离,故D不选; 故选:C。 8.【分析】在水溶液中只能部分电离的电解质为弱电解质,包括弱酸、弱碱和水等,据此分析。 【解答】解:A、NH3•H2O是弱碱,是弱电解质,故A正确; B、CO2在水溶液中和熔融状态下均不能导电,故为非电解质,故B错误; C、乙醇在水溶液中和熔融状态下均不能导电,故为非电解质,故C错误; D、BaSO4在水溶液中虽然溶解度很小,但溶解的能完全电离,故为强电解质,故D错误。 故选:A。 9.【分析】电解质的水溶液中只含一种分子,说明该电解质是强酸、强碱或强酸强碱盐等强电解质,在水溶液里完全电离,且电离出的阴阳离子不发生水解反应。 【解答】解:A.氢氧化钠是强碱,所以溶液中只含有水分子,故A正确; B.氯化铵是强酸弱碱盐,铵根离子能水解生成一水合氨,所以溶液中存在水分子、一水合氨分子,故B错误; C.乙醇是共价化合物,水溶液中存在乙醇分子、水分子,故C错误; D.次氯酸是弱电解质,在水溶液里只有部分电离,所以溶液中存在水分子、次氯酸分子,故D错误; 故选:A。 10.【分析】氯化钠溶于水电离出氯离子和钠离子,在水溶液中形成的是水合钠离子和水合氯离子,氯离子半径大于钠离子的半径,据此分析判断。 【解答】解:氯化钠溶于水电离出氯离子和钠离子,NaCl=Na++Cl﹣,在水溶液中形成的是水合钠离子和水合氯离子,氯离子半径大于钠离子的半径,则A为氯离子,故选C。 11.【分析】①电子层越多,半径越大; ②电子层越多,半径越大; ③根据图象判断; ④Na+带正电荷,Cl﹣带负电荷; ⑤氯化钠溶于水,形成水合离子; ⑥NaCl是强电解质,在溶液中完全电离; ⑦由图可知,钠离子和氯离子周围都存在水分子. 【解答】解:①电子层越多,半径越大,Na+有2个电子层,Cl﹣有3个电子层,所以二者半径不同,故正确; ②电子层越多,半径越大,H原子只有1个电子层,O原子有2个电子层,所以氢和氧的半径不同,故正确; ③由图象可知,Na+周围有5个水分子,Cl﹣周围有6个水分子,所以Na+和Cl﹣周围的水分子数不同,故正确; ④Na+带正电荷吸引显负电性的O原子,Cl﹣带负电荷吸引显正电性的H原子,所以环绕在Na+和Cl﹣周围的水分子的排列方式不相同,故错误; ⑤氯化钠溶于水,形成水合离子,则物质的溶解是在水分子的作用下完成的,故正确; ⑥NaCl是强电解质,在溶液中完全电离,所以溶于水的NaCl完全电离,故错误; ⑦由图可知,钠离子和氯离子周围都存在水分子,即水溶液中的离子是以水合离子的形式存在的,故正确。 故选:A。 12.【分析】A、在T°C时,Kw=c(H+)•c(OH﹣),而c(H+)=,说明溶液中c(H+)=c(OH﹣); B、酸与碱溶液的pH之和等于14,如果碱为强碱,当酸为强酸时,则溶液的pH=7;当酸为弱酸时,酸过量,混合后溶液显酸性,即pH<7,即pH一定不大于7; C、一水合氨为弱碱存在电离平衡,稀释促进水的电离; D、等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多. 【解答】解:A、在T°C时,Kw=c(H+)•c(OH﹣),而c(H+)=,说明溶液中c(H+)=c(OH﹣),所以溶液呈中性,故A正确; B、酸与碱溶液的pH之和等于14,如果碱为强碱,当酸为强酸时,则溶液的pH=7;当酸为弱酸时,酸过量,混合后溶液显酸性,即pH<7,即pH一定不大于7,而弱酸与强碱,所以混合反应后溶液呈酸性,故B正确; C、一水合氨为弱碱存在电离平衡,稀释促进水的电离,将等体积pH均相等的氢氧化钠和氨水溶液加水稀释相同倍数,氨水溶液的pH大,所以稀释后保持pH仍然相等,则氨水加水多,故C正确; D、等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多,而不是一样多,故D错误; 故选:D。 13.【分析】含有自由移动的离子或电子的物质能导电,如石墨、金属单质、熔融状态下的电解质或电解质的水溶液。 【解答】解:A.石墨含有自由移动的电子,所以能导电,故A错误; B.铜合金含有金属,有自由移动的电子,所以能导电,故B错误; C.液态的氯化氢只存在分子,不含自由移动的电子或离子,所以不能导电,故C正确; D.熔融态的氯化钠能电离出自由移动的阴阳离子而使其导电,故D错误; 故选:C。 14.【分析】根据图象分析,当氨水的体积为10ml时导电性最强,说明刚好与醋酸完全反应,所以醋酸的浓度为:=0.1mol•L﹣1,再根据pH=3的 CH3COOH溶液,则氢离子浓度为:10﹣3mol•L﹣1,所以CH3COOH的电离度为=(已电离的电解质的物质的量/原来总的物质的量)×100%进行计算; 【解答】解:根据图象分析,当氨水的体积为10ml时导电性最强,说明刚好与醋酸完全反应,所以醋酸的浓度为:=0.1mol•L﹣1,再根据pH=3的 CH3COOH溶液,则氢离子浓度为:10﹣3mol•L﹣1,所以CH3COOH的电离度为×100%=1%,故选:D; 15.【分析】A.导电能力越强,自由移动离子的浓度越大; B.反应物的总能量小于生成物的总能量,属于吸热反应; C.减小压强反应物和生成物的浓度都减小,v逆瞬间减小,但平衡逆向移动,导致v逆逐渐减小; D.水的电离是吸热的过程,温度越高电离程度越大。 【解答】解:A.导电能力越强,自由移动离子的浓度越大,所以a点氢离子的浓度大于b点,所以图中a点pH小于b点,故A正确; B.反应物的总能量小于生成物的总能量,属于吸热反应,反应A(g)+B(g)→ C(g)+D(g)+QKJ为放热反应,与图象不符,故B错误; C.减小压强反应物和生成物的浓度都减小,v逆瞬间减小,但平衡逆向移动,导致v逆逐渐减小,最终达平衡状态,故C正确; D.水的电离是吸热的过程,温度越高电离程度越大,氢离子和氢氧根离子的浓度越大,所以图中a点对应温度低于b点,故D正确。 故选:B。 16.【分析】物质导电有两种原因,一是金属类有自由移动的电子能够导电,二是能够产生自由离子的溶液能够导电。 【解答】解:A.氯化钠晶体没有自由移动的离子,不导电,故A错误; B.酒精是非电解质,不导电,故B错误; C.冰醋酸中只有分子,没有离子,不导电,故C错误; D.石墨有自由移动的电子,可以导电,故D正确; 故选:D。 17.【分析】A.室温下,pH相同的一元酸,弱酸浓度大于强酸; B.溶液导电性与离子浓度成正比; C.加水稀释促进弱电解质电离; D.中和两份完全相同的NaOH溶液,酸的浓度越大,消耗的酸体积越少。 【解答】解:A.室温下,pH相同的一元酸,弱酸浓度大于强酸,醋酸是弱酸、HCl是强电解质,所以相同pH的盐酸和醋酸,浓度:醋酸>盐酸,故A错误; B.溶液导电性与离子浓度成正比,两种溶液的pH相同,则氢离子浓度相等,溶液导电性相同,故B错误; C.加水稀释促进弱电解质电离,所以加水稀释促进醋酸电离,HCl完全电离,所以稀释相同倍数时氢离子浓度:醋酸>盐酸,则盐酸的pH变化较明显,故C错误; D.中和两份完全相同的NaOH溶液,酸的浓度越大,消耗的酸体积越少,pH相同时酸浓度:醋酸>盐酸,则消耗的盐酸体积小,故D正确; 故选:D。 18.【分析】A.如果NaHA溶液的pH<7,H2A可能是弱酸; B.随着二氧化碳的通入,二氧化碳和水反应生成的碳酸中和一水合氨电离生成的OH﹣而促进一水合氨电离,导致溶液中c(NH4+)增大, =×=; C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)+c(NH4+)=c(Cl﹣)+c(OH﹣)+c (HCO3﹣)+2c(CO32﹣),因为析出部分NaHCO3晶体,所以导致溶液中c(Na+)<c(Cl﹣); D.CaO和水反应生成Ca(OH)2,Ca(OH)2和Na2CO3反应生成CaCO3和NaOH,溶液碱性增强抑制碳酸钠水解,导致溶液中c(H2CO3)减小,=×=,温度不变水解平衡常数不变。 【解答】解:A.如果NaHA溶液的pH<7,H2A可能是弱酸,如NaHSO3溶液pH<7,但是H2SO3是弱酸,故A错误; B.温度不变电离平衡常数不变,随着二氧化碳的通入,二氧化碳和水反应生成的碳酸中和一水合氨电离生成的OH﹣而促进一水合氨电离,导致溶液中c(NH4+)增大,所以=×=减小,故B正确; C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)+c(NH4+)=c(Cl﹣)+c(OH﹣)+c (HCO3﹣)+2c(CO32﹣),因为析出部分NaHCO3晶体,所以导致溶液中c(Na+)<c(Cl﹣),则c(H+)+c(NH4+)>c(OH﹣)+c (HCO3﹣)+2c(CO32﹣),故C错误; D.温度不变水解平衡常数不变,CaO和水反应生成Ca(OH)2,Ca(OH)2和Na2CO3反应生成CaCO3和NaOH,溶液碱性增强抑制碳酸钠水解,导致溶液中c(H2CO3)减小,=×=增大,故D错误; 故选:B。 19.【分析】弱电解质的电离是不完全的,存在电离平衡,弱酸对应的强碱盐,能够水解,常温下pH大于7,以此解答该题。 【解答】解:A.冰醋酸能和氨水反应,表现酸性,不能判断酸性强弱,故A错误; B.冰醋酸加水后导电性增强,说明加水电离,氢离子浓度增大,但不能确定酸性强弱,故B错误; C.醋酸溶液能溶解CaCO3 ,说明醋酸的酸性比碳酸强,不能说明酸性强弱,故C错误; D.醋酸溶液加热后c(CH3COO﹣)变大,说明存在电离平衡,说明醋酸为弱酸,故D正确。 故选:D。 20.【分析】A、图中M、N两点对应溶液中N点的pH大于M点的pH,温度一定水的离子积常数一定; B.根据pH=4.88时,丙酸分子的分布分数为50%计算丙酸的电离平衡常数; C.当pH相同时,酸分子的含量越高,电离平衡常数越小,酸性越弱; D.将0.1mol/L 的HCOOH溶液与0.1mol/L 的HCOONa溶液等体积混合,溶液呈酸性。 【解答】解:A、图中M、N两点对应溶液中N点的pH大于M点的pH,即cM(H+)>cN(H+),温度一定水的离子积常数一定,则溶液中的c(OH﹣)比较:前者<后者,故A错误; B.pH=4.88时,溶液中c(H+)=10﹣4.88mol/L,丙酸分子的分布分数为50%,则c(CH3CH2COOH)=0.05mol/L,所以K===10﹣4.88,故B正确; C.当pH相同时,酸分子的含量越高,电离平衡常数越小,酸性越弱,根据图象,当pH相同时,丙酸的含量较高,则酸性较弱,丙酸的酸性比甲酸弱,所以等浓度的HCOONa和CH3CH2COONa两种溶液的pH比较:前者<后者,故C错误; D.将0.1mol/L 的HCOOH溶液与0.1mol/L 的HCOONa溶液等体积混合,溶液呈酸性,故c(H+)>c(OH﹣),故D错误, 故选:B。 二.填空题(共4小题) 21.【分析】(1)根据P原子守恒分析; (2)根据图象分析,当向溶液中滴加稀盐酸时,溶液中离子的变化判断发生的离子反应;当pH=7时,根据图象确定溶液中存在的阴离子; (3)根据图象分析,当溶液中存在H2PO4﹣时溶液的PH值确定溶液的酸碱性,从而确定H2PO4﹣的电离程度和水解程度的相对大小; (4)先根据磷酸钠盐的类型确定钠离子和磷酸根离子的关系,再根据外界条件对水解平衡的影响分析. 【解答】解:(1)磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4﹣、HPO42﹣、和PO43﹣四种粒子形式存在,无论以何种离子存在,但总的P原子总数与原磷酸中P原子相对, 所以c(总)=c(H3PO4)+c(H2PO4﹣)+c(HPO42﹣)+c(PO43﹣), 故答案为:c(总)=c(H3PO4)+c(H2PO4﹣)+c(HPO42﹣)+c(PO43﹣); (2)根据图象知,当向溶液中滴加稀盐酸时,溶液中H2PO4﹣增加,HPO42﹣减少,所以是溶液中的HPO42﹣和氢离子发生生成H2PO4﹣,离子方程式为:HPO42﹣+H+═H2PO4﹣, 当pH=7时,根据图象知,溶液中存在的阴离子为H2PO4﹣、HPO42﹣, 故答案为:HPO42﹣+H+═H2PO4﹣;H2PO4﹣、HPO42﹣; (3)根据图象知,当溶液中存在H2PO4﹣时,溶液呈酸性,说明H2PO4﹣在溶液中的电离程度大于水解程度,导致溶液中氢离子浓度大于氢氧根离子的浓度, 故答案为:酸;H2PO4﹣在溶液中的电离程度大于水解程度; (4)磷酸钠是强碱弱酸盐,所以弱酸根离子能发生水解,导致溶液中c(Na+)/c(PO43﹣)>3; PO43﹣+H2O⇌HPO42﹣+OH﹣,当向溶液中滴入几滴浓KOH溶液后,根据勒夏特列原理知,水解平衡向逆反应方向移动,所以导致溶液中磷酸根离子的浓度增大,故c(Na+)/c(PO43﹣)的值减小. 故答案为:>;KOH抑制了PO43﹣的水解. 22.【分析】溶液的导电性与离子浓度大小有关,离子浓度越大,溶液导电性越强,结合反应的离子方程式或化学方程式以及电解质的强弱进行判断. 【解答】解:①Ba(OH)2+H2SO4=BaSO4↓+2H2O,滴入H2SO4时,导电性减弱,完全反应后,H2SO4过量,导电性又增强,与B一致; ②CH3COOH+NH3•H2O=CH3COONH4+H2O,导电性增强,但氨水过量后,将溶液稀释,导电性减弱,与A一致; ③Ca(OH)2+CO2=CaCO3↓+H2O,导电性减弱,CO2过量后,CaCO3+CO2+H2O⇌Ca(HCO3)2,Ca(HCO3)2电离使导电性又增强,与B一致; ④NH4Cl+NaOH=NaCl+NH3•H2O,原为强电解质NH4Cl,反应后仍为强电解质NaCl,NH3•H2O影响不大,与C一致, 故答案为:②;①③;④. 23.【分析】水杨酸第一级电离形成的离子能形成分子内氢键,导致水杨酸根离子中酚羟基难电离出氢离子,据此分析解答. 【解答】解:中形成分子内氢键,使该微粒中酚羟基更难电离出H+,导致该微粒酸性小于苯酚,所以相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚), 故答案为:<;中形成分子内氢键,使其更难电离出H+,故Ka2<Ka. 24.【分析】醋酸溶液中存在电离平衡CH3COOH⇌H++CH3COO﹣,由于溶液pH较小,则c(CH3COO﹣)=c(H+),根据K=计算此时醋酸的电离平衡常数. 【解答】解:醋酸溶液中存在电离平衡CH3COOH⇌H++CH3COO﹣,用于溶液pH较小,则c(CH3COO﹣)=c(H+)1.3×10﹣3=mol/L, Ka(CH3COOH)===1.7×10﹣5mol/L, 故答案为:1.3×10﹣3;1.7×10﹣5mol/L. 三.解答题(共5小题) 25.【分析】(1)电解质:在水溶液中或熔融状态下能够导电的化合物; 非电解质:在熔融状态和水溶液中都不能导电的化合物; (2)离子方程式为:H++OH﹣═H2O,可表示强酸与强碱反应生成可溶性盐和水的离子反应; (3)根据碳酸钠加热不分解,碳酸氢钠加热分解得到碳酸钠、水、二氧化碳来解答; (4)根据n=结合分子的构成计算. (5)根据n=计算Fe3+的物质的量,溶液中2n(SO42﹣)=3n(Fe3+),再根据c=计算SO42﹣的物质的量浓度; (6)胶体加入电解质会发生聚沉; (7)电解质溶液导电能力强弱取决于离子浓度的大小,氨水中加入盐酸依据反应物和生成物的性质判断离子浓度的变化进而判断导电能力变化; 【解答】解:(1)①液态氯化氢在水溶液中能导电,是电解质; ②NaHCO3在水溶液或者熔融状态下能够导电,是电解质; ③固体纯碱在水溶液或者熔融状态下能够导电,是电解质; ④葡萄糖在水溶液和熔融状态下都不能够导电,是非电解质; ⑤Ba(OH)2在熔融状态下能导电,是电解质; ⑥氢氧化钾在水溶液或者熔融状态下能够导电,是电解质; ⑦氢氧化铁胶体属于混合物 既不是电解质也不是非电解质; ⑧氨水属于混合物 既不是电解质也不是非电解质; ⑨空气属于混合物 既不是电解质也不是非电解质; ⑩硫酸铁溶液属于混合物 既不是电解质也不是非电解质; 故属于电解质的是:①②③⑥,非电解质的有:④⑤; 故答案为:①②③⑥;④⑤; (2)离子方程式为:H++OH﹣═H2O,可表示强酸与强碱反应生成可溶性盐和水的离子反应,如HCl+KOH=H2O+KCl; 故答案为:HCl+KOH=H2O+KCl; (3)根据碳酸钠加热不分解,碳酸氢钠加热分解得到碳酸钠、水、二氧化碳,所以除去固体纯碱中少量小苏打的操作是加热,方程式为: 故答案为:加热;2NaHCO3Na2CO3+H2O+CO2↑; (4)n(CO2)=n(O)=0.2mol,V(CO2)=0.2mol×22.4L/mol=4.48L; 故答案为:4.48; (5)Fe3+的物质的量为=0.1mol,溶液中2n(SO42﹣)=3n(Fe3+),则SO42﹣的物质的量为0.1mol×=0.15mol,SO42﹣的物质的量浓度为=1.5mol/L; 故答案为:1.5mol/L; (6)若在氢氧化铁胶体中缓慢加入氢氧化钾,胶体发生聚沉,产生的现象是产生红褐色沉淀; 故答案为:产生红褐色沉淀; (7)氨水中的一水合氨是弱电解质,部分电离产生出自由移动的离子浓度较小,加入盐酸后反应生成氯化铵是强电解质,完全电离,所以离子浓度逐渐增大,导电能力逐渐增强, 故答案为:增强; 26.【分析】(1)在水溶液中或熔融状态下能够导电的化合物称为电解质;在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质.大多数的有机物都是非电解质;单质,混合物既不是电解质也不是非电解质; 盐是指由金属离子和酸根离子构成的化合物,是纯净物; 由同种分子构成的物质是纯净物,由不同种分子构成的物质是混合物; (2)H++OH﹣═H2O表示的是可溶性的强酸和可溶性的强碱发生酸碱中和反应生成可溶性的盐的离子方程式,据此解答; (3)碘化钾溶液在空气中被氧化生成碘、氢氧化钾,据此解答. 【解答】解:(1)①⑤⑥都是在水溶液或熔融状态下能导电的化合物,属于电解质; ①⑤都是由金属离子和酸根离子构成的化合物,属于盐; ④氨气自身不能电离出阴阳离子,是非电解质; ③⑦⑧都是由不同种分子构成,属于混合物; 故答案为:①⑤⑥;①⑤;④;③⑦⑧; (2)氯化氢与氢氧化钡反应的离子方程式为:H++OH﹣═H2O;化学方程式为:Ba(OH)2+2HNO3═Ba(NO3)2+2H2O, 故答案为:Ba(OH)2+2HNO3═Ba(NO3)2+2H2O; (3)碘化钾溶液在空气中被氧化的离子方程式为:O2+4I﹣+2H2O═2I2+4OH﹣, 故答案为:O2+4I﹣+2H2O═2I2+4OH﹣. 27.【分析】n(CO2)=0.5mol,通入含有0.2mol氢氧化钠和0.1mol氢氧化钙的溶液中,通入含有0.2molNaOH和0.1molCa(OH)2的溶液中,相当于首先发生:Ca2++2OH﹣+CO2=CaCO3↓,然后发生2OH﹣+CO2=CO32﹣+H2O,再发生CO32﹣+CO2+H2O=2HCO3﹣、继续通入反应CaCO3+CO2+H2O=Ca2++2HCO3﹣,再继续通入二氧化碳溶液中离子物质的量不变,过程中发生的反应为:Ca2++2OH﹣+CO2=CaCO3↓,2OH﹣+CO2=CO32﹣+H2O,OH﹣+CO2+H2O=2HCO3﹣,CaCO3+CO2+H2O=Ca2++2HCO3﹣,以此解答该题. 【解答】解:n(CO2)=0.5mol, 含有0.2mol氢氧化钠和0.1mol氢氧化钙的溶液中:n(OH﹣)=0.2mol+0.1mol×2=0.4mol,n(Na+)=0.2mol,n(Ca2+)=0.1mol, 通入CO2,发生反应的离子方程式:Ca2++2OH﹣+CO2=CaCO3↓,2OH﹣+CO2=CO32﹣+H2O,OH﹣+CO2+H2O=2HCO3﹣,CaCO3+CO2+H2O=Ca2++2HCO3﹣, 通入含有0.2molNaOH和0.1molCa(OH)2的溶液中,相当于首先发生:Ca2++2OH﹣+CO2=CaCO3↓,该阶段0.1molCa(OH)2完全反应消耗0.1molCO2,离子物质的量减少0.3mol,溶液中离子物质的量为0.7mol﹣0.3mol=0.4mol,其中含有0.2molOH﹣、生成0.1molCaCO3; 然后发生2OH﹣+CO2=CO32﹣+H2O,0.2molOH﹣完全反应消耗0.1molCO2,该阶段离子物质的量减少0.1mol,溶液中剩余离子物质的量为0.4mol﹣0.1mol=0.3mol,溶液中含有0.2molNa+、0.1molCO32﹣; 再发生CO32﹣+CO2+H2O=2HCO3﹣、消耗0.1molCO2,溶液中离子物质的量增大0.1mol,为0.2molHCO3﹣,0.2molNa+、共0.4mol离子,继续通入反应CaCO3+CO2+H2O=Ca2++2HCO3﹣,消耗0.1molCO2,溶液中离子物质的量增大0.1moCa2+和0.2molHCO3﹣,溶液中离子为0.7mol,再继续通入二氧化碳溶液中离子物质的量不变, 依据上述分析得到描点坐标为:(0,0.7)(0.1,0.4)(0.2,0.3)(0.3,0.4)(0.4,0.7)(0.5,0.7),描点画出变化的曲线图象为: 答:离子总量随CO2加入量变化的折线图为:. 28.【分析】(1)硼酸对人体的受伤组织有缓和和防腐作用,故可以用于医药和食品防腐等方面,体现了硼酸的性质; (2)硼酸是由非金属元素构成的共价化合物,分子内部全为共价单键; (3)硼酸在水溶液中能电离出氢离子而显酸性,能和氢氧化钠反应; (4)酯化反应的实质是:酸掉羟基醇掉氢,然后生成酯和水; (5)1个B原子为3个Mg原子共用,1个Mg原子为6个B原子共用,可以计算硼原子和镁元自得个数之比. 【解答】解:(1)从题目信息中硼酸的用途:对人体的受伤组织有缓和和防腐作用,可以用于医药和食品防腐等方面,可知其为弱酸,故答案为:弱; (2)由于B原子外层3个电子,而硼酸中H与O成键,即H与O形成羟基,羟基氧原子连接在B原子上,所以每个羟基可以提供1个电子与B原子共用,因此硼酸结构简式为:B(OH)3,结构式为:,故答案为:; (3)硼酸中B原子属于缺电子原子,所以水溶液中可以结合水电离出的氢氧根,破坏水的电离平衡而使溶液显酸性,故答案为:B(OH)3+H2O=B(OH)4﹣+H+;B(OH)3+OH﹣=B(OH)4﹣; (4)在酯化反应中硼酸的三个羟基类似于羧酸中的羟基,﹣OH与甲醇中的氢原子结合生成水,故答案为:B(OH)3+3CH3OH═B(OCH3)3+3H2O; (5)根据投影可知,1个B原子为3个Mg原子共用,故属于一个Mg原子的B原子为;1个Mg原子为6个B原子共用,故用于一个B原子的Mg原子为.由此可知,故硼化镁的化学式为MgB2,故答案为:MgB2. 29.【分析】溶液导电率的大小取决于离子浓度的大小,结合酸碱中和滴定中pH突变的原因、酸碱中和的实质对电导率﹣V曲线分析. 【解答】解:溶液导电率的大小取决于离子浓度的大小,离子浓度越大,导电能力越强.当接近终点时,溶液中离子浓度已非常之小,而加入的氢氧化钠溶液的离子浓度并没有变化,二者相比是非常大的,所以加入一滴离子浓度就会改变很大,出现突变的情况,C点为巧好完全中和的时刻, 故答案为:当接近终点时,一滴氢氧化钠溶液引起了离子浓度的突变.查看更多