2018届二轮复习元素周期表及周期律课件(17张)(全国通用)
题型五 元素周期表及周期律
-
2
-
一
二
三
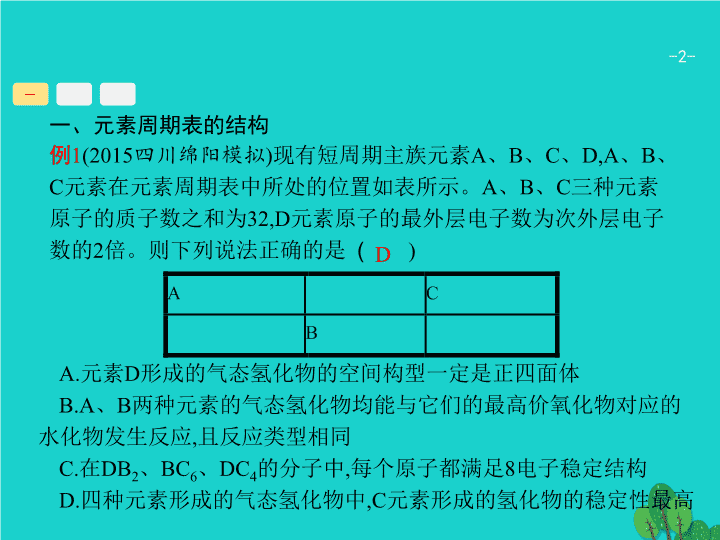
一、元素周期表的结构
例
1
(2015
四川绵阳模拟
)
现有短周期主族元素
A
、
B
、
C
、
D,A
、
B
、
C
元素在元素周期表中所处的位置如表所示。
A
、
B
、
C
三种元素原子的质子数之和为
32,D
元素原子的最外层电子数为次外层电子数的
2
倍。则下列说法正确的是
(
)
A.
元素
D
形成的气态氢化物的空间构型一定是正四面体
B.A
、
B
两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物发生反应
,
且反应类型相同
C.
在
DB
2
、
BC
6
、
DC
4
的分子中
,
每个原子都满足
8
电子稳定结构
D.
四种元素形成的气态氢化物中
,C
元素形成的氢化物的稳定性最高
D
-
3
-
一
二
三
解析
设
A
的质子数为
n
,
由
A
、
B
、
C
的位置关系可知
,B
的质子数为
n
+9,C
的质子数为
n+
2,
即
n
+(
n
+9)+(
n
+2)=32,
解得
n
=7,
可知
A
、
B
、
C
分别是
N
、
S
、
F;D
元素原子的最外层电子数为次外层电子数的
2
倍
,
则
D
为碳元素
(C)
。碳元素的氢化物有多种
,
如
CH
4
、
C
2
H
6
、
C
2
H
4
,
不一定是正四面体
,A
项错误
;NH
3
与
HNO
3
发生的反应为非氧化还原反应
,H
2
S
与浓硫酸发生的反应为氧化还原反应
,B
项错误
;CS
2
、
CF
4
均能满足
8
电子稳定结构
,SF
6
中的硫
(S)
原子不能满足
8
电子稳定结构
,C
项错误
;
由于氟元素是最活泼的非金属元素
,
其氢化物的稳定性最高
,D
项正确。
-
4
-
一
二
三
解题指导
解答此类题目关键在于熟悉元素周期表的结构。
①
元素周期表中的第一周期只有
H
和
He
两种元素
,H
所在的第
Ⅰ
A
族为元素周期表的左侧边界
,
第
Ⅰ
A
族左侧无元素分布
;
②
He
为
0
族元素
,0
族元素为元素周期表的右侧边界
,0
族元素右侧没有元素分布
;
③
第
Ⅱ
A
族和第
Ⅲ
A
族中间间隔
10
列
,
分别位于周期表的第
2
列和第
13
列。
-
5
-
一
二
三
-
6
-
一
二
三
对点训练
1
(2015
江西南昌联考
)
短周期元素
X
、
Y
、
Z
、
W
在元素周期表中的相对位置如图所示
,
其中
Z
为地壳中含量最高的金属元素。下列说法正确的是
(
)
A.
元素
X
的最高正化合价与
W
的最高正化合价相同
B.
工业上电解
ZW
3
饱和溶液冶炼金属
Z
C.
简单离子半径的大小顺序
:
r
(Y
+
)>
r
(X
-
)
D.Y
、
W
的最高价氧化物对应水化物均能溶解金属
Z
答案
解析
解析
关闭
Z
为地壳中含量最高的金属元素
,
故
Z
为
Al,
由位置关系可得
X
为
F,Y
为
Na,W
为
Cl
。
F
无正化合价
,A
项错误
;
不能用电解
AlCl
3
溶液的方法冶炼金属
Al,B
项错误
;Y
+
与
X
-
核外电子排布相同
,
核电荷数大的半径小
,
即
r
(Y
+
)<
r
(X
-
),C
项错误。
答案
解析
关闭
D
-
7
-
一
二
三
二、元素的
“
位
—
构
—
性
”
的关系
例
2
(2015
山东枣庄质检
)W
、
X
、
Y
、
Z
是短周期元素
,
其部分性质如下表
,
下列说法正确的是
(
)
A.Z
的氧化物属于碱性氧化物
B.
离子半径
:Z>W
C.
最高价氧化物对应水化物的碱性
:Y>Z
D.
气态氢化物的热稳定性
:X>W
答案
解析
解析
关闭
根据题目信息判断
,W
、
X
、
Y
、
Z
分别为
S
、
Si
、
Na
、
Al
。
Al
2
O
3
是两性氧化物
,A
项错误
;
r
(Al
3+
)<
r
(S
2-
),B
项错误
;
碱性
:
NaOH
>Al(OH)
3
,C
项正确
;
热稳定性
:SiH
4
r
(Na
+
)
r
(Fe
)>
r
(Fe
2+
)
“
二看
”
核电荷数
:
当电子层数相同时
,
核电荷数越大
,
半径越小。
例
:
r
(Na
)>
r
(Mg
)>
r
(Al
)>
r
(Si
)>
r
(P
)>
r
(S
)>
r
(Cl
)
r
(O
2-
)>
r
(F
-
)>
r
(Na
+
)>
r
(Mg
2+
)>
r
(Al
3+
)
“
三看
”
核外电子数
:
当电子层数和核电荷数均相同时
,
核外电子数越多
,
半径越大。
例
:
r
(Cl
-
)>
r
(Cl
)
r
(Fe
2+
)>
r
(Fe
3+
)
-
10
-
一
二
三
2
.
由
10
电子微粒中的
CH
4
、
NH
3
、
H
2
O
、
HF
分别失去一个
H
剩余的
—CH
3
、
—NH
2
、
—OH
、
—F
为
9
电子微粒
,
两两组合得到的物质如
CH
3
CH
3
、
CH
3
OH
、
H
2
O
2
、
N
2
H
4
、
F
2
等则为
18
电子微粒。
-
11
-
一
二
三
对点训练
2
(2015
重庆模拟
)
现有原子序数依次递增的
M
、
R
、
X
、
Y
、
Z
五种短周期元素
,M
原子的最外层电子数等于其电子层数
;R
原子的最外层电子数是其电子层数的
2
倍
;X
原子的最外层电子数是其电子层数的
3
倍
;Y
原子的最外层电子数是内层电子总数的
3.5
倍
;Z
与
X
同主族
,
最外层电子数比内层电子总数少
4
。甲、乙、丙、丁
4
种物质分别含上述五种元素中的
1
种、
2
种或
3
种
,
四种物质的分子中均含
18
个电子。各物质的结构或性质信息如表所示
:
-
12
-
一
二
三
下列推断合理的是
(
)
A.
甲的钠盐溶液显碱性
,
只能与酸反应
B.
乙与水发生的置换反应中
,
乙作还原剂
,
被氧化
C.
丙分子中既含有极性共价键
,
又含有非极性共价键
,
是非极性分子
D.
用丁制造的碱性燃料电池中正极发生的反应为
答案
解析
解析
关闭
答案
解析
关闭
-
13
-
一
二
三
三、元素周期律与化学键
例
3
(2015
湖北武汉检测
)X
、
Y
、
Z
、
W
是原子序数依次增大的短周期元素。已知
X
原子的最外层电子数是其所在周期数的
2
倍
,X
单质在
Y
单质中充分燃烧生成其最高价化合物
XY
2
,Z
+
与
Y
2-
具有相同的电子数
,W
与
Y
同主族。下列说法正确的是
(
)
A.W
在元素周期表中位于第三周期第
Ⅳ
A
族
B.X
的最简单气态氢化物的热稳定性比
Y
的强
C.
由
X
、
Y
、
Z
三种元素组成物质的水溶液一定呈碱性
D.
由
Y
、
Z
两种元素组成的离子化合物
,
其阳离子与阴离子个数比不一定为
2
∶
1
答案
解析
解析
关闭
X
原子的最外层电子数是其所在周期数的
2
倍
,
符合题意的元素有
C
、
S,
但
S
充分燃烧不能得到最高价化合物
XY
2
,
故
X
为
C,Y
为
O,Z
+
与
Y
2-
具有相同的电子数
,
故
Z
为
Na,W
与
Y
同主族
,
且为短周期元素
,
故
W
为
S
。
S
位于周期表中第三周期
ⅥA
族
,A
项错误
;CH
4
的热稳定性比
H
2
O
的弱
,B
项错误
;X
、
Y
、
Z
三种元素组成的物质为
Na
2
CO
3
,
水溶液呈碱性
,C
项正确
;Y
、
Z
两元素组成的离子化合物为
Na
2
O
或
Na
2
O
2
,
其阳离子与阴离子个数比均为
2
∶
1,D
项错误。
答案
解析
关闭
C
-
14
-
一
二
三
解题指导
本题依据元素周期表
“
位
—
构
—
性
”
的关系推断元素
,
然后根据相关的规律作答。
方法拓展
1
.
离子化合物与共价化合物的比较
-
15
-
一
二
三
(1)
离子化合物中一定含有离子键
,
可能含有共价键
,
如
NaOH
、
Na
2
O
2
等
,
共价化合物中只含有共价键
,
不可能含有离子键。
(2)
金属与非金属元素组成的化合物不一定是离子化合物
,
如
AlCl
3
为共价化合物。全由非金属元素组成的化合物不一定为共价化合物
,
如
NH
4
Cl
为离子化合物。
2
.
失电子难的元素得电子能力不一定强
,
如稀有气体元素。最高正化合价和最低负化合价绝对值相等的元素不一定是
Ⅳ
A
族元素
,
如
H
。绝大多数非金属元素的最高正化合价和它的最低负化合价的绝对值之和等于
8,
但
H
、
O
、
F
等例外。
-
16
-
一
二
三
对点训练
3
(2015
河北衡水中学检测
)
现有
X
、
Y
、
Z
、
W
四种短周期主族元素
,
原子半径
X>Y>Z>W,X
、
Y
、
Z
处于同一周期
,Z
、
W
处于同一主族
,X
、
Y
、
Z
的原子序数之和为
40,
最外层电子数之和为
10,
下列说法正确的是
(
)
A.Y
的最高价氧化物对应的水化物一定是强碱
B.Z
一定位于
ⅦA
族
C.
若
X
、
Y
、
W
形成的化合物为
XYW
2
,
则其水溶液显碱性
D.X
与足量的
W
反应生成的化合物为
X
2
W
C
-
17
-
一
二
三
解析
本题中
X
、
Y
、
Z
处于同一周期
,
因此内层电子数相等
,
由于原子序数等于内层电子数与最外层电子数之和
,
结合题给条件可确定
X
、
Y
、
Z
的内层电子数均为
10,
故均为第三周期元素
,
结合原子半径的大小关系可得
4
种元素在周期表中的位置关系如图所示
,
再结合
X
、
Y
、
Z
原子最外层电子数之和为
10
可推测有多种可能
,
如
Na
、
Mg
、
Cl
;
Mg
、
Al
、
P;Na
、
Al
、
S
等
,
因此选项
A
、
B
、
D
三项均错误
;
若
X
、
Y
、
W
形成的化合物为
XYW
2
,
是
NaAlO
2
,NaAlO
2
在溶液中水解显碱性
,
选项
C
正确。