山东省中学联盟2021届高三上学期12月大联考化学试题 Word版含答案
1
山东中学联盟 2021届高三大联考
化学试题
2020.12
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题
卡上。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:N 14 O 16 Na 23 C1 35.5 Cr 52 Fe 56 Cu 64
一、选择题:本题共 10小题,每小题 2分,共 20分。每小题只有一个选项符合题目要求。
1.新型冠状病毒正威胁着人们的身体健康,各种防护防控措施中,化学知识起到了重要
作用。下列有关说法错误的是
A.冷链运输和冷藏储存抗病毒疫苗,目的是避免蛋白质变性
B.体积分数为 75%的医用酒精,与“84”消毒液混合使用消毒效果更好
C.新冠病毒可能通过气溶胶传播,加快扩散速率,气溶胶能产生丁达尔效应
D.医用防护服的核心材料是微孔聚四氟乙烯薄膜,其单体四氟乙烯所有原子共平面
2.实验室中下列做法错误的是
A.将石蜡油蒸气分解得到的气体通入溴水中,溴水退色,且分层
B.配制 Na2SO3溶液时,用新煮沸过并冷却的 NaOH溶液溶解 Na2SO3固体
C.向含有 FeC13的MgC12溶液中,加入氧化镁调 pH,搅拌、过滤可除去 Fe3+
D.用镊子取绿豆粒大小的钠迅速投入盛有 10mL水(含酚酞)的试管中,观察现象
3.下列有关物质性质与应用的对应关系正确的是
4.设 NA为阿伏加德罗常数的值,下列说法一定正确的是
A.标准状况下,2.24L C4H8分子中的 键的数目为 1.1NA
B.4.6gNa在空气中反应完全生成 Na2O、Na2O2,转移电子数为 0.2NA
C.室温下,pH=5的醋酸溶液中,由水电离的 H+离子数目为 10-9NA
D.电解 CuSO4溶液时,当阴极产生 3.2g O2时,转移的电子数为 0.4NA
2
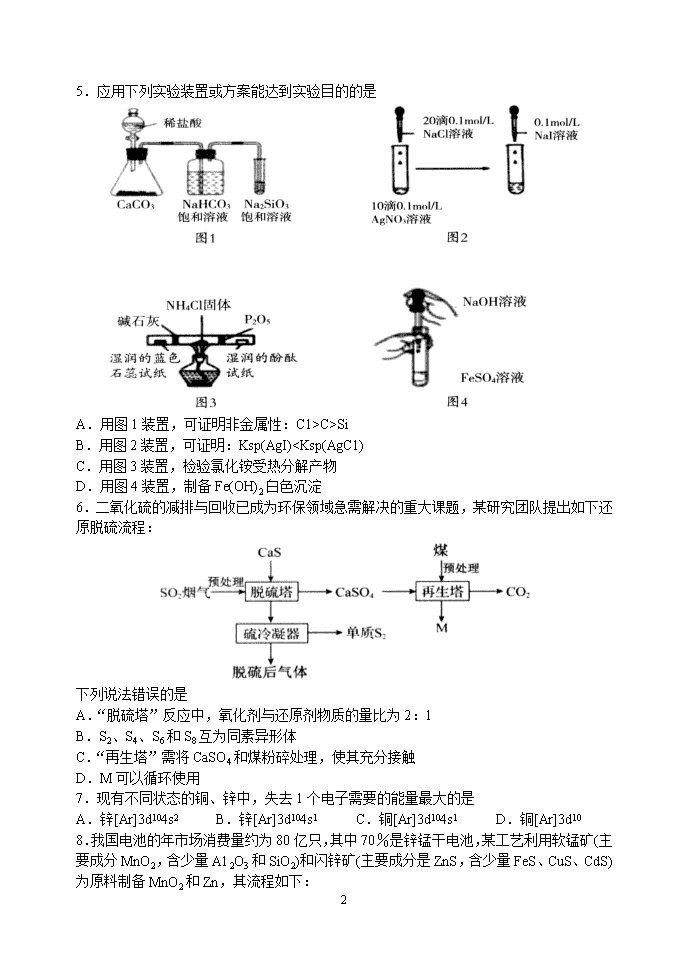
5.应用下列实验装置或方案能达到实验目的的是
A.用图 1装置,可证明非金属性:C1>C>Si
B.用图 2装置,可证明:Ksp(AgI)
C>A
B.若 B单质为淡黄色固体,则含氧酸酸性:C>B
C.若 B单质为无色无味气体,则 B的氢化物可能含有非极性键
D.由 A、B、C三种元素只能形成共价化合物
10.中科大电化学研究团队用 HC1—
CuC12混合溶液做腐蚀液,处理工业废铜,
提升经济效益,其方法如下图所示,水在
BDD 电极上生成一种具有强氧化性的羟
基自由基(HO·),下列有关说法错误的是
A.X为盐酸
B.BDD电极反应式:H2O—e-=HO·+H+
C.蚀铜槽中发生的反应:CuC12+Cu+4HC1=2H2CuC13
D.当 SS 电极生成 32gCu 时,将交换 1molC1—
到 BDD 电极区域
4
二、选择题:本题共 5小题,每小题 4分,共 20分。每小题有一个或两个选项符合题目
要求,全部选对得 4分,选对但不全的得 2分,有选错的得 0分。
11.下列操作不能达到实验目的的是
12.某学校实验小组发现,可用如下两种方法制备MnO4-:
① NaBiO3( 铋 酸 钠 ) 和 稀 硫 酸 酸 化 的 MnSO4 溶 液 :
5NaBiO3+2Mn2++14H+=5Na++5Bi3++2MnO4-+7H2O;
②PbO2与稀硫酸酸化的MnSO4溶液:
5PbO2+2Mn2++4H++5SO42-==2MnO4-+5PbSO4+2H2O
下列有关说法正确的是
A.NaBiO3中 Bi原子采用 sp3杂化
B.NaBiO3可与浓盐酸发生反应:NaBiO3+HC1=HBiO3+NaC1
C.PbO2可与硫酸酸化 FeSO4发生反应:PbO2+2Fe2++4H+=Pb2++2H2O+2Fe3+
D.均制备 1mol MnO4-,两种方法转移的电子数和消耗氧化剂物质的量均相同
13.南京大学研究发现电化学“大气固碳”
有效方法,电池工作原理示意图如图所示。
充电时,利用催化剂的选择性,阳极电极反
应式为:2Li2CO3—e-=2CO2+O2+4Li+,下列
有关说法正确的是
A.放电时,M电极的电势比 N电极的高
B . 放 电 时 , 正 极 电 极 反 应 式 :
3CO2+4e-+4Li+=C+2Li2CO3
C.充电时,M 电极接外电源负极,电解质可选含 Li+
水溶液
D.该电池每放电、充电一次,若均转移 2mol 电子,
理论上能固定标准状况下 11.2LCO2
14.常温下,用 NaOH溶液滴定某二元弱酸 H2A溶液,
溶液中—1g[c(H+)/c(H2A)]和—1gc(HA-)或—lg[c(H+)
/c(HA-)]和—lgc(A2-)关系如图所示,下列说法正确的是
A.水的电离程度:M点>N点
B.滴定过程中,当 pH=5 时,c(Na+)—3c(HA-)<0
C.若 c(HA-)>c(A2-)>c(H2A),则 pH范围 3.5c(H2PO2-)>c(OH-)>c(H+)(2分)
(3)降低 NaH2PO2溶解度,使其析出,与杂质分离 (1分) 乙醚 (1分)
(4)2Ni2++H2PO2-+2H2O=2Ni+H3PO4+3H+ (2分) 700 (2分)
17、(1)5种 (1分) 4种 (1分)
(2)(CH3)2NH (1 分)(CH3)2NH 中甲基数目多,供电强,N 原子形成的氢键强,同时
(CH3)2NH分子量大,范德华力强,其沸点更高 (2分) 小于 (1分)
(3)22 (2分)
(4)8 (2分);
310
206
10 Aa N
(2分)
18、(1)① 800 (2分) ②165.17 (2分)
(2)①K(C)>K(A)>K(B) (1分), 75% (1分) ② d (2分)
(3)④ (1分) ③ (1分) 100 (2分)
19、(1)三口烧瓶(三颈烧瓶)(1分)平衡压强,使浓赴酸或浓硝酸顺利滴下;防止浓盐酸或
浓硝酸挥发出气体污染环境(2分)
(2)fg→cb(1分) bc←ed (1分)cb→m(1分) 充满黄绿色气体 (2分)吸收反应放出的热量,
降低体系温度,使 NOC1(业硝酰氯)转化为液体,收集产品 (2分)
(3)
1 20.655c V V
m
100% (2分)
20、(1)4[FeO·Cr2O3]+8Na2CO3+7O2 高温 8Na2CrO2+2Fe2O3+8CO2↑(2分) Fe2O3(1分)
(2)C (1分) H2SiO3、A1(OH)3(1分)
(3)Cr2O72-+3H2C2O4+8H+=2Cr3++6CO2↑+7H2O(2分)
Cr3++3HCO3-=Cr(OH)3+3CO2↑(2分)
(4)蒸发浓缩,降温结晶 (1分) (5)28.5(1-a%)3 (2分)
10