- 2021-07-08 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】河南省鹤壁市高级中学2019-2020学年高一适应性月考(6月)试题
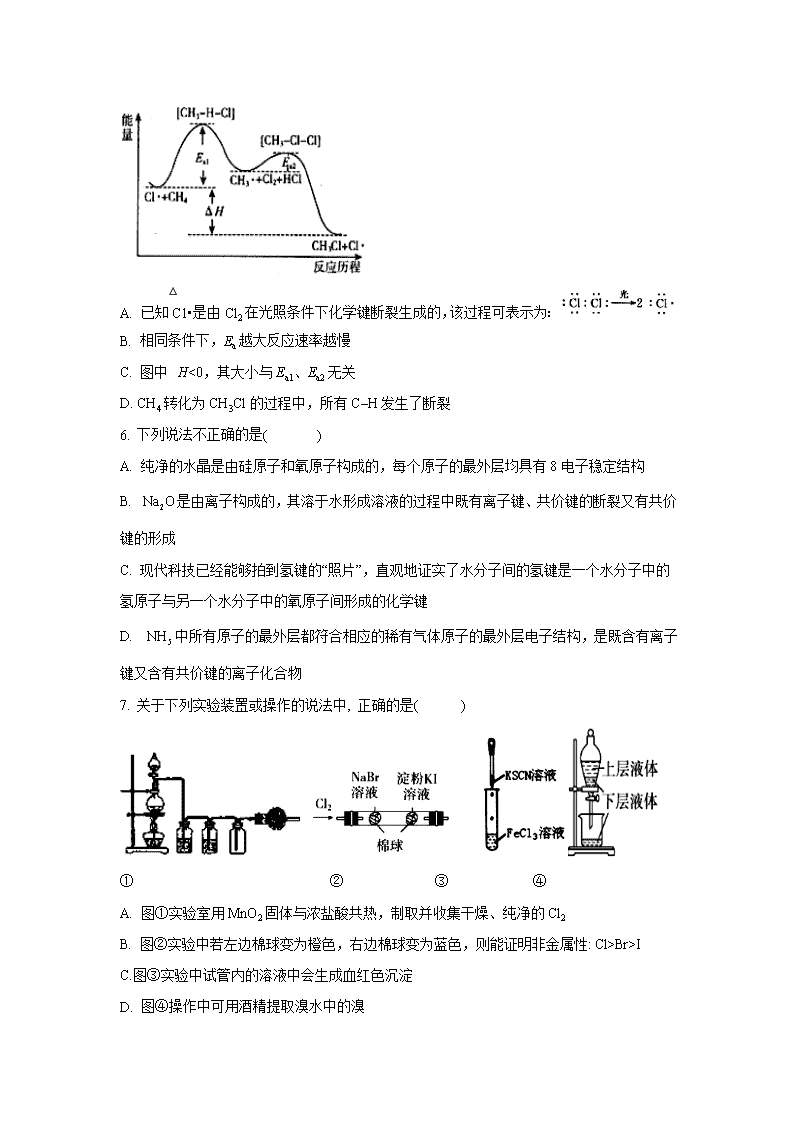
河南省鹤壁市高级中学2019-2020学年高一适应性月考(6月)试题 本试卷满分100分,考试时间90分钟 可能用到的相对原子质量:H-1 C-12 N-14 O-16 第I卷(选择题,共50分) 一、单选题(每题只有一个选项符合题意, 1-10每小题2分, 11-20每小题3分,共50分) 1. 有5种微粒,它们分别是Z、X、M、、,则它们所属元素的种类有( ) A. 2种 B. 3种 C. 4种 D. 5种 2.《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”下列说法错误的是( ) A.“石碱”中含有离子键 B.“石碱”是离子化合物 C.“石碱”中含有极性共价键 D.“石碱”中含有非极性共价键 3. 闪烁着银白色光泽的金属钛(22Ti)因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域,号称“崛起的第三金属”。已知钛有48Ti、49Ti、50Ti等同位素, 下列关于金属钛的叙述中不正确的是( ) A. 上述钛原子中,中子数不可能为22 B. 钛元素在元素周期表中处于第四周期 C. 钛的不同同位素在元素周期表中处于不同的位置 D. 钛元素属于过渡元素 4. 下列陈述的知识正确的是( ) A. C2H6与C3H8互为同系物,C2H4与C3H6也一定互为同系物 B. 一种化合物不是电解质就一定是非电解质 C. 离子化合物中可能含有共价键,共价化合物中也可能含有离子键 D. 常温常压下,H2O是液态,H2S是气态,说明H2O的热稳定性更好 5. CH4与Cl2生成CH3Cl的反应过程中,中间态物质的能量关系如下图所示(Ea表示活化能),下列说法不正确的是( ) A. 已知C1•是由Cl2在光照条件下化学键断裂生成的,该过程可表示为: B. 相同条件下,Ea越大反应速率越慢 C. 图中△H<0,其大小与Ea1、Ea2无关 D. CH4转化为CH3Cl的过程中,所有C–H发生了断裂 6. 下列说法不正确的是( ) A. 纯净的水晶是由硅原子和氧原子构成的,每个原子的最外层均具有8电子稳定结构 B. 是由离子构成的,其溶于水形成溶液的过程中既有离子键、共价键的断裂又有共价键的形成 C. 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 D. 中所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,是既含有离子键又含有共价键的离子化合物 7. 关于下列实验装置或操作的说法中, 正确的是( ) ① ② ③ ④ A. 图①实验室用MnO2固体与浓盐酸共热,制取并收集干燥、纯净的Cl2 B. 图②实验中若左边棉球变为橙色,右边棉球变为蓝色,则能证明非金属性: Cl>Br>I C.图③实验中试管内的溶液中会生成血红色沉淀 D. 图④操作中可用酒精提取溴水中的溴 8.元素周期表中短周期主族元素W、X、Y、Z ,原予序数依次增大,W的液态单质应用于航天领域,是火箭起飞的重要燃料; X元素原子的最外层电子数是内层电子数的3倍; 元素Y在自然界中只能以化合态存在,而且元素Y在组成海水盐类物质的所有元素中 ,质量分数为第二; Z元素原子在同周期中原子半径最小。下列说法错误的是( ) A. Z的单质与W、Y的单质都能反应,且反应中Z的单质都作氧化剂 B. X的单质与Y的单质在常温条件下反应生成化合物甲,用电子式表示甲的形成过程为: C. Y 与W可以形成原子个数比为1:1的化合物乙,且乙与水反应有气体产生 D. W 与X形成的含有极性共价键的化合物不只有一种 9. 下列说法能说明反应2HI(g)H2(g)+I2(g)已达到平衡状态的是( ) ① 单位时间内生成n mol H2的同时生成n mol HI ② 一个H-H键断裂的同时有两个H-I键断裂 ③ 当v正(HI)=2v逆(I2)时 ④ 反应速率:v(H2)=v(I2)=0.5v(HI) ⑤ 当c(H2):c(I2):c(HI)=1:1:2时 ⑥ 温度和体积一定时,某一生成物浓度不再变化 ⑦ 温度和体积一定时,容器内压强不再变化 ⑧ 温度和体积一定时,混合气体的平均相对分子质量不再变化 ⑨ 温度和体积一定时,混合气体的颜色不再发生变化 ⑩ 温度和压强一定时,混合气体的密度不再发生变化 A. ② ③ ⑥ ⑨ B. ① ② ⑤ ⑨ ⑩ C. ③ ⑥ ⑦ ⑩ D. ② ⑥ ⑧ ⑨ 10. 工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)Si(s)+4HCl(g)△H=+QkJ/mol(Q>0),等温、恒压条件下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( ) A. 反应过程中,若充入与反应无关的气体,由于保持压强不变,则反应速率不变 B. 若反应开始时为1mol,则达平衡时,吸收热量为QkJ C. 当反应吸收热量为时,生成的HCl通入 的NaOH溶液恰好完全反应 D. 反应至4min时,若HCl浓度为,则0~4min内的反应速率为0.03moL/(L∙min) 11. 一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷(C2H6)和氧气,其中某一电极反应式为:C2H6+18OH--14e-=2CO32-+12H2O。有关此电池的推断不正确的是( ) A. 通入乙烷的电极为负极 B. 放电一段时间后,KOH的物质的量浓度将下降 C. 参加反应的O2与C2H6的质量比为32:105 D.溶液中的OH-向负极移动 12. 下列说法错误的是( ) A. 烷烃的通式为CnH2n+2,随n值的增大,碳元素的质量分数逐渐增大 B. 分子式为C2H6和分子式为C5H12的烷烃的一氯代物的数目不可能相同 C. 丙烷的球棍模型为 D. 属于同种物质 13. 固态或气态碘分别与氢气反应的热化学方程式如下: ① H2(g) +I2(?)2HI(g) ΔH1= -9.48kJ/mol ② H2(g) +I2(?)2HI(g) ΔH2= +26.48kJ/mol 下列判断不正确的是( ) A. ①中的I2为气态,②中的I2为固态 B. ②的反应物总能量比①的反应物总能量低 C. 反应①的产物比反应②的产物热稳定性更好 D. 1mol固态碘升华时将吸热35.96kJ 14. 向一支大试管中加入5mL 0.1mol·L-1 KI溶液和1mL0.1mol·L-1 FeCl3溶液,用力振荡,为证明I-与Fe3+可发生可逆反应,下列实验设计不正确的是( ) A. 取少量反应后的溶液于试管中,滴加淀粉溶液,观察现象 B. 取少量反应后溶液于试管中,滴加0.1mol·L-1 KSCN溶液,观察现象 C. 取少量反应后溶液于试管中,滴加K3[Fe(CN)6]溶液(该溶液与Fe2+反应能产生蓝色沉淀),检验是否有Fe2+生成 D. 取少量反应后溶液于试管中,滴加AgNO3溶液,观察现象 15. 、CO与体系中存在如图甲、乙所示的物质转变和能量关系。 下列说法错误的是( ) A. 由图甲可知,反应过程中存在 B. 在反应中作催化剂,能降低反应的活化能 C. 若已知与均小于0,则可知与也均小于0 D. 由图乙可知,反应的 16. 下列离子方程式书写正确且能合理解释事实的是( ) A. 将铜丝插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O B. 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时问后,溶液变蓝: 4H+ +4I-+O2=2I2 +2H2O C. 向Mg(HCO3)2溶液中加入过量NaOH溶液,产生白色沉淀: Mg2++2HCO3-+2OH-=MgCO3↓+2H2O D. 向含0.1 mol FeBr2的溶液中通入0.1 mol Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- 17. 利用人工模拟光合作用合成甲酸的原理为2CO2+2H2O=2HCOOH+O2,装置如图所示,下列说法不正确的是( ) A. 该装置能将太阳能转化为化学能和电能 B. 电子由电极1经过负载流向电极2 C. 电极2的反应式:CO2+2H++2e-=HCOOH A. 电极1周围pH增大 18. 在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表,下列判断不正确的是( ) T/K T/K v/mmol∙L-1∙min-1 c/mol∙L-1 0.600 0.500 0.400 0.300 318.2 3.60 3.00 2.40 1.80 328.2 9.00 7.50 a 4.50 b 2.16 1.80 1.44 1.08 A. a=6.00 B. 同时改变反应温度和蔗糖的浓度, 可能不变 C. b<318.2 D. 不同温度时,蔗糖浓度减少一半所需的时间相同 19. 3mol A和2.5mol B混合于2 L恒容的密闭容器中,保持温度不变发生的反应如下: 3A(g)+B(g) xC(g)+2D(g),反应5min达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论正确的是( ) A. A的平均反应速率为0.15mol/(L·s) B. 平衡时,B的转化率为20% C.平衡时,C的浓度为0.125mol/L D. 平衡时,容器内压强为原来的0.8倍 20. 1mol某烷烃在氧气中充分燃烧,需要消耗氧气246.4L(标准状况下),该烷烃在光照的条件下与氯气反应能生成4种不同的一氯取代物,该烃的结构简式是( ) A. B. CH3 CH2 CH2 CH2 CH3 C. D. 第II卷(非选择题 共50分) 二、 填空题(50分) 21. (10分)下列各组物质中,互为同位素的是__________(填写序号,下同),互为同素异形体的是__________,互为同分异构体的是__________,是同一种物质的是__________,属于同系物的是__________。 ① H-O-C≡N与H-N=C=O ② CuSO4与CuSO4∙5H2O ③ H2O与D2O ④ H、D与T ⑤ O2与O3 ⑥ CH3CH2CH3 与CH3CH2CH2 CH3 ⑦ CH3CH2CHO与 ⑧ CH3-CH2-CH=CH2 与CH3-CH=CH-CH3 ⑨与 22.(10分)有A、B、C、D、E五种前四周期元素,原子序数依次增大。A为自然界中形成化合物种类最多的元素;C为地壳中含量最多的元素;D与A为同主族元素,且原子的质子数相差8;E是日常生活中用途最广、用量最大的金属元素。请回答下列问题: (1) A的一种同位素具有放射性,在考古学上常用来测定文物的历史年代,写出该核素的符号:_____________。 (2) B的简单气态氢化物的电子式为___________________,若用玻璃棒蘸取浓盐酸靠近盛满该气体的集气瓶瓶口,则观察到的现象为________________________。 (3) C元素有、、三种核素,这三种核素的质子数之和为___________。 (4) D元素在元素周期表中的位置为_______________________,写出工业上制备含少量杂质的D单质的化学方程式:______________________________________。 (5) 写出少量E的单质与B的最高价氧化物对应的水化物的稀溶液反应的离子方程式:_____________________________________________________。 23.(10分)工业制备硫酸的主要反应之一为SO2与O2反应生成SO3。请回答下列问题: (1)SO2与O2反应生成SO3的反应过程的能量变化如图1所示。由图中曲线变化可知,该反应为__________(填“放热”或“吸热”)反应。 (2)其他条件不变时,不同温度下SO2的转化率随时间的变化情况如图2所示T1___________(填“>”或“<”)T2。 (3)某次实验中,在容积为2L的恒温恒容密闭容器中通入2mol SO2和b mol O2,反应过程中部分物质的物质的量随反应时间的变化如图3所示。 ①甲为__________(填化学式,下同),乙为__________。 ②SO2与O2生成SO3的反应是_______反应。(填“可逆”或“不可逆”) ③10 min时,________。(填“>”、“<”或“ = ”) ④从反应开始到平衡,反应速率__________。 ⑤当b=________时,O2与SO2的转化率相等。 ⑥反应达到平衡时,SO2的转化率为___________。 24.(10分)某兴趣小组用如图所示装置进行实验,探究铁和浓硫酸反应的产物及性质。(夹持装置已略,气密性已检验) 实验开始前,先打开活塞K通一段时间N2。关闭活塞K后,向A中滴加一定量的浓硫酸,加热观察到A中铁片上有气泡产生。 请回答下列问题: (1) 仪器a的名称是___________。实验开始前,先通一段时间N2的目的是________________________________________________________。 (1) 加热一段时间后发现B装置中溶液褪色,说明有_________(填化学式)生成。再取出A中反应后的溶液少许,加入KSCN溶液未出现血红色,浓硫酸与铁反应的化学方程式是________________________________________________________。 (2) C装置中______(填“有”或“无”)沉淀生成。D装置中溶液紫色褪去,该反应的离子方程式为________________________________________________________。 (3) E装置的作用是____________________________。(用离子方程式表示) 25.(10分)CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义。 (1)金刚石和石墨燃烧反应中的能量变化如下图所示。在通常状况下,金刚石和石墨中,__________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH为_________________。 (2)采用电化学法可将二氧化碳转化为甲烷,试写出以氢氧化钾水溶液作电解质溶液时,该转化的电极反应式为_________________________________________________。 (3)以CO2为原料还可以合成多种物质。工业上常以CO2(g)与H2(g)为原料合成乙醇。 ①已知:H2O(l)=H2O(g) △H= +44kJ·mol-1 CO(g)+H2O(g)CO2(g)+H2(g) △H= -41.2kJ·mol-1 2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1 则:CO2气体与氢气反应生成气态乙醇和液态水的热化学方程式为________________________________________________________________________。 ②下图是一种以烟道气为原料合成乙醇的工作原理示意图。对该流程的分析,下列说法正确的是__________。 A.该流程至少包含4种形式的能量转化 B. 装置X中为了增强水的导电性,通常向其中加入少量Na2SO4或NaOH C. 合成塔中生成乙醇的反应是化合反应 D. 流程设计体现了绿色化学思想 ③如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。该电池负极的电极反应式为 。 【参考答案】 1、 单选题(每题只有一个选项符合题意, 1-10每小题2分, 11-20每小题3分,共50分) 1. B 2. D 3. C 4. B 5.D 6.C 7. A 8. B 9. A 10. C 11.C 12.B 13.C 14.D 15. C 16. B 17.D 18.D 19. B 20. A 二、填空题(50分) 21.(10分,每空2分)④; ⑤; ①⑦⑧; ③⑨; ⑥ 22.(10分,前四空每空1分,后三空每空2分) (1) 或 14C (2); 产生白烟 (3)24 (4)第三周期第IVA族; (5)Fe+4H++NO3- =Fe3++NO↑+2H2O 23.(10分,最后一空2分,其他每空1分) (1)放热; (2)>; (3)①SO3; SO2; ② 可逆; ③ >; ④0.028mol∙L-1∙min-1; ⑤ 1 ⑥ 70% 24.(10分,化学方程式、离子方程式每空2分,其他每空1分) (1)分液漏斗; 排除装置中的空气(防止氧气对SO2的性质的检验产生干扰) (2)SO2; Fe+2H2SO4(浓)FeSO4+SO2↑+2H2O (3)无; 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ (4)(或 SO2+OH-=HSO3-) 25. (10分,前两空每空1分,其他每空2分) (1)石墨; -393.5kJ/mol; (2) CO2+8e-+6H2O=CH4+8OH- (3)①2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(l)△H= -305.7kJ/mol ②ABD ③ CH3CH2OH -4e-+H2O=4H++CH3COOH查看更多