- 2021-07-08 发布 |
- 37.5 KB |
- 2页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
铝的氧化物和氢氧化物教学案
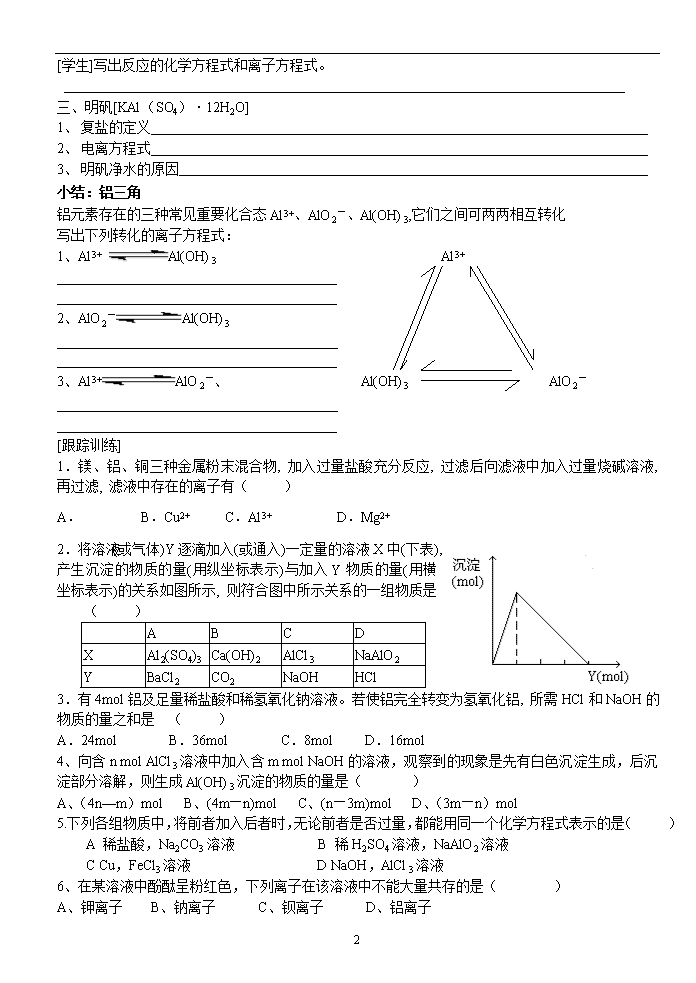
高一化学 专题三 第一单元 第二课时 铝的氧化物和氢氧化物 教学案 [教学目的]1、掌握氧化铝和氢氧化铝的性质。 2、理解两性氧化物和两性氢氧化物的定义。 [教学重点和难点]氧化铝和氢氧化铝的化学性质。 一、氧化铝(Al2O3) 1、 物理性质 氧化铝是一种白色难熔的固体,不溶于水。 [思考]联系氧化钠的化学性质,推测氧化铝的化学性质有哪些? 2、 化学性质 a、与酸的反应 [学生]写出氧化铝分别与盐酸、硫酸反应的化学方程式及离子方程式。 b、与碱的反应 [学生]写出氧化铝分别与氢氧化钠、氢氧化钾反应的化学方程式及离子方程式。 [定义]两性氧化物 c、电解 [学生]完成化学方程式 二、氢氧化铝(Al(OH)3) 1、 物理性质 氢氧化铝是一种白色固体,不溶于水,能溶于强酸和强碱,不溶于弱酸(如碳酸)和弱碱(如氨水)。 2、 化学性质 a、与酸的反应 [学生]写出氢氧化铝分别与盐酸、硫酸反应的化学方程式和离子方程式。 b、与碱的反应 [学生]写出氢氧化铝分别与氢氧化钠、氢氧化钾溶液反应的化学方程式和离子方程式。 [定义]两性氢氧化物 [解析]Al(OH)3具有两性的原因是什么? 3、 制备 法一:向AlCl3溶液中加入足量氨水 [学生]写出反应的化学方程式和离子方程式。 法二:向NaAlO2溶液中通入足量CO2 2 [学生]写出反应的化学方程式和离子方程式。 三、明矾[KAl(SO4)·12H2O] 1、 复盐的定义 2、 电离方程式 3、 明矾净水的原因 小结:铝三角 铝元素存在的三种常见重要化合态Al3+、AlO2-、Al(OH)3,它们之间可两两相互转化 写出下列转化的离子方程式: 1、Al3+ Al(OH)3 Al3+ ________________________________________ ________________________________________ 2、AlO2-Al(OH)3 ____________________________________________________________ ________________________________________ 3、Al3+AlO2-、 Al(OH)3 AlO2- ____________________________________________________________ ________________________________________ [跟踪训练] 1.镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有( ) A. B.Cu2+ C.Al3+ D.Mg2+ 2.将溶液(或气体)Y逐滴加入(或通入)一定量的溶液X中(下表), 产生沉淀的物质的量(用纵坐标表示)与加入Y物质的量(用横坐标表示)的关系如图所示, 则符合图中所示关系的一组物质是 ( ) A B C D X Al2(SO4)3 Ca(OH)2 AlCl3 NaAlO2 Y BaCl2 CO2 NaOH HCl 3.有4mol铝及足量稀盐酸和稀氢氧化钠溶液。若使铝完全转变为氢氧化铝, 所需HCl和NaOH的物质的量之和是 ( ) A.24mol B.36mol C.8mol D.16mol 4、向含n mol AlCl3溶液中加入含m mol NaOH的溶液,观察到的现象是先有白色沉淀生成,后沉淀部分溶解,则生成Al(OH)3沉淀的物质的量是( ) A、(4n—m)mol B、(4m—n)mol C、(n—3m)mol D、(3m—n)mol 5.下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个化学方程式表示的是( ) A 稀盐酸,Na2CO3溶液 B 稀H2SO4溶液,NaAlO2溶液 C Cu,FeCl3溶液 D NaOH,AlCl3溶液 6、在某溶液中酚酞呈粉红色,下列离子在该溶液中不能大量共存的是( ) A、钾离子 B、钠离子 C、钡离子 D、铝离子 2查看更多