- 2021-07-08 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习人教版铁及其化合物学案
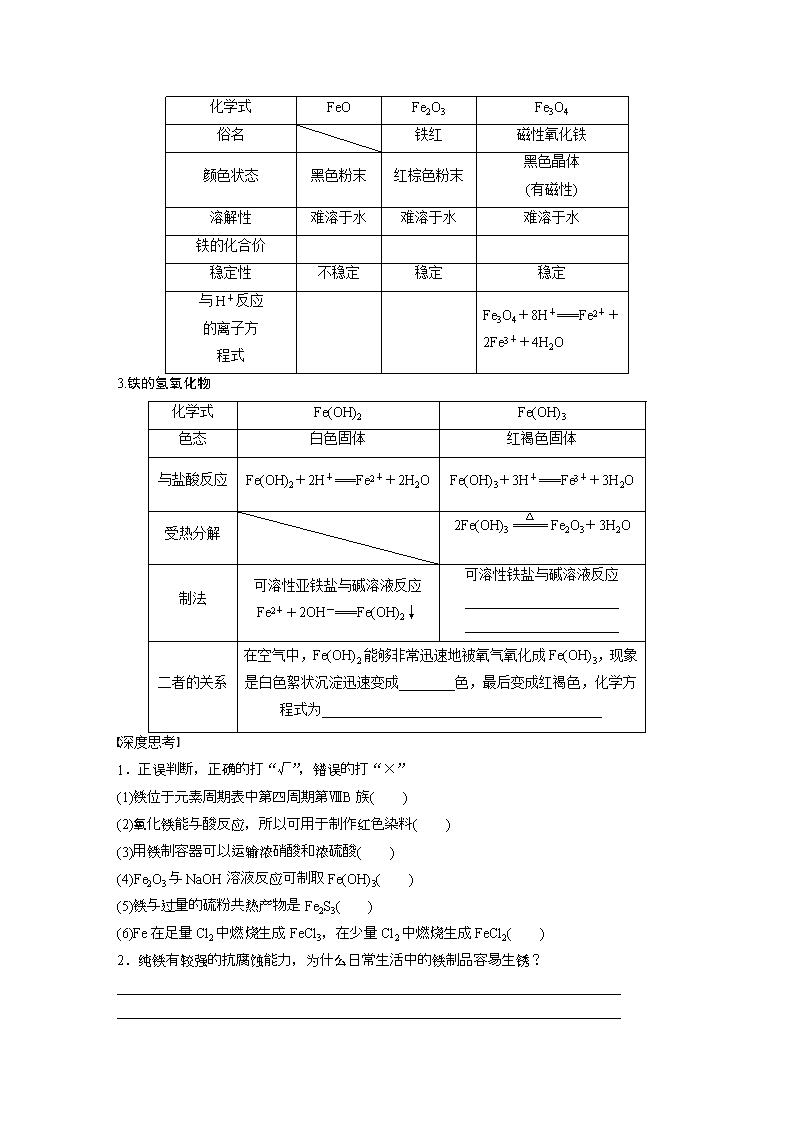
铁及其化合物 考点一 铁的单质、氧化物和氢氧化物 【基础知识梳理】 1.铁 (1)物理性质 银白色固体,熔点较高,具有良好的导热、导电、延展性,能被磁铁吸引。 (2)结构 (3)化学性质 铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。 按要求书写下列反应的方程式: ①Fe与Cl2、S反应的化学方程式: ________________________________________________________________________; ________________________________________________________________________。 ②Fe与水蒸气的反应: ________________________________________________________________________。 ③与氧化性酸(如HNO3)的反应(写离子方程式)。 Fe与过量稀HNO3的反应: ________________________________________________________________________。 Fe与少量稀HNO3的反应: ________________________________________________________________________。 ④Fe与FeCl3溶液的反应(写离子方程式): ________________________________________________________________________。 2.铁的氧化物 化学式 FeO Fe2O3 Fe3O4 俗名 铁红 磁性氧化铁 颜色状态 黑色粉末 红棕色粉末 黑色晶体 (有磁性) 溶解性 难溶于水 难溶于水 难溶于水 铁的化合价 稳定性 不稳定 稳定 稳定 与H+反应 的离子方 程式 Fe3O4+8H+===Fe2++2Fe3++4H2O 3.铁的氢氧化物 化学式 Fe(OH)2 Fe(OH)3 色态 白色固体 红褐色固体 与盐酸反应 Fe(OH)2+2H+===Fe2++2H2O Fe(OH)3+3H+===Fe3++3H2O 受热分解 2Fe(OH)3Fe2O3+3H2O 制法 可溶性亚铁盐与碱溶液反应 Fe2++2OH-===Fe(OH)2↓ 可溶性铁盐与碱溶液反应 ______________________ ______________________ 二者的关系 在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成________色,最后变成红褐色,化学方程式为________________________________________ 深度思考 1.正误判断,正确的打“√”,错误的打“×” (1)铁位于元素周期表中第四周期第ⅧB族( ) (2)氧化铁能与酸反应,所以可用于制作红色染料( ) (3)用铁制容器可以运输浓硝酸和浓硫酸( ) (4)Fe2O3与NaOH溶液反应可制取Fe(OH)3( ) (5)铁与过量的硫粉共热产物是Fe2S3( ) (6)Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2( ) 2.纯铁有较强的抗腐蚀能力,为什么日常生活中的铁制品容易生锈? ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ 3.通过化合反应能制取FeCl2、FeCl3、Fe(OH)2、Fe(OH)3吗?能制取的用化学方程式表示。 ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ 【解题探究】 题组一 铁的单质、氧化物和氢氧化物的性质 1.下列有关铁及其化合物的说法中正确的是( ) A.铁的化学性质比较活泼,所以铁在自然界中全部以化合态存在 B.铁在纯氧中燃烧或在氯气中燃烧所得产物中铁的化合价均为+3价 C.工业上可用铁质容器储存浓硝酸和浓硫酸,原因是铁在常温下与两种酸不反应 D.工业上用CO在高温条件下还原含Fe2O3的铁矿石炼铁 2.(2017·大连高三调研)在一定条件下,下列物质能与铁单质发生反应,其中能将铁元素从0价转变为+3价的是( ) A.盐酸 B.稀硫酸 C.稀硝酸 D.硫酸铜溶液 3.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣。上述沉淀和残渣分别是( ) A.Fe(OH)3 Fe2O3 B.Fe(OH)2 Fe2O3 C.Fe(OH)2 Fe(OH)3 D.Fe(OH)2 Fe3O4 题组二 用守恒思想判断氧化物的组成 4.(2016·樟树市模拟)铁的常见化合价有+2价和+3价。据研究,铁在浓HNO3中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以看作由FeO和Fe2O3组成的复杂氧化物。该化合物可以表示为( ) A.FeO·3Fe2O3 B.2FeO·3Fe2O3 C.FeO·2Fe2O3 D.2FeO·Fe2O3 5.准确称取某种铁的氧化物2.88g,用足量的CO进行还原,将生成的CO2全部用足量的澄清石灰水吸收,得到沉淀4g,则这种铁的氧化物为( ) A.Fe3O4 B.Fe2O3 C.FeO D.以上都不是 6.有一块铁的“氧化物”样品,用140mL5.0mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025molCl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为( ) A.Fe2O3B.Fe3O4C.Fe4O5D.Fe5O7 【归纳总结】 确定铁的氧化组成的基本方法 设铁的氧化物中铁元素与氧元素的质量比为m∶n, 则氧化物中n(Fe)∶n(O)=∶=a∶b, 若a∶b=1∶1,则铁的氧化物为FeO; 若a∶b=2∶3,则铁的氧化物为Fe2O3; 若a∶b=3∶4,则铁的氧化物是Fe3O4或FeO与Fe2O3按物质的量比1∶1的混合物或FeO、Fe2O3、Fe3O4的混合物(其中FeO、Fe2O3物质的量之比为1∶1,Fe3O4为任意值)。 题组三 氢氧化亚铁的制备方法 7.用下列方法可制得白色的Fe(OH)2沉淀:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。 (1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________。 (2)除去蒸馏水中溶解的O2常采用________的方法。 (3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是________________________________________ ________________________________________________________________________。 8.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是________(填序号)。 【反思归纳】 防止Fe(OH)2氧化的方法 (1)将配制溶液的蒸馏水煮沸,驱除溶液中的氧气。 (2)将盛有NaOH溶液的胶头滴管尖端插入试管的亚铁盐溶液底部,并慢慢挤出NaOH溶液。 (3)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。 (4)在亚铁盐溶液上面加保护层,如苯、植物油等。 (5)用Fe作阳极,石墨作阴极,电解NaOH溶液,利用新产生的Fe2+与OH-反应制取。 考点二 Fe2+与Fe3+的性质及检验 【基础知识梳理】 1.亚铁盐 (1)Fe2+的氧化性和还原性 含有Fe2+的溶液呈浅绿色,Fe2+处于铁的中间价态,既有氧化性,又有还原性,其中以________为主,如:遇Br2、Cl2、H2O2、NO(H+)等均表现为________。 Fe2+的酸性溶液与H2O2反应的离子方程式:__________________________________ ________________________________________________________________________。 (2)可水解 Fe(OH)2是弱碱,含Fe2+的盐(如硫酸亚铁)溶液呈酸性。配制硫酸亚铁溶液时常加少量________抑制Fe2+的水解,加少量________防止Fe2+被氧化。 2.铁盐的性质及应用 (1)氧化性:含有Fe3+的溶液呈棕黄色,Fe3+处于铁的高价态,遇Fe、Cu、HI、H2S等均表现为________。 ①Fe3+与____________________等具有较强还原性离子不能大量共存。 ②Fe3+可腐蚀印刷电路板上的铜箔,反应的离子方程式为_____________________________。 (2)易水解:Fe(OH)3是很弱的碱,且溶度积很小,因而Fe3+极易水解,只能存在于酸性较强的溶液中。 ①利用Fe3+易水解的性质,实验室可用FeCl3滴入沸水中制取氢氧化铁胶体,反应的化学方程式:________________________________________________________________________ ________________________________________________________________________。 ②利用Fe3+易水解的性质,工业上常用调节pH方法除去溶液中的铁离子。 ③利用Fe3+易水解的性质,实验室配制氯化铁溶液,通常将氯化铁固体先溶于较浓的盐酸中,然后再稀释至所需浓度。 ④Fe3+与________________________________________________________________________等水解呈碱性的离子不能大量共存。 3.Fe2+、Fe3+的检验方法 (1)用KSCN溶液和氯水 (2)用NaOH溶液 (3)含Fe2+、Fe3+的混合溶液中Fe3+、Fe2+的检验 溶液变红色,说明含有Fe3+ KMnO4溶液紫红色褪去,说明含有Fe2+。 (4)Fe2+的特征检验方法 溶液产生蓝色沉淀,说明溶液中含有Fe2+,3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓ 4.含Fe2+、Fe3+的除杂问题 主要成分 杂质 除杂方法 FeCl3(aq) FeCl2(aq) 加入氯水或H2O2 FeCl2(aq) FeCl3(aq) 加过量铁粉后过滤 FeCl2(aq) CuCl2(aq) 加过量铁粉后过滤 【解题探究】 题组一 含铁物质的除杂问题 1.硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列物质中的( ) A.锌粉 B.镁粉 C.铁粉 D.铝粉 2.下列除杂的操作不正确的是( ) A.MgCl2溶液中混有少量FeCl3:加入足量镁充分反应后过滤 B.FeCl2溶液中混有少量FeCl3:加入过量铁粉充分反应后过滤 C.CuCl2溶液中混有少量FeCl3:加入NaOH溶液充分反应后过滤 D.CuCl2溶液中混有少量FeCl2:先加入H2O2将Fe2+氧化成Fe3+,再加入CuO充分反应后过滤 3.Fe2+、Fe3+、Zn2+较完全地形成氢氧化物沉淀的pH分别为6.7、3.7、4.6。某硫酸锌酸性溶液中含有少量Fe2+、Fe3+杂质离子,为除去这些离子制得纯净的ZnSO4,应加入的试剂是( ) A.NaOH溶液 B.氨水 C.KMnO4、ZnCO3 D.H2O2、ZnO 混合溶液中Fe3+、Fe2+的除去的常用方法 (1)除去Mg2+中混有的Fe3+的方法 向混合溶液中加入Mg、MgO、MgCO3、Mg(OH)2中之一,与Fe3+水解产生的H+反应,促进Fe3+的水解,将Fe3+转化为Fe(OH)3沉淀除去。 (2)除去Cu2+中混有的Fe3+的方法 向混合溶液中加入CuO、CuCO3、Cu(OH)2、Cu2(OH)2CO3中之一,与Fe3+水解产生的H+反应,促进Fe3+的水解,将Fe3+转化为Fe(OH)3沉淀而除去。 (3)除去Mg2+中混有的Fe2+的方法 先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然后再按(1)的方法除去溶液中的Fe3+。 (4)除去Cu2+中混有的Fe2+的方法 先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然后再按(2)的方法除去溶液中的Fe3+。 题组二 Fe2+和Fe3+的检验 4.下列有关物质检验方法不合理的是( ) A.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含有Fe2+ B.用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2 C.检验绿矾晶体是否已氧化变质,可将绿矾晶体溶于稀H2SO4后滴加KSCN溶液,再观察溶液是否变红 D.向某溶液中加入NaOH溶液产生红褐色沉淀,说明溶液中含有Fe3+ 5.要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时,最佳顺序为( ) ①加入足量氯水 ②加入足量酸性KMnO4溶液 ③加入少量NH4SCN溶液 A.①③B.③②C.③①D.①②③ 6.为了证明化学反应有一定的限度,进行了如下探究活动: 探究活动一:取5mL0.1mol·L-1的KI溶液于试管,滴加0.1mol·L-1的FeCl3溶液5~6滴,振荡; 探究活动二:在上述试管中加入2mLCCl4,充分振荡、静置; 探究活动三:取上述静置分层后的上层水溶液于试管,滴加0.1mol·L-1的KSCN溶液5~6滴,振荡。 (1)写出探究活动一中反应的离子方程式___________________________________________ ________________________________________________________________________。 (2)探究活动二的实验现象为________。 a.溶液分层,上层呈紫色 b.溶液分层,下层呈紫色 c.溶液分层,均为无色 (3)在探究活动三中,可以证明该化学反应有一定的限度的实验现象是 ________________________________________________________________________。 【反思归纳】 检验Fe2+和Fe3+时的注意事项 (1)检验Fe2+时不能先加氯水后加KSCN溶液,也不能将加KSCN后的混合溶液加入到足量的新制氯水中(新制氯水能氧化SCN-)。 (2)Fe3+、Fe2+、Cl-同时存在时不能用酸性KMnO4溶液检验Fe2+(Cl-能还原酸性KMnO4,有干扰)。 (3)检验Fe2+、Fe3+的其他方法 检验Fe3+也可用苯酚(C6H5OH),在FeCl3溶液中滴加苯酚,溶液显紫色。 考点三 铁及其化合物转化关系及应用 【基础知识梳理】 “铁三角”的转化关系 完成下列变化的离子方程式,体会Fe2+与Fe3+转化条件。 (1)将H2S气体通入FeCl3溶液中产生淡黄色沉淀: ________________________________________________________________________。 (2)将FeCl3溶液滴入KI淀粉溶液,溶液变蓝: ________________________________________________________________________。 (3)FeCl3可溶解铁片: ________________________________________________________________________。 (4)FeSO4可使酸性KMnO4溶液褪色: ________________________________________________________________________ ________________________________________________________________________。 (5)将FeCl2溶液滴入到HNO3溶液中,有无色气体放出: ________________________________________________________________________ ________________________________________________________________________。 【解题探究】 题组一 化学反应中铁元素价态的判断 1.(2016·荆门高三上学期期末)在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是( ) A.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+ B.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含Cu2+和Fe3+ C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+ D.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和 Fe3+ 2.在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示。请将正确答案的序号填在相应的横线上。 ①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+ (1)AB段铁元素以__________形式存在。 (2)BC段铁元素以__________形式存在。 (3)CD段铁元素以__________形式存在。 3.向含有1molHNO3和1molH2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是( ) A.a表示Fe3+的关系曲线 B.n1=0.75 C.P点时,n(Fe2+)=0.5625mol D.向P点溶液中加入铜粉,最多可溶解14.4g 【反思归纳】 1.铁与稀硝酸反应产物中铁元素价态的判断方法 (1)当HNO3过量时: 反应原理:Fe+4HNO3===Fe(NO3)3+NO↑+2H2O,铁元素的存在形式为Fe3+,铁元素的价态为+3价。 (2)当Fe过量时:铁被硝酸氧化为Fe3+,然后Fe3+被剩余的铁还原为Fe2+,也就是说最终得到亚铁盐,总方程式:3Fe+8HNO3===3Fe(NO3)2+2NO↑+4H2O。 (3)当<<时: 铁元素的存在形式为Fe2+和Fe3+,铁元素的价态为+2、+3价。 (4)用数轴法表示,铁与硝酸的用量比与反应产物的关系: 2.铁与硫酸、硝酸的混酸反应顺序总结 足量铁与稀硫酸、稀硝酸的混合溶液反应,则可利用离子反应分析,依次发生反应:Fe+NO+4H+===Fe3++NO↑+2H2O、2Fe3++Fe===3Fe2+、Fe+2H+===Fe2++H2↑(若H+量不足,该反应不再发生)。 题组二 “铁三角”在物质转化推断题中的应用 4.(2016·沈阳东北育才中学模拟)如图是物质间发生化学反应时颜色的变化情况,下列选项中正确的是( ) 选项 M N P Q A NH3·H2O Ba(OH)2 铜 石蕊溶液 B Na BaCl2 FeO KSCN溶液 C NaOH Ba(NO3)2 锌粉 KSCN溶液 D NaHCO3 MgCl2 Fe 石蕊溶液 5.A、B、C三种物质中均含有同一种元素M,它们之间有如图所示的转化关系。A为一种金属单质,其产量直接关系国民经济命脉。反应①②③均为化合反应,反应④为置换反应。下列有关说法不正确的是( ) A.①中所加试剂可能是氯气 B.③中需要加具有氧化性的试剂 C.A与稀硝酸反应一定能实现元素M在①中发生的价态变化 D.元素M在②中发生的价态变化也能通过加碘化钾溶液实现 【反思归纳】 铁及其化合物性质的综合考查常常涉及价态、物质盐、碱、氧化物之间的转化关系,不同价态的Fe2+、Fe3+间的转化和离子检验等,解答时应联系常见铁的化合物的颜色、氧化还原反应知识、水解平衡等分析回答。 答案精析 考点一 基础知识梳理 1.(3)①2Fe+3Cl22FeCl3 Fe+SFeS ②3Fe+4H2O(g)Fe3O4+4H2 ③Fe+NO+4H+===Fe3++NO↑+2H2O 3Fe+2NO+8H+===3Fe2++2NO↑+4H2O ④Fe+2Fe3+===3Fe2+ 2.(从左到右,从上到下)+2 +3 +2,+3 FeO+2H+===Fe2++H2O Fe2O3+6H+===2Fe3++3H2O 3.Fe3++3OH-===Fe(OH)3↓ 灰绿 4Fe(OH)2+O2+2H2O===4Fe(OH)3 深度思考 1.(1)× (2)× (3)√ (4)× (5)× (6)× 2.日常生活中的铁制品中的铁通常含有杂质碳,在潮湿的空气中易发生原电池反应(电化学腐蚀),生成氧化铁的水合物。 3.FeCl2、FeCl3和Fe(OH)3均能通过化合反应制取,而Fe(OH)2则不能。 FeCl2:2FeCl3+Fe===3FeCl2 FeCl3:①2Fe+3Cl22FeCl3 ②2FeCl2+Cl2===2FeCl3 Fe(OH)3:4Fe(OH)2+O2+2H2O===4Fe(OH)3 解题探究 1.D 2.C 3.B [铁与稀硫酸反应生成FeSO4,再与过量氨水反应生成白色沉淀Fe(OH)2,在空气中加热Fe(OH)2,铁元素被氧化为+3 价,最后所得红棕色残渣为Fe2O3。] 4.B [化合物Fe8O11可以看作由FeO和Fe2O3组成的复杂氧化物,设化学式为nFeO·mFe2O3,则 解得n=2,m=3,该化合物可以表示为2FeO·3Fe2O3。] 5.C [4gCaCO3沉淀的物质的量为0.04mol,则CO、CO2的物质的量也为0.04mol,增加的氧元素为0.04mol,质量为0.04mol×16g·mol-1=0.64g,铁的氧化物中氧元素质量为0.64g,铁元素质量为2.88g-0.64g=2.24g,铁的氧化物中铁元素与氧元素物质的量之比为∶=1∶1,则铁的化学式为FeO。] 6.D [根据2Fe2++Cl2===2Fe3++2Cl-,可知铁的“氧化物”样品用盐酸溶解后所得溶液中n(Fe2+)=0.025 mol×2=0.05 mol,根据电荷守恒得2n(Fe2+)+3n(Fe3+)=n(Cl-),则n(Fe3+)=0.2 mol,故n(Fe2+)∶n(Fe3+)=0.05∶0.2=1∶4,故该氧化物可表示为FeO·2Fe2O3,即Fe5O7。] 7.(1)稀硫酸、铁屑 (2)加热煮沸 (3)避免生成的Fe(OH)2与氧气接触而被氧化 8.①②③⑤ 解析 因为Fe(OH)2在空气中很容易被氧化为红褐色的Fe(OH)3,即4Fe(OH)2+O2+2H2O===4Fe(OH)3,因此要较长时间看到Fe(OH)2白色沉淀,就要排除装置中的氧气或空气。①、②原理一样,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;③的原理为铁作阳极产生Fe2+,与电解水产生的OH-结合生成Fe(OH)2,且液面用汽油保护,能防止空气进入;⑤中液面加苯阻止了空气进入;④由于带入空气中的氧气能迅速将Fe(OH)2氧化,因而不能较长时间看到白色沉淀。 考点二 基础知识梳理 1.(1)还原性 还原性 2Fe2++H2O2+2H+===2Fe3++2H2O (2)硫酸 铁屑 2.(1)氧化性 ①S2-、I-、HS-、SO ②2Fe3++Cu===Cu2++2Fe2+ (2)①FeCl3+3H2OFe(OH)3(胶体)+3HCl ④HCO、AlO、CO、ClO- 解题探究 1.C 2.C 3.D [由于Fe2+沉淀所需pH比Zn2+大,应首先将Fe2+氧化为Fe3+,然后调节溶液的pH使Zn2+还不沉淀时Fe3+已沉淀完全。氧化剂H2O2将Fe2+氧化为Fe3+,ZnO能消耗溶液中的H+且不引入新的杂质离子,故D项符合要求。] 4.B [B项中的Cl-也能使酸性KMnO4溶液褪色。] 5.C [在该溶液中先加入少量NH4SCN溶液,溶液不变红色,证明无Fe3+存在,再加入氯水,将Fe2+氧化成Fe3+,溶液变为红色。KMnO4溶液呈紫红色,溶液颜色变化不明显,所以不能用酸性KMnO4溶液检验。] 6.(1)2Fe3++2I-2Fe2++I2 (2)b (3)溶液变红色 解析 (2)碘溶于水呈棕黄色,CCl4能萃取水中的碘,液体呈紫色,由于CCl4的密度比水大而且难溶于水,所以碘的四氯化碳溶液在下层,则实验现象为溶液分层,下层呈紫色,b正确。 (3)取上述静置分层后的上层水溶液于试管中,滴加0.1mol·L-1的KSCN溶液5~6滴,Fe3+可与KSCN反应显红色,若溶液变红色,说明溶液中有铁离子存在,则说明铁离子没有完全反应,即该化学反应有一定的限度。 考点三 基础知识梳理 (1)H2S+2Fe3+===S↓+2Fe2++2H+ (2)2I-+2Fe3+===I2+2Fe2+ (3)2Fe3++Fe===3Fe2+ (4)5Fe2++MnO+8H+===5Fe3++Mn2++4H2O (5)3Fe2++NO+4H+===3Fe3++NO↑+2H2O 解题探究 1.D 2.(1)① (2)④ (3)③ 解析 向稀HNO3中加入铁粉,开始时稀HNO3过量应生成Fe3+,随加入铁粉量的增加,HNO3反应完全后,发生反应2Fe3++Fe===3Fe2+,最后全部转化为Fe2+。 3.C [该反应可以看作两步:①Fe+4H++NO===Fe3++NO↑+2H2O,硝酸根过量,氢离子不足;②2Fe3++Fe===3Fe2+。a表示Fe3+的关系曲线,故A正确;溶液中共有3molH+参加反应,消耗铁为0.75mol,B正确;P点n(Fe2+)=n(Fe3+),二者均为0.45mol,C错误;剩余0.45molFe3+,消耗0.225mol铜,质量为14.4g,D正确。] 4.C 5.C查看更多