- 2021-07-08 发布 |
- 37.5 KB |
- 77页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
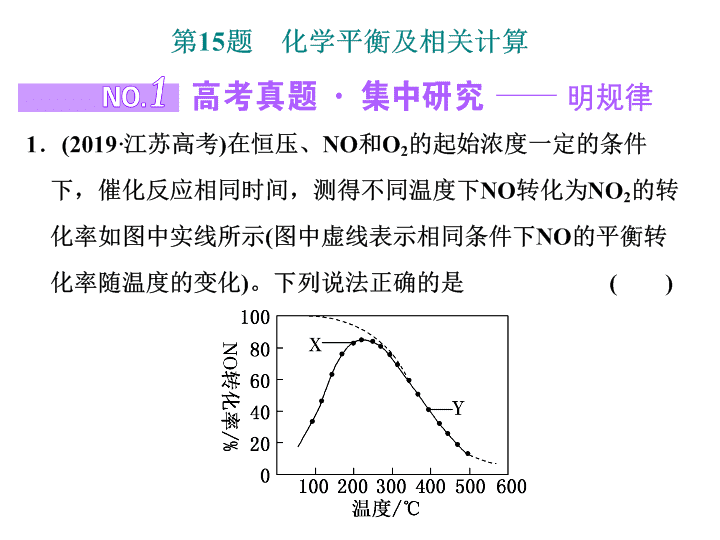
2020届二轮复习化学平衡及相关计算课件(77张)(江苏专用)
容器 1 容器 2 容器 3 反应温度 T /K 700 700 800 反应物投入量 2 mol SO 2 、 1 mol O 2 4 mol SO 3 2 mol SO 2 、 1 mol O 2 平衡 v 正 (SO 2 ) /mol·L - 1 ·s - 1 v 1 v 2 v 3 平衡 c (SO 3 )/mol·L - 1 c 1 c 2 c 3 平衡体系总压强 p /Pa p 1 p 2 p 3 物质的平衡转化率 α α 1 (SO 2 ) α 2 (SO 3 ) α 3 (SO 2 ) 平衡常数 K K 1 K 2 K 3 容器编号 物质的起始浓度 ( mol·L - 1 ) 物质的平衡浓度 ( mol·L - 1 ) c (NO 2 ) c (NO ) c (O 2 ) c (O 2 ) Ⅰ 0.6 0 0 0.2 Ⅱ 0.3 0.5 0.2 Ⅲ 0 0.5 0.35 容器 温度 /K 物质的起始浓度 /( mol·L - 1 ) 物质的平衡浓度 /( mol·L - 1 ) c (H 2 ) c (CO ) c (CH 3 OH) c (CH 3 OH) Ⅰ 400 0.20 0.10 0 0.080 Ⅱ 400 0.40 0.20 0 Ⅲ 500 0 0 0.10 0.025 反应的热效应 温度变化 K 的变化 反应的热效应 温度 变化 K 的 变化 吸热反应 升温 变大 放热反应 升温 减小 降温 减小 降温 变大 实验 编号 NH 3 的 平衡浓度 / mol·L - 1 反应的能量变化 体系压强 /Pa 反应物转 化率 实验 1 1 mol 3 mol 0 c 1 放出 a kJ p 1 α 1 实验 2 0 0 2 mol c 2 吸收 b kJ p 2 α 2 实验 3 0 0 4 mol c 3 吸收 c kJ p 3 α 3 容器 编号 温度 / ℃ 起始物质的量 /mol 平衡物质的量 /mol CH 3 OH(g) CH 3 OCH 3 (g) H 2 O(g) Ⅰ 387 0.20 0.080 0.080 Ⅱ 387 0.40 Ⅲ 207 0.20 0.090 0.090 容器 时间 / min n (NO 2 )/mol 温度 /K 0 t 1 t 2 t 3 t 4 Ⅰ T 1 1.0 0.65 0.4 0.2 0.2 Ⅱ T 2 1.0 0.6 0.33 0.3 t /s 0 50 150 250 350 n (PCl 3 )/mol 0 0.16 0.19 0.20 0.20 容器 甲 乙 丙 容积 /L 0.5 0.5 V 温度 / ℃ T 1 T 2 T 1 起始量 1 mol C(s) 1 mol H 2 O(g) 1 mol CO(g) 1 mol H 2 (g) 3 mol C(s) 2 mol H 2 O(g) 容器 容器类型 初始体积 反应物投入量 /mol 反应物的平衡转化率 α 平衡时 C 的物质的量 /mol 平衡常数 K A B C Ⅰ 恒温恒容 1 L 1 3 0 α 1 (A) 1.2 K 1 Ⅱ 绝热恒容 1 L 0 0 2 α 2 (C) x K 2 Ⅲ 恒温恒压 2 L 2 6 0 α 3 (A) y K 3 容器 容积 /L 温度 / ℃ 起始量 /mol 平衡量 /mol 平衡 常数 C(s ) H 2 O(g) H 2 (g) 甲 2 T 1 2.0 4.0 3.2 K 1 乙 1 T 2 1.0 2.0 1.2 K 2 容器 起始物质的量 /mol CH 4 的平衡转化率 CH 4 H 2 O CO H 2 Ⅰ 0.1 0.1 0 0 50% Ⅱ 0.1 0.1 0.1 0.3 Ⅲ 0 0.1 0.2 0.6 时间 /min 0 10 20 40 50 T 1 n (CH 4 )/mol 0.50 0.35 0.25 0.10 0.10 T 2 n (CH 4 )/mol 0.50 0.30 0.18 … 0.15 容器 物质的起始浓度 /( mol·L - 1 ) 物质的平衡浓度 c (H 2 ) c (I 2 ) c (HI ) Ⅰ ( 恒容 ) 0.1 0.1 0 c (I 2 ) = 0.07 mol·L - 1 Ⅱ ( 恒压 ) 0 0 0.6 谢谢观看查看更多