- 2021-07-08 发布 |
- 37.5 KB |
- 26页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习电化学课件(26张)(广西专用)
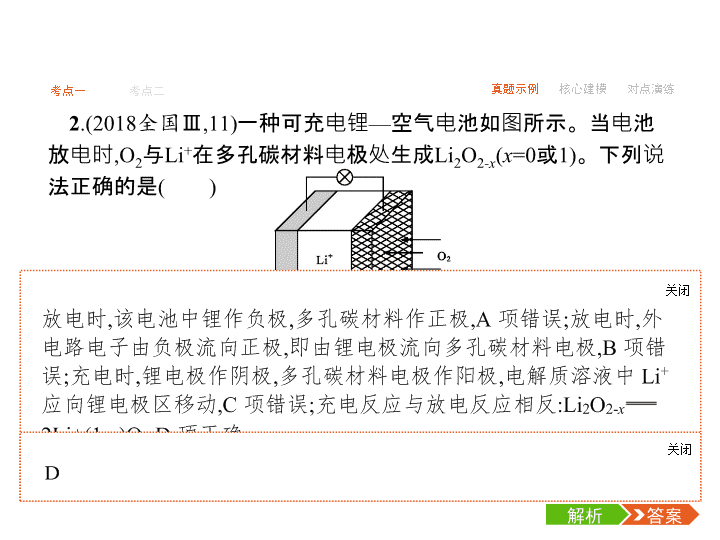
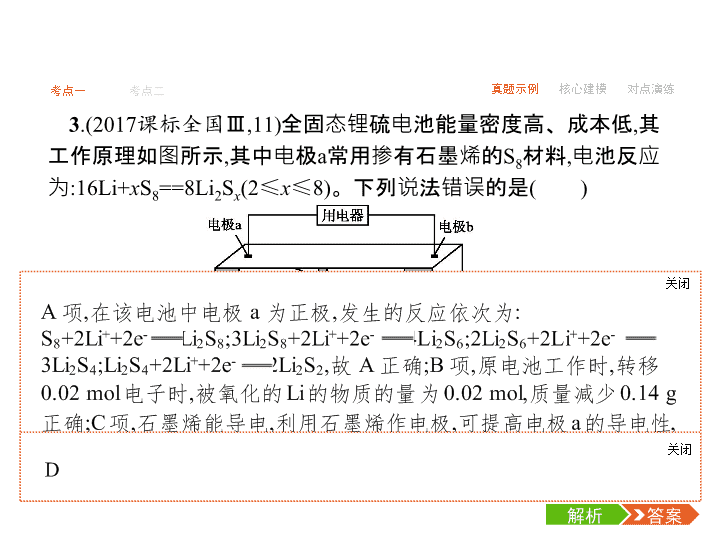
-1- 考点一 考点二 真题示例 核心建模 对点演练 考点一 原电池 1.(2018全国Ⅱ,12)我国科学家研发了一种室温下“可呼吸”的Na- CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳 米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na 2Na2CO3+C,下列说法错误的是( ) 答案解析解析 关闭 答案解析 关闭 -2- 考点一 考点二 真题示例 核心建模 对点演练 2.(2018全国Ⅲ,11)一种可充电锂—空气电池如图所示。当电池 放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说 法正确的是( ) A.放电时,多孔碳材料电极为负极 B.放电时,外电路电子由多孔碳材料电极流向锂电极 C.充电时,电解质溶液中Li+向多孔碳材料区迁移 答案解析解析 关闭 答案解析 关闭 -3- 考点一 考点二 真题示例 核心建模 对点演练 3.(2017课标全国Ⅲ,11)全固态锂硫电池能量密度高、成本低,其 工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应 为:16Li+xS8==8Li2Sx(2≤x≤8)。下列说法错误的是( ) A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-==3Li2S4 B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g C.石墨烯的作用主要是提高电极a的导电性 D.电池充电时间越长,电池中Li2S2的量越多 答案解析解析 关闭 答案解析 关闭 -4- 考点一 考点二 真题示例 核心建模 对点演练 B -5- 考点一 考点二 真题示例 核心建模 对点演练 C -6- 考点一 考点二 真题示例 核心建模 对点演练 6.(2015课标全国Ⅱ,26节选)酸性锌锰干电池是一种一次性电池, 外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和 NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。 (1)该电池的正极反应式为 。 (2)维持电流强度为0.5 A,电池工作5分钟,理论上消耗锌 g。 (已知F=96 500 C·mol-1) -7- 考点一 考点二 真题示例 核心建模 对点演练 1.原电池工作原理示意图 -8- 考点一 考点二 真题示例 核心建模 对点演练 2.原电池电极名称判断“六法” 方法一:根据两极材料判断。一般活泼金属为负极,活泼性较弱 的金属或能导电的非金属为正极。 方法二:根据电极反应现象判断。一般情况下电极逐渐溶解的为 负极,电极增重或放出气体的为正极。 方法三:根据电子移动方向来判断。电子流出的为负极、电子流 入的为正极或电流流出的为正极、电流流入的为负极。 方法四:根据原电池里电解质溶液中离子的定向移动方向判断。 阴离子流向负极、阳离子流向正极。 方法五:根据原电池两极发生的变化来判断。失去电子发生氧化 反应的是负极、得到电子发生还原反应的是正极。 -9- 考点一 考点二 真题示例 核心建模 对点演练 方法六:根据电解质溶液来判断电极。能与电解质溶液反应的电 极为负极,不能与电解质溶液反应的电极为正极。例如:镁、铝为 电极,氢氧化钠溶液为电解质溶液,虽然镁比铝活泼,但是由于镁不 与氢氧化钠溶液反应,而铝能与氢氧化钠溶液反应,所以铝为负极、 镁为正极。 -10- 考点一 考点二 真题示例 核心建模 对点演练 答题模板1.有关原电池解题的思维路径 2.书写原电池电极反应式的三个步骤 (1)列物质标得失:按照负极发生氧化反应,正极发生还原反应,判 断出电极反应物和产物,找出得失电子的数量。 (2)看环境配守恒:电极产物在电解质溶液的环境中,应能稳定存 在,如碱性介质中生成的H+应让其结合OH-生成水。电极反应式要 遵守电荷守恒、质量守恒和得失电子守恒等,并加以配平。 (3)两式加验总式:两电极反应式相加,与总反应方程式对照验证。 -11- 考点一 考点二 真题示例 核心建模 对点演练 1.(2018浙江绍兴诸暨中学模拟)如图所示是一种酸性燃料电池酒 精检测仪,具有自动吹气流量检测与控制的功能,非常适合进行现场 酒驾检测。下列说法不正确的是( ) A.电流由O2所在的铂电极流出 B.O2所在的铂电极处发生还原反应 C.该电池的负极反应式为CH3CH2OH+3H2O-12e- 2CO2↑+12H+ D.微处理器通过检测电流大小可计算出被测气体中酒精的含量 答案解析解析 关闭 答案解析 关闭 -12- 考点一 考点二 真题示例 核心建模 对点演练 答案解析解析 关闭 正极发生还原反应,电极反应方程式为PbSO4+2e-+2Li+==Li2SO4+Pb,A 错误。放电过程中Li+向正极移动,B错误。常温下,电解质不是熔融态, 离子不能移动,不能产生电流,因此连接电流表或检流计,指针不偏转,C 错误。根据电极方程式PbSO4+2e-+2Li+==Li2SO4+Pb,可知每转移0.1 mol电子,理论上生成0.05 mol Pb,质量为10.35 g,D正确。 答案解析 关闭 D -13- 考点一 考点二 真题示例 核心建模 对点演练 答案解析解析 关闭 正极发生反应为H2O2+2e-==2OH-,A正确。放电时为原电池,阳离子移 向正极,b为正极,B正确。电子由负极经外电路流向正极,应该由a到b,C 错误。正极电极反应式为H2O2+2e-==2OH-,产生的氢氧化钠溶液可以 循环使用,D正确。 答案解析 关闭 C -14- 考点一 考点二 真题示例 核心建模 对点演练 4.已知:电池的理论比能量指单位质量的电极材料理论上能释放出 的最大电能。镁—空气电池的总反应方程式为2Mg+O2+2H2O 2Mg(OH)2,其工作原理如图所示。 下列说法不正确的是( ) A.该电池的放电过程的正极反应为O2+2H2O+4e- 4OH- B.为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 C.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有 利于氧气扩散至电极 D.与铝—空气电池相比,镁—空气电池的比能量更高 答案解析解析 关闭 答案解析 关闭 考点二 电解池 1.(2018全国Ⅰ,13)最近我国科学家设计了一种CO2+H2S协同转 化装置,实现对天然气中CO2和H2S的高效去除。示意图如下所示, 其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨 烯电极区发生反应为: -15- 真题示例 核心建模 对点演练考点一 考点二 -16- 真题示例 核心建模 对点演练考点一 考点二 答案解析解析 关闭 答案解析 关闭 -17- 真题示例 核心建模 对点演练考点一 考点二 2.(2017课标全国Ⅰ,11)支撑海港码头基础的钢管桩,常用外加电 流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰 性辅助阳极。下列有关表述不正确的是( ) A.通入保护电流使钢管桩表面腐蚀电流接近于零 B.通电后外电路电子被强制从高硅铸铁流向钢管桩 C.高硅铸铁的作用是作为损耗阳极材料和传递电流 D.通入的保护电流应该根据环境条件变化进行调整 答案解析解析 关闭 外加电流的阴极保护法,使被保护的钢管桩上无腐蚀电流,A项正确;通 电后,高硅铸铁为惰性阳极,钢管桩为阴极,外电路电子从阳极流向阴极 ,B项正确;由于高硅铸铁为惰性阳极,因此应是海水中的OH-失电子 ,2H2O-4e-==O2↑+4H+,因此阳极材料不被损耗,C项错误;在外加电流的阴 极保护法中,应依据环境条件变化调整电流大小。 答案解析 关闭 C -18- 真题示例 核心建模 对点演练考点一 考点二 3.(2017课标全国Ⅱ,11)用电解氧化法可以在铝制品表面形成致 密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。 下列叙述错误的是( ) A.待加工铝质工件为阳极 B.可选用不锈钢网作为阴极 C.阴极的电极反应式为:Al3++3e-==Al D.硫酸根离子在电解过程中向阳极移动 C -19- 真题示例 核心建模 对点演练考点一 考点二 4.(2016课标全国Ⅰ,11)三室式电渗析法处理含Na2SO4废水的原 理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的 作用下,两膜中间的Na+和 可通过离子交换膜,而两端隔室中离 子被阻挡不能进入中间隔室。 下列叙述正确的是( ) A.通电后中间隔室的 向正极迁移,正极区溶液pH增大 B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 C.负极反应为2H2O-4e-O2↑+4H+,负极区溶液pH降低 D.当电路中通过1 mol电子的电量时,会有0.5 mol的O2生成 答案解析解析 关闭 答案解析 关闭 -20- 真题示例 核心建模 对点演练考点一 考点二 5.(2016课标全国Ⅰ,28节选)NaClO2是一种重要的杀菌消毒剂,也 常用来漂白织物等,其一种生产工艺如下: “电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和 Ca2+,要加入的试剂分别为 、 。“电解”中阴 极反应的主要产物是 。 答案解析解析 关闭 答案解析 关闭 -21- 真题示例 核心建模 对点演练考点一 考点二 1.电解池的电极反应及其放电顺序 (1)阳离子在阴极上的放电顺序:Ag+>Fe3+>Cu2+>H+>…… (2)阴离子在阳极上的放电顺序:S2->I->Br->Cl->OH->…… -22- 真题示例 核心建模 对点演练考点一 考点二 2.电解的四大类型及规律 -23- 真题示例 核心建模 对点演练考点一 考点二 -24- 真题示例 核心建模 对点演练考点一 考点二 方法技巧判断电解池阴阳极的“四方法” (1)根据所连接的外加电源判断,与直流电源正极相连的为阳极, 与直流电源负极相连的为阴极。 (2)根据电子流动方向判断,电子由电源负极流向阴极,由阳极流 向电源正极。 (3)根据电解池里电解质溶液中离子的移动方向判断,阳离子向阴 极移动,阴离子向阳极移动。 (4)根据电解池两极产物判断,一般情况下:①阴极上的现象是:析 出金属(质量增加)或有无色气体(H2)放出;②阳极上的现象是:有非 金属单质生成,呈气态的有Cl2、O2或电极质量减小(活性电极作阳 极)。 -25- 考点一 考点二 真题示例 核心建模 对点演练 答案解析解析 关闭 答案解析 关闭 -26- 考点一 考点二 真题示例 核心建模 对点演练 答案解析解析 关闭 放电时钠金属片,作负极,失去电子发生氧化反应,A正确。原电池中正 极上碳得到电子,则充电时碳纳米管接直流电源的正极,B正确。放电 时每消耗3 mol CO2,4 mol Na失去电子,转移4 mol电子,C错误。充电为 电解池,阳极与正极相连,阳极失去电子发生氧化反应,则阳极反应为 C+2Na2CO3-4e-==3CO2↑+4Na+,D正确。 答案解析 关闭 C查看更多